Nomenclatura alcani, cicloalcani, alogenuri alchilici

Alla fine del post trovate dei link che vi porteranno ad altri post dedicati agli esercizi sulla nomenclatura e un altro link utile…
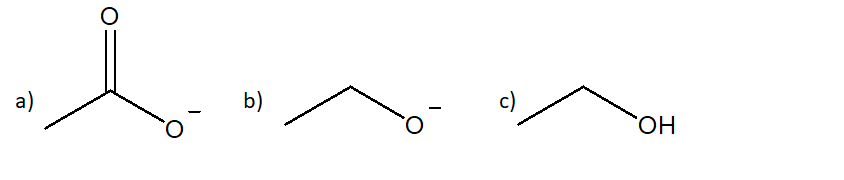
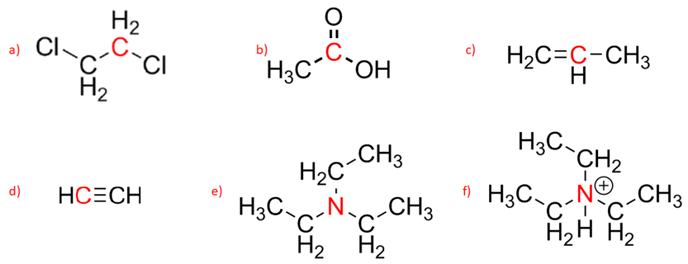
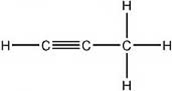
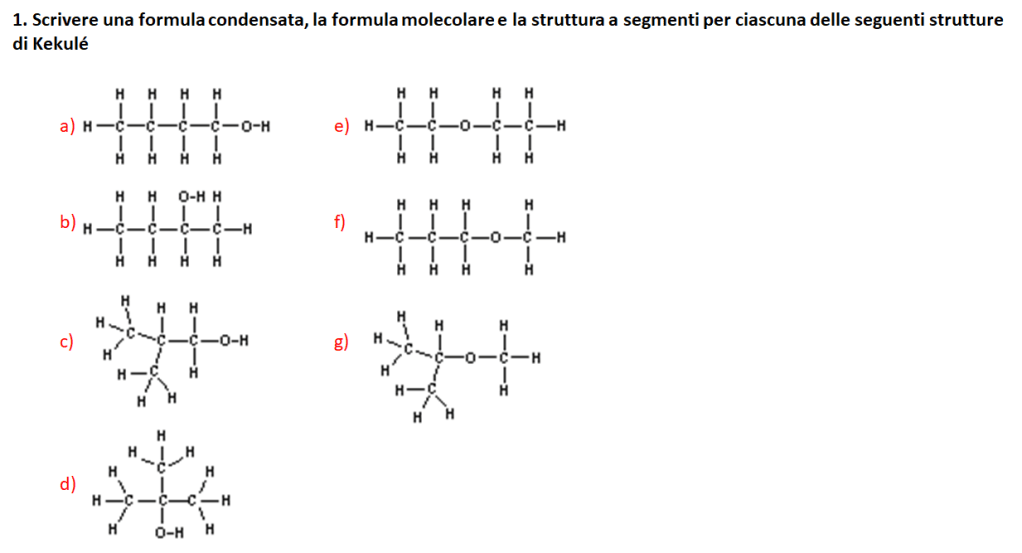
1) Assegnare il nome IUPAC ai seguenti composti:
RICORDATE DI APPLICARE LE REGOLE IUPAC AGGIORNATE PER I CICLOALCANI!

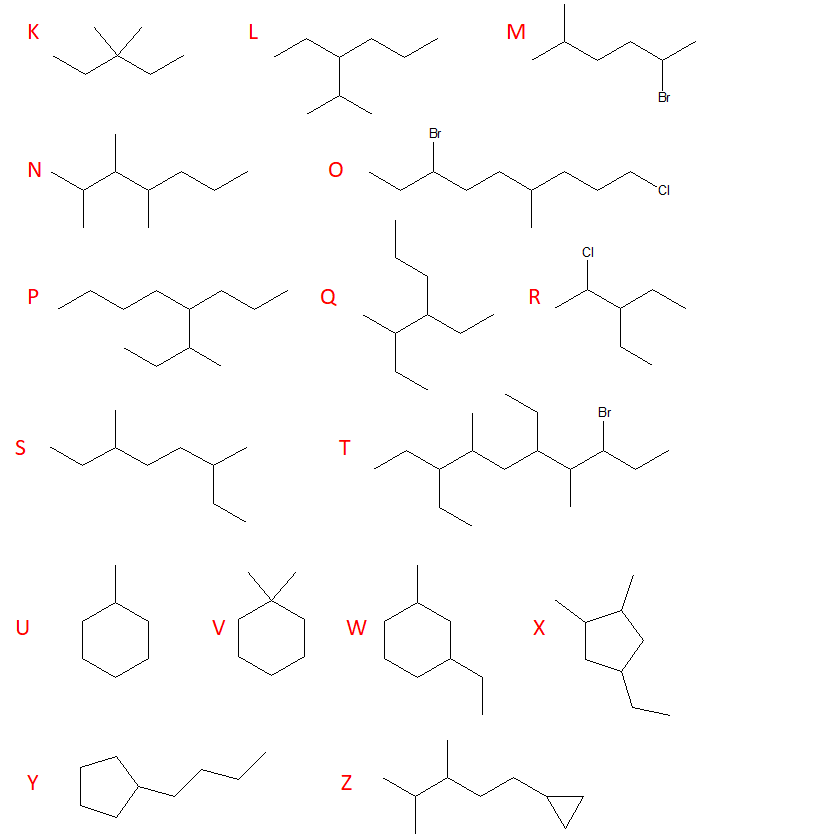
NELLA LETTERA D c’è un errore. Il carbonio bivalente non va considerato!
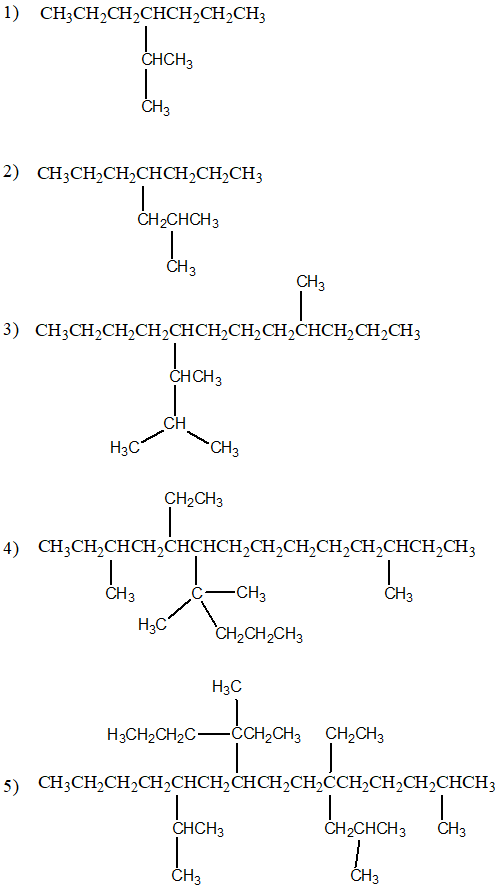
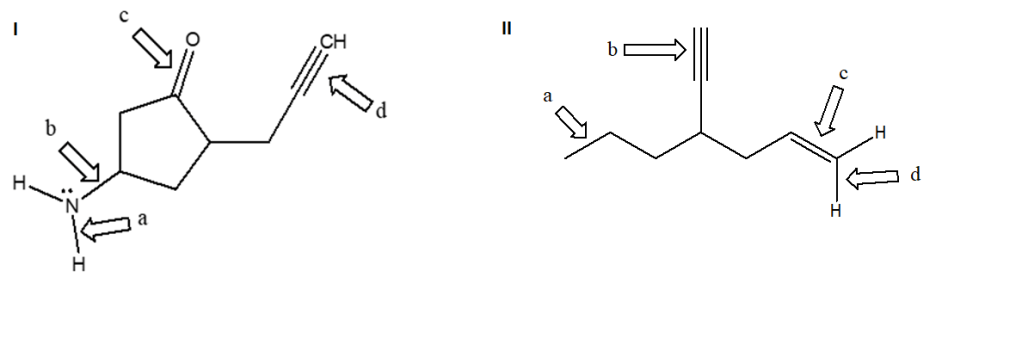
2) Per i più coraggiosi: determinare il nome sistematico del seguente composto


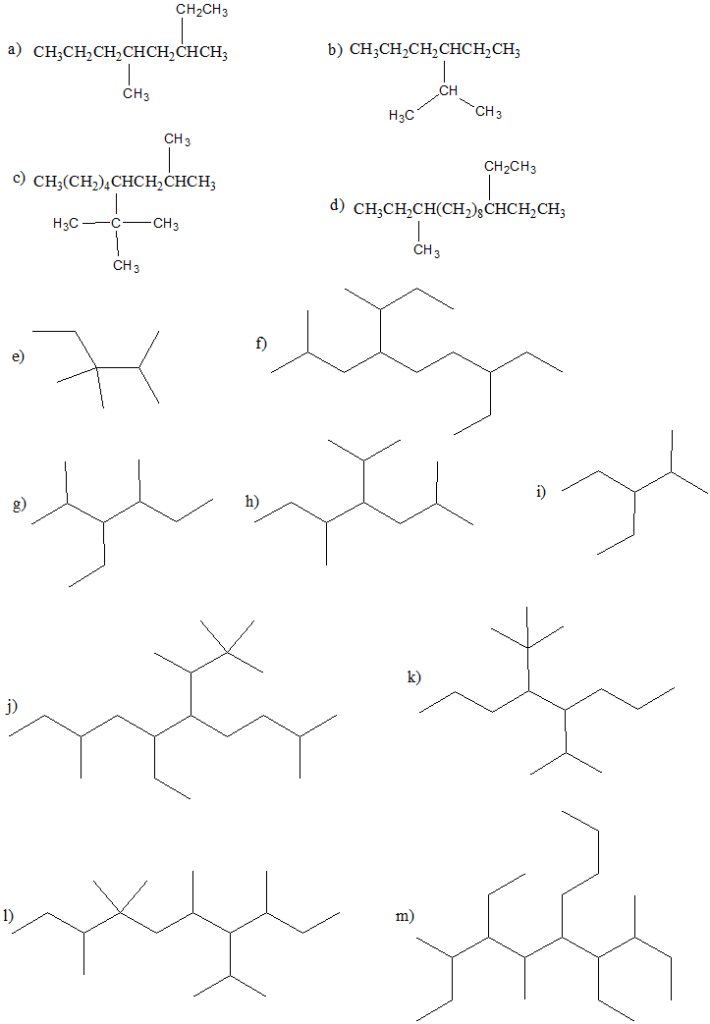
4) Dire se i seguenti nomi sono corretti. Se non lo sono, proporre il nome corretto:
a) 2-etil-6-iodo-3-metileptano
b) 3-etil-6-isobutil-2,6-trimetilnonano
5) Scrivere e assegnare il nome IUPAC ad un alcano (o cicloalcano) che abbia:
a) formula bruta C6H14 e che contenga solo idrogeni primari e terziari
b) formula bruta C5H10 e che sia costituito da due carboni primari, due terziari e un carbonio secondario
c) formula bruta C7H14 e che sia costituito da soli carboni secondari, con l’eccezione di 3 carboni dei quali 1 è quaternario e 2 sono primari.
ALTRI ESERCIZI: Nomenclatura degli alcani, Nomenclatura II
Esercizi interattivi 



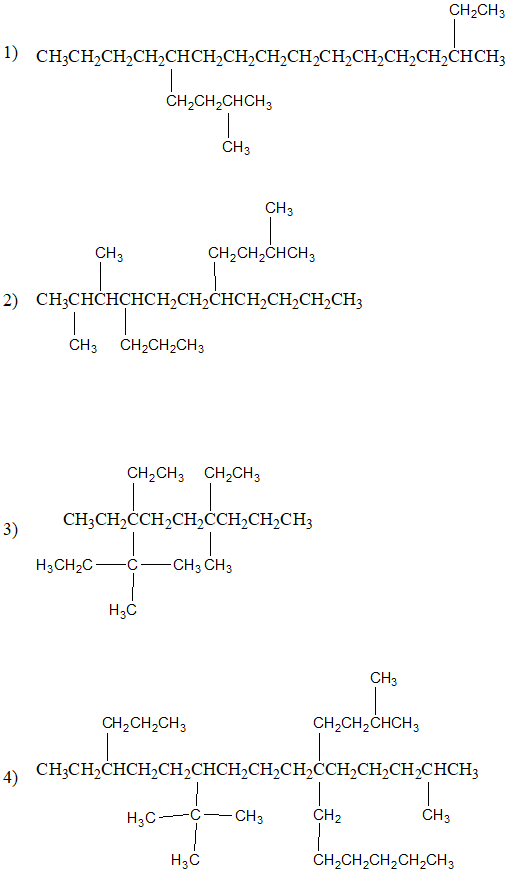





























You must be logged in to post a comment.