Calendario appuntamenti della prossima settimana

| Giorno | Ora | Evento | Aula | Note |
|---|---|---|---|---|
| 03/02 | 15:30 | PROVA SCRITTA | A1 | |
| 04/02 | 9:30 | ESAME ORALE | L |
Università degli Studi della Campania "Luigi Vanvitelli"

| Giorno | Ora | Evento | Aula | Note |
|---|---|---|---|---|
| 03/02 | 15:30 | PROVA SCRITTA | A1 | |
| 04/02 | 9:30 | ESAME ORALE | L |

Suggerimento: per poter usare questi set di esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 2 ore per ciascun set.
PRIMO SET
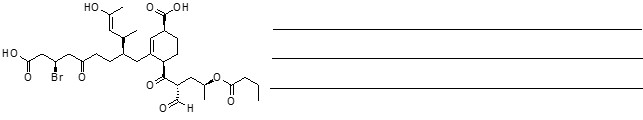
1. Assegnare il nome IUPAC, comprensivo di stereochimica, alle seguenti molecole
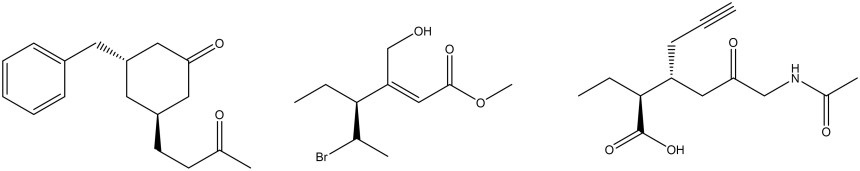
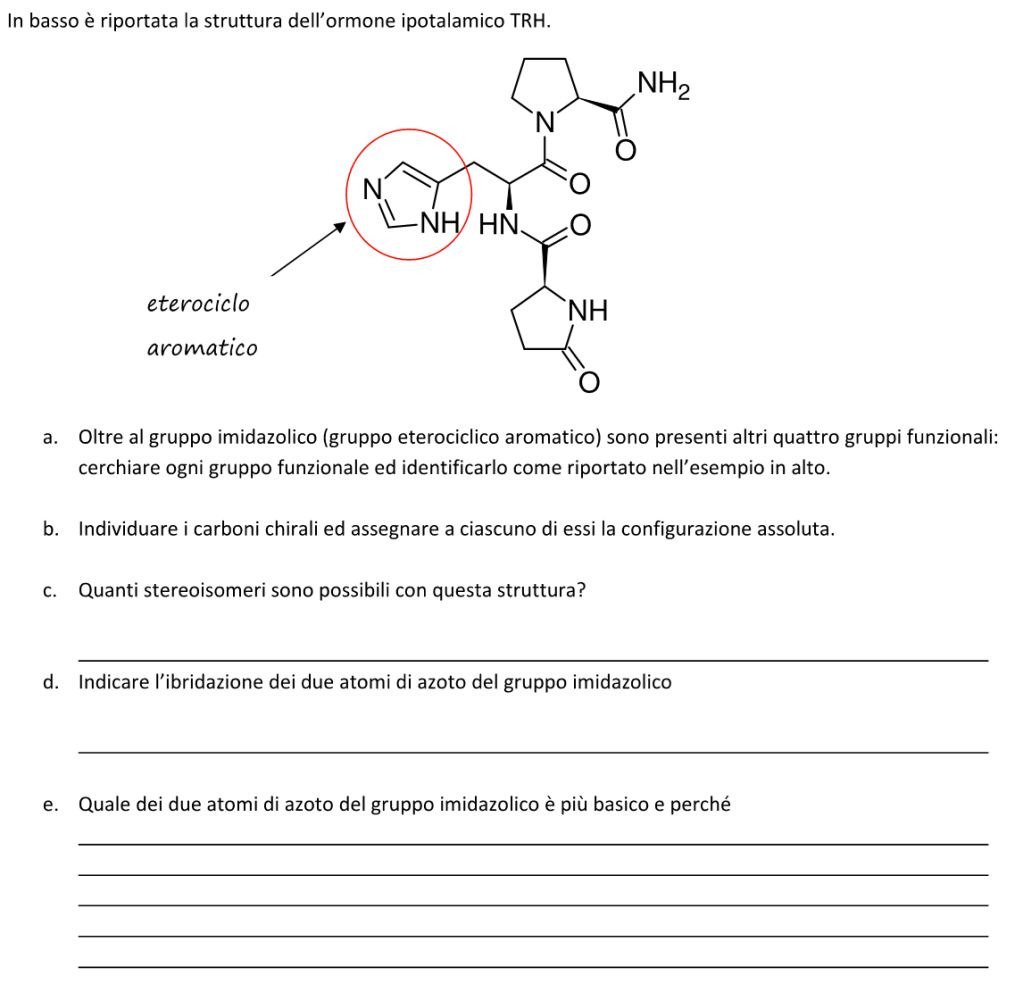
2. Rispondi alle domande sulla seguente molecola:
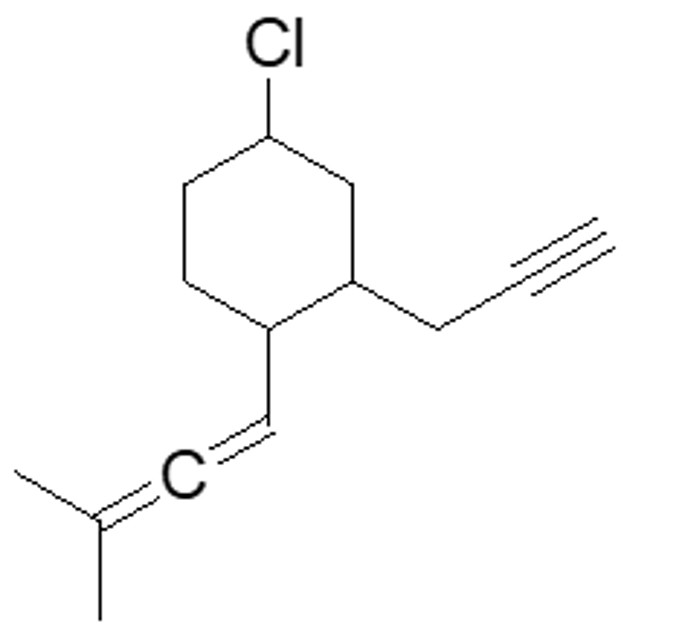
a) Come è ibridato l’atomo di cloro ____________________
b) Prendere in considerazione i doppi legami cumulati: com’è ibridato il carbonio centrale? Descrivere il tipo di legami che fa tale carbonio e gli orbitali molecolari coinvolti
c) Individuare l’idrogeno più acido in questa molecola
3.Disporre i seguenti composti in ordine di acidità crescente (dal meno acido al più acido) e spiegare sinteticamente il perché
a) CH3BrCH2SH
b) CH3CH2SH
c) CH3CH2OH
d) CH3CH2NH2
4. Il mentolo di origine naturale ha il seguente nome IUPAC: (1R,2S,5R)-2-isopropil-5-metilcicloesanolo. Qual è il nome IUPAC del suo enantiomero?
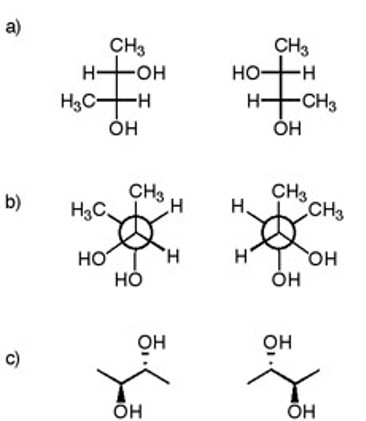
5. Dire se le seguenti coppie di composti sono enantiomeri, diastereoisomeri o lo stesso composto
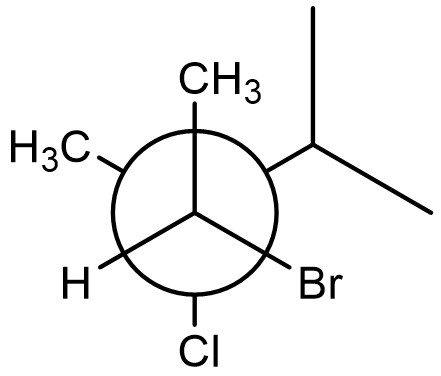
6. Scrivere a) un isomero di struttura del seguente composto, b) un diastereoisomero del seguente composto, c) l’enantiomero del seguente composto. Attribuire il nome IUPAC a ciascun di essi
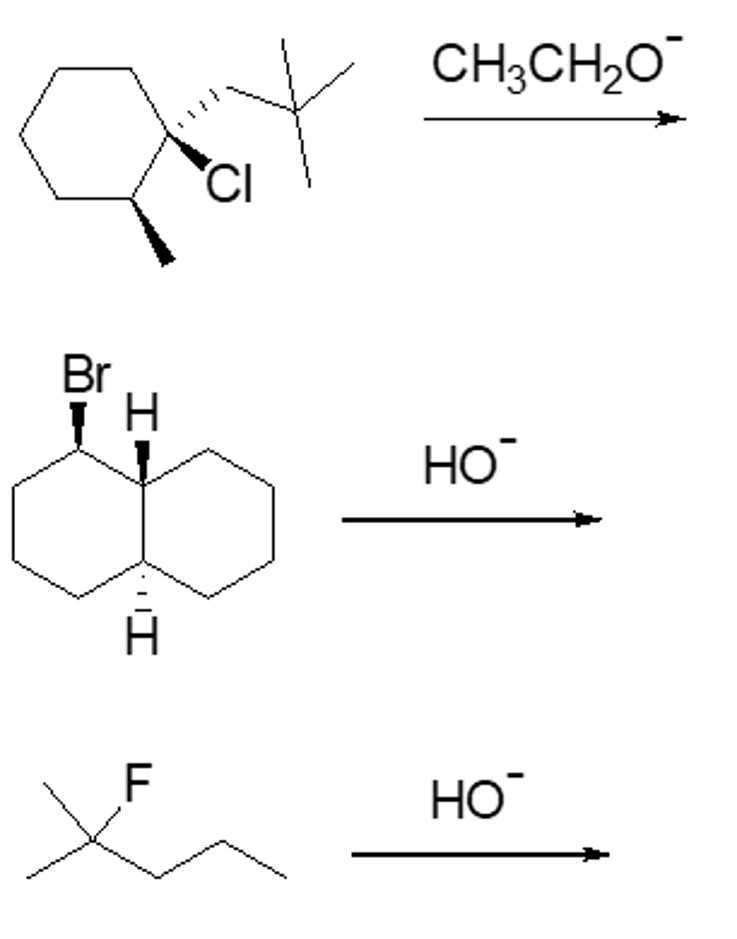
7. Proporre un meccanismo per la seguente reazione:
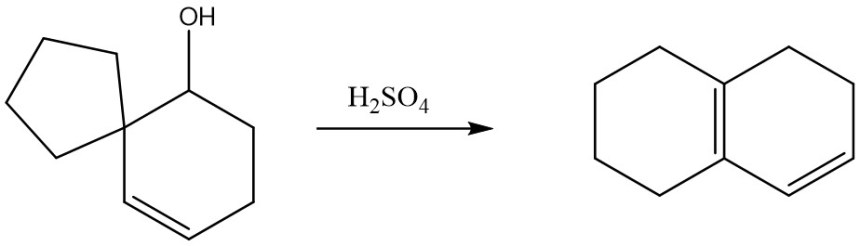
8. Chi reagirà più velocemente in una reazione E1 tra 3-bromo-3-metil-1-cicloesene e 4-bromo-4-metil-1-cicloesene? Spiegare sinteticamente perché.
9. Disporre i seguenti composti in ordine di basicità decrescente, fornire una spiegazione e dimostrare gli effetti che concorrono a determinare l’ordine indicato
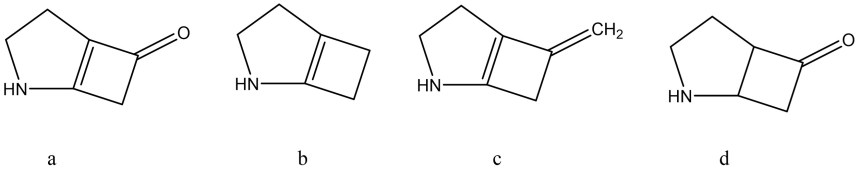
10. Quanti prodotti si formano dalla seguente reazione? Quale relazione stereochimica esiste tra questi pdotti?
11. Fornire una definizione di punto isoelettrico. Come può essere calcolato?
SECONDO SET
1. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:
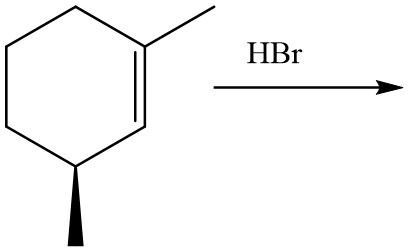
2. Disporre i seguenti composti in ordine di acidità decrescente e spiegare sinteticamente il perché
3. Partendo dall’opportuno alchene, illustrare il meccanismo di reazione della sintesi del seguente composto. Indicare eventuali altri prodotti fornendo per tutti il nome IUPAC completo di stereochimica.
4. Quale dei seguenti è un composto meso?
a) (2R,3S)-diclorobutano
b) (2R,3R)-diclorobutano
c) (2R,3S)-3-cloro-2-butanolo
d) (2R,3R)-3-cloro-2-butanolo
5. Confrontare i seguenti composti e definirne le relazioni stereochimiche. In particolare, dire se sono enantiomeri, diastereoisomeri o isomeri conformazionali.
a e b sono___________________
a e c sono___________________
b e c sono___________________
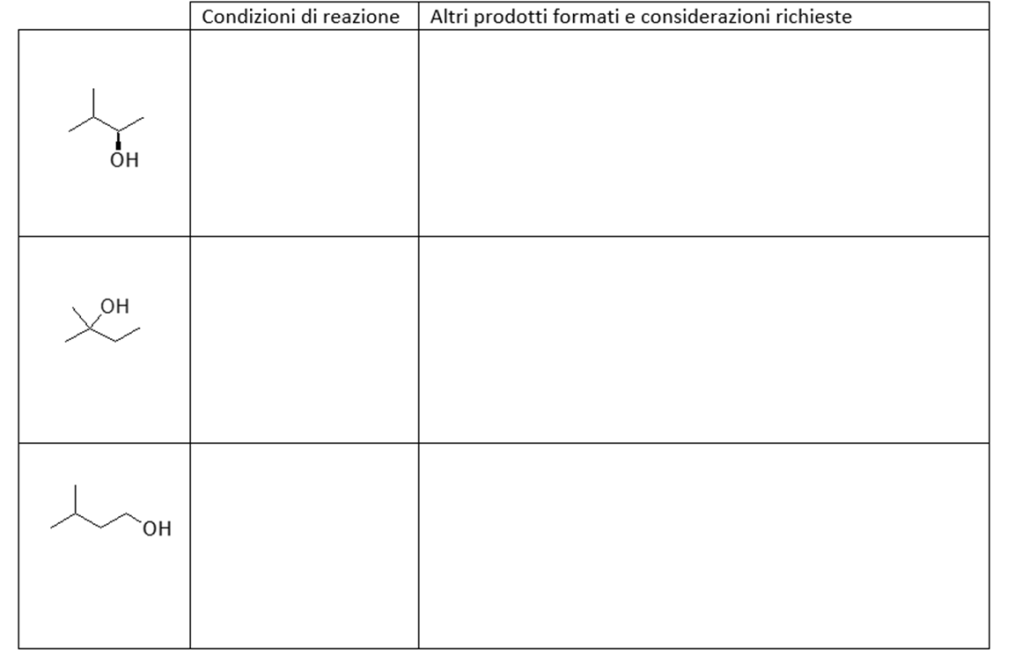
6. Indicare le condizioni ottimali per ottenere ciascuno dei seguenti composti a partire dal 3-metil-1-butene. Se quello ottenuto non è l’unico prodotto di reazione, indicare gli ulteriori altri prodotti formati, dire in che relazione sono col prodotto riportato e indicare se si formano o meno in quantità equimolari rispetto a quest’ultimo. NB: se non si formano ulteriori prodotti, scrivere “nessuno” nella casella dedicata
7. Mostrare il meccanismo e scrivere il prodotto della seguente reazione
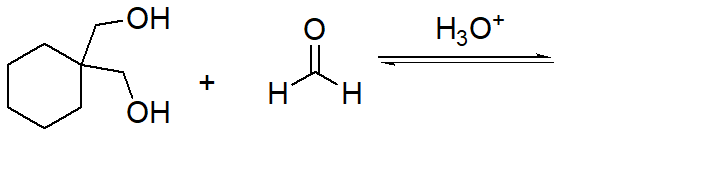
8. Scrivere i due anomeri del D-galattopiranosio, sapendo che il galattosio è l’epimero in 4 del glucosio
9 Scrivere il dipeptide Ala-Ala sapendo che la catena laterale dell’alanina è -CH3
TERZO SET
1. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:
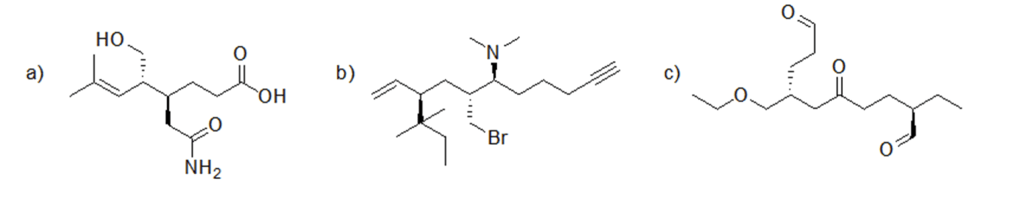
2.
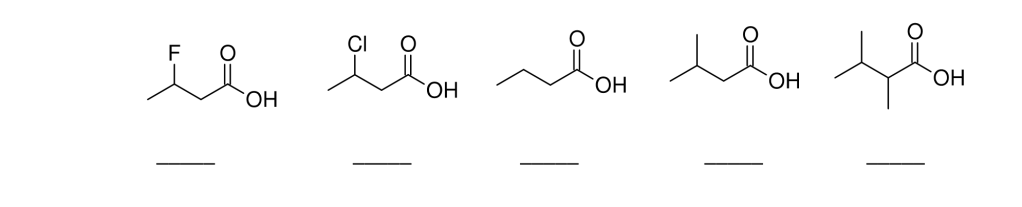
3. Ordinare i seguenti acidi carbossilici dal più acido al meno acido, giustificando la risposta data
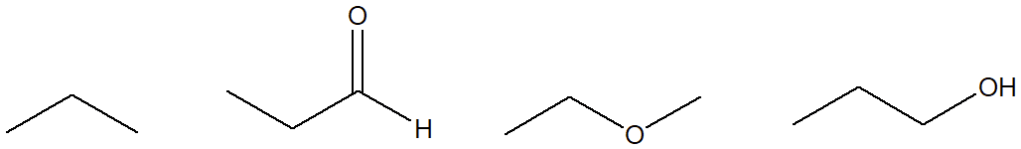
4. Quale dei seguenti composti è meno solubile in acqua?
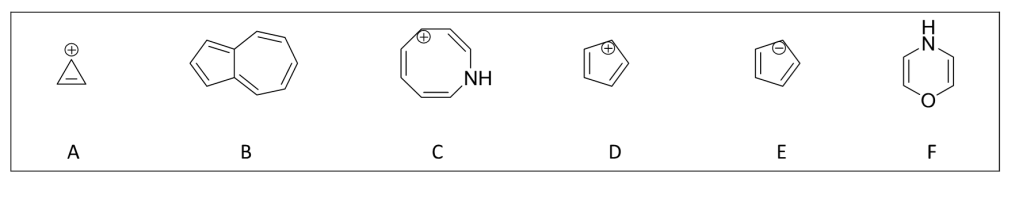
5. Giustificare il carattere aromatico, antiaromatico o non aromatico dei seguenti composti e ioni
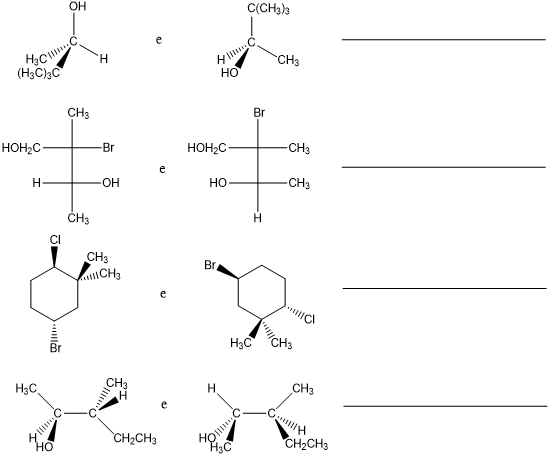
6. Indicare se le seguenti coppie di strutture sono enantiomeri, diastereoisomeri, isomeri strutturali o composti identici
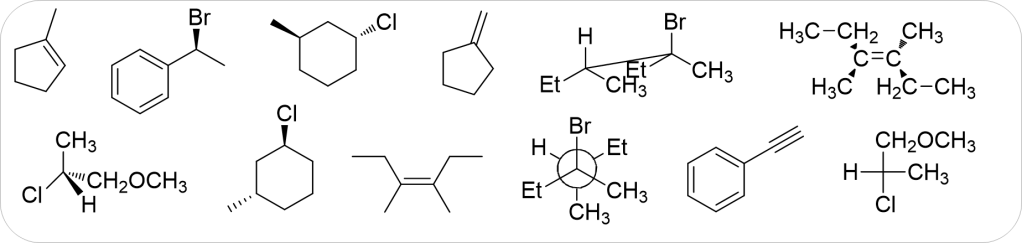
7. A partire da uno dei composti riportati nel riquadro e utilizzando qualsiasi altro reagente necessario, suggerire la sintesi di ciascuno dei seguenti prodotti, indicando sulle frecce le condizioni di reazione. Mostrare, inoltre, il meccanismo di reazione.
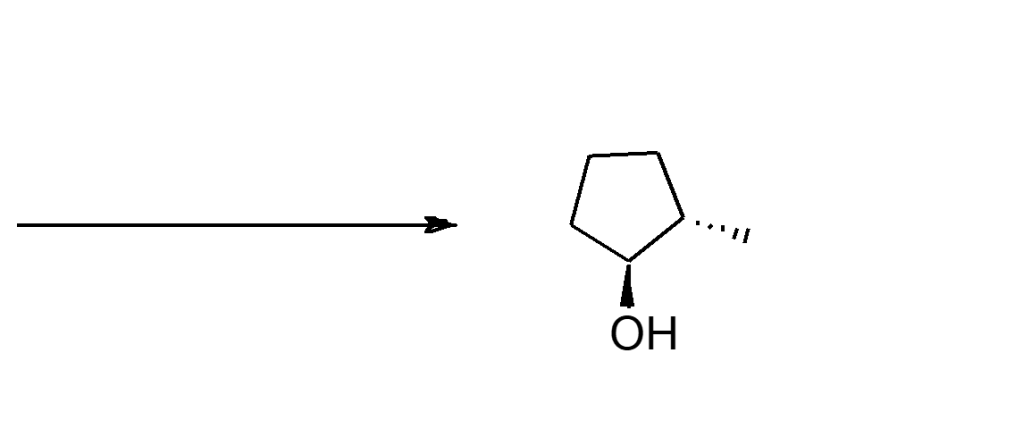
8. La reazione di (1R,2S)-1-bromo-2-metilcicloesano con etossido di sodio, dà come prodotto principale di eliminazione un prodotto diverso rispetto a quello che si ottiene dalla stessa reazione dello stereoisomero (1R,2R). Dare una spiegazione.
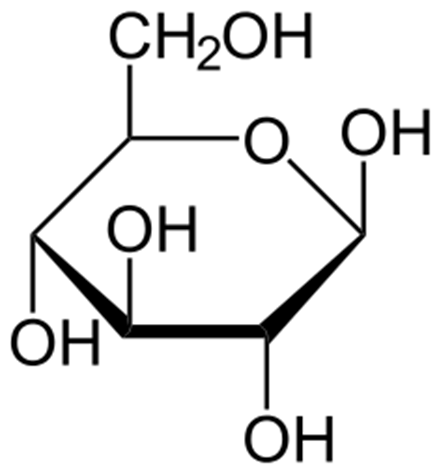
9. Il composto di seguito mostrato è il β-D-glucopiranosio, scrivere: a) l’anomero α; b) il β-D-galattopiranosio (epimero in 4); β -L-glucopiranosio
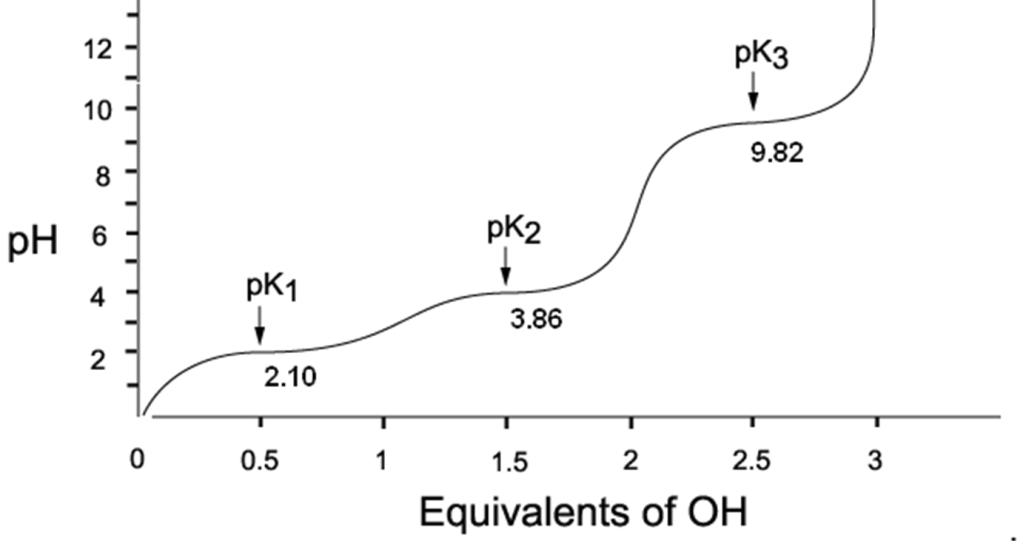
10. In basso è riportata la curva di titolazione dell’acido aspartico, un amminoacido acido.
Qual è il punto isoelettrico dell’acido aspartico?

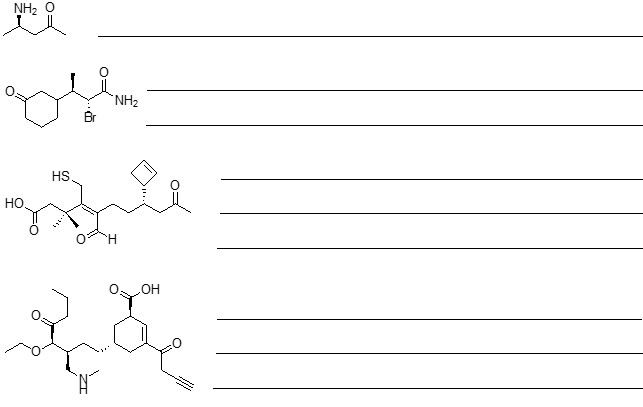
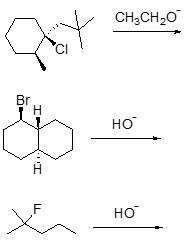
1. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti
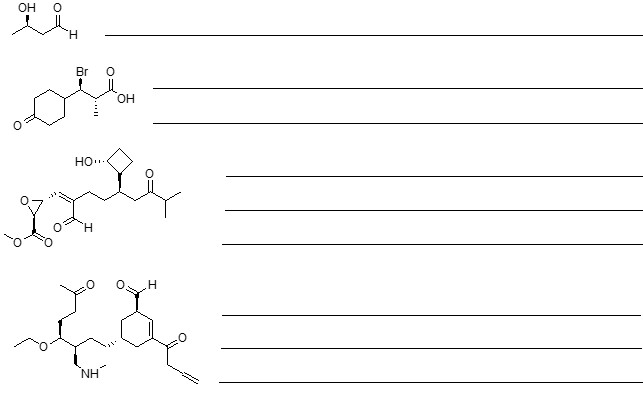
2. Scrivere i prodotti principali di eliminazione delle seguenti reazioni, indicando, per ciascuna reazione, se procede con meccanismo E1 o E2

3. Scrivere i prodotti principali delle seguenti reazioni, indicando la stereochimica quando necessario:
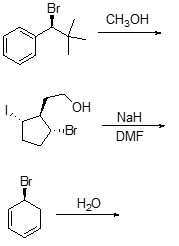
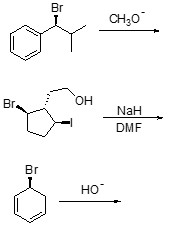
4. A. Chi reagirà più velocemente in una reazione E2 tra (1R,3R)-1-bromo-3-isopropilcicloesano e (1R,3S)-1-bromo-3-isopropilcicloesano? Spiegare sinteticamente perché.
B. Chi reagirà più velocemente in una reazione E2 tra (1S,3S)-1-bromo-3-isopropilcicloesano e (1S,3R)-1-bromo-3-isopropilcicloesano? Spiegare sinteticamente perché.
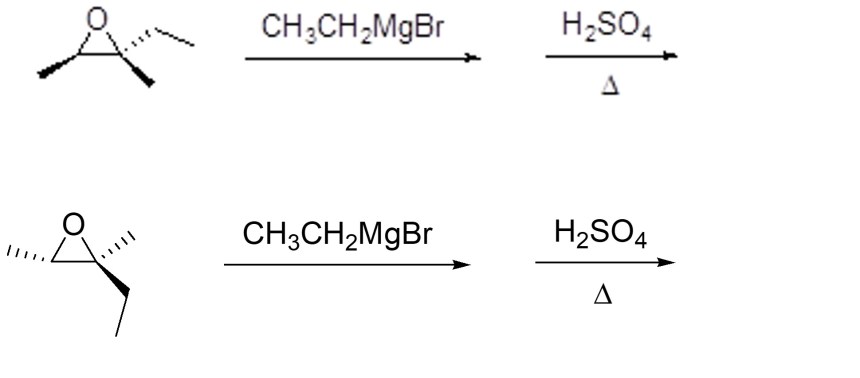
5. I reattivi di Grignard sono tra i nucleofili che possono aprire gli epossidi. Mostrare il meccanismo e i prodotti della seguente sequenza di reazioni (indicando la stereochimica dei prodotti):
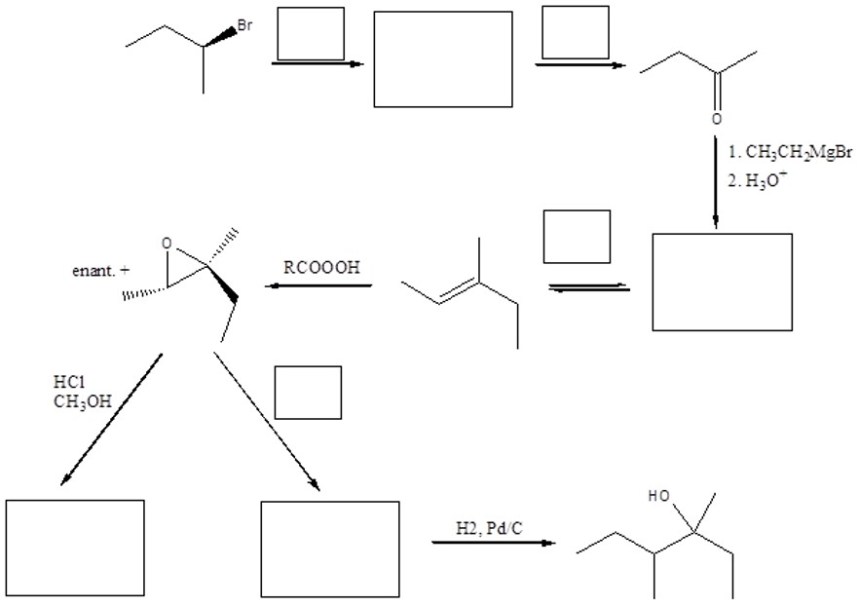
6. A. La disidratazione acido-catalizzata del (1R,2R)-2-metil-1-ciclopentanolo porta alla sintesi di tre alcheni diversi. Mostrare il meccanismo di formazione dei tre prodotti.
B. La disidratazione acido-catalizzata del (1S,2S)-2-metil-1-ciclopentanolo porta alla sintesi di tre alcheni diversi. Mostrare il meccanismo di formazione dei tre prodotti.
7. Completare il seguente schema inserendo le condizioni di reazione o i prodotti mancanti. Evidenziare la stereochimica quando opportuno.
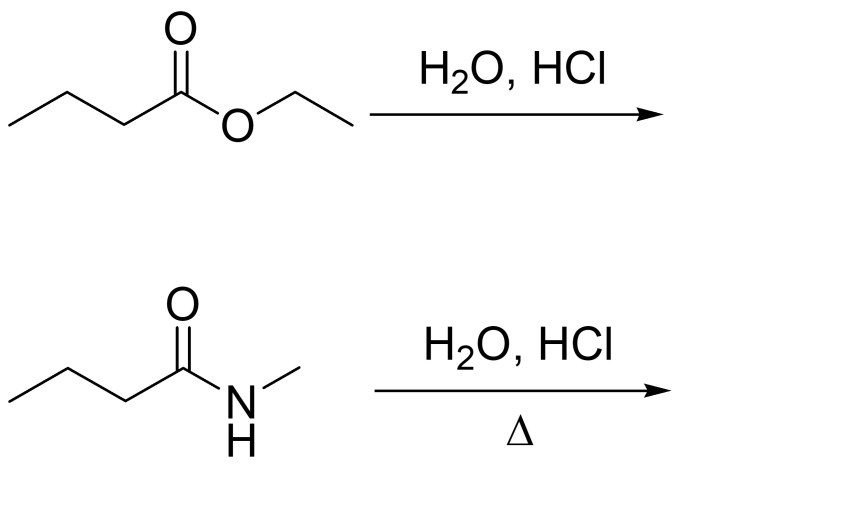
8. Mostrare il meccanismo e i prodotti della seguente reazione:
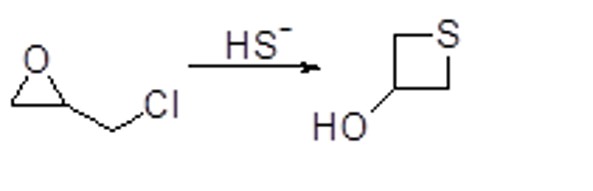
Opzionale 1: Mostrare il meccanismo per la seguente trasformazione
Opzionale 2: Assegnare il nome IUPAC comprensivo di stereochimica al seguente composto

Suggerimento: per poter usare questi set di esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 2 ore per ciascun set.
PRIMO SET
1. Assegnare il nome IUPAC, comprensivo di stereochimica, alle seguenti molecole

2. Rispondi alle domande sulla seguente molecola:

a) Quante coppie solitarie sono presenti sul cloro e quali orbitali occupano? ____________________
b) Quanti carboni ibridati sp sono presenti? ________________________________________
c) Indicare con una freccia sulla figura il legame singolo carbonio-carbonio più corto
3.Disporre i seguenti composti in ordine di acidità crescente (dal meno acido al più acido) e spiegare sinteticamente il perché
a) CH3CH2SH
b) CH3CH2NH2
c) CH3CH2OH
d) CH3CH2CH3
4. Prendendo in considerazione il (2R,3R)-2,3-dibromobutano, scrivere A) l’enantiomero in proiezione di Fischer, B) un diastereoisomero con una struttura a segmenti. Poi, per ciascuno dei due composti, dire se sono otticamente attivi
5. Scrivere i prodotti principali di eliminazione delle seguenti reazioni, indicando, per ciascuna reazione, se procede con meccanismo E1 o E2
6. Attribuire la configurazione assoluta ai seguenti carboni chirali

7. Dire quale dei seguenti composti è otticamente attivo (è possibile scegliere più opzioni):

8. Mostrare le condizioni di reazione e il meccanismo della seguente trasformazione (ignorare la stereochimica)
9. Chi reagirà più velocemente in una reazione E2 tra (1R,3R)-1-bromo-3-isopropilcicloesano e (1R,3S)-1-bromo-3-isopropilcicloesano? Spiegare sinteticamente perché.
10. Disporre i seguenti composti in ordine di basicità decrescente, fornire una spiegazione e dimostrare gli effetti che concorrono a determinare l’ordine indicato
11. Mostrare il meccanismo di apertura del seguente epossido a) con metanolo in ambiente acido; b) con ione metossido. Mostrare la stereochimica dei prodotti.Attribuire il nome IUPAC all’epossido e ai prodotti formati.
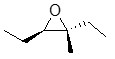
12. Scrivere l’α-L-galattopiranosio (il galattosio è l’epimero in 4 del glucosio)
SECONDO SET
1. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:
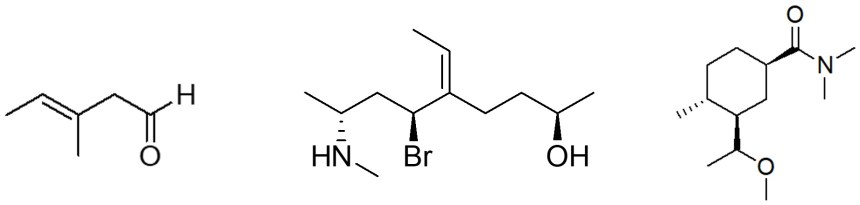
2. Disporre i seguenti composti in ordine di acidità crescente (dal meno acido al più acido) e spiegare sinteticamente il perché
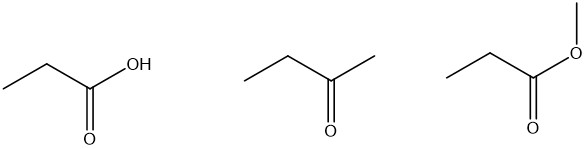
3. Mostrare il meccanismo di addizione aldolica per il secondo composto dell’esercizio 2
4. Scrivere una proiezione di Newman del (1R,3R)-3-metil-1-cicloesanolo secondo i legami C1-C6 e C3-C4. Poi, effettuare l’inversione d’anello e dire qual è il conformero più stabile
5. Scrivere la struttura a sedia del conformero più stabile di un diastereoisomero del composto dell’esercizio 4. Poi, confrontare il composto dell’esercizio 4 col diastereoisomero disegnato. Quale dei due stereoisomeri sarà quello più stabile?
6. Prendendo in considerazione il legame C3-C4 del 2-metilpentano, scrivere la proiezione di Newman del conformero meno stabile in assoluto e la struttura a cavalletto del conformero più stabile in assoluto.
7. Il 2-metil-2-butene reagirà con Br2 in acqua per dare un’aloidrina (ignorare la stereochimica). La reazione ha Keq>1. Mostrare il meccanismo di reazione, inclusi gli stati di transizione. Poi, disegnare il diagramma energetico della reazione. Indicare nel diagramma le parti corrispondenti a reagenti, prodotti, stato di transizione, intermedio, variazione dell’energia libera di Gibbs, energia di attivazione di ciascuno stadio della reazione.
8. Disporre i seguenti composti in ordine di basicità decrescente e motivare la risposta data

9. Mostra il meccanismo e i prodotti della seguente reazione:
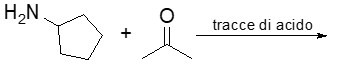
10. Mostrare la sintesi di Kiliani Fischer che porta alla sintesi del D-glucosio e del D-mannosio (il D-mannosio è l’epimero in 2 del glucosio).
TERZO SET
1. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:
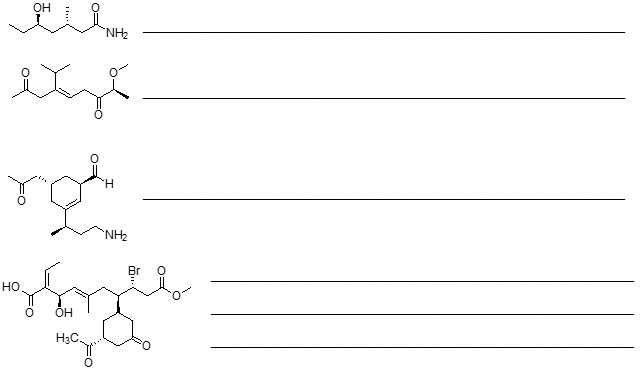
2. Dire quali dei seguenti composti ha punto di ebollizione più basso, motivando la risposta: a) pentano, b) 2-metilbutano, c) 2,2-dimetilpropano
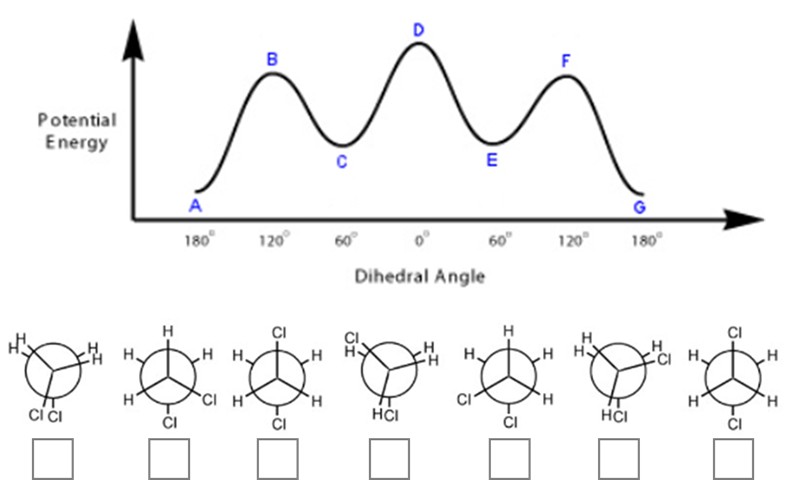
3. Quello riportato di seguito è il diagramma delle variazioni di energia potenziale rispetto all’angolo diedro per l’1,2-dicloroetano. Sotto, sono riportate le proiezioni di Newman dei possibili conformeri. Completare il diagramma indicando il conformero associato a ciascuna lettera, inserendo le lettere corrispondenti nel riquadro sotto i conformeri.
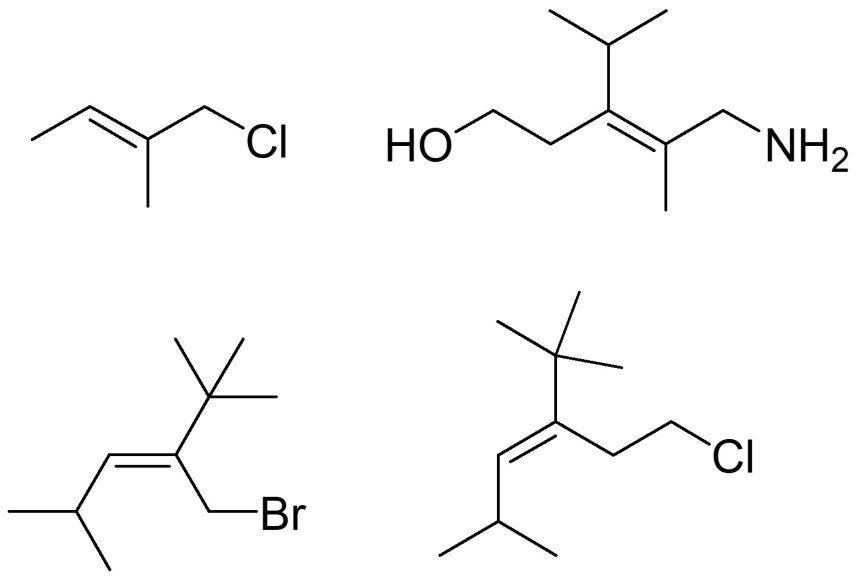
4. Indicare con una freccia i doppi legami che presentano geometria Z:
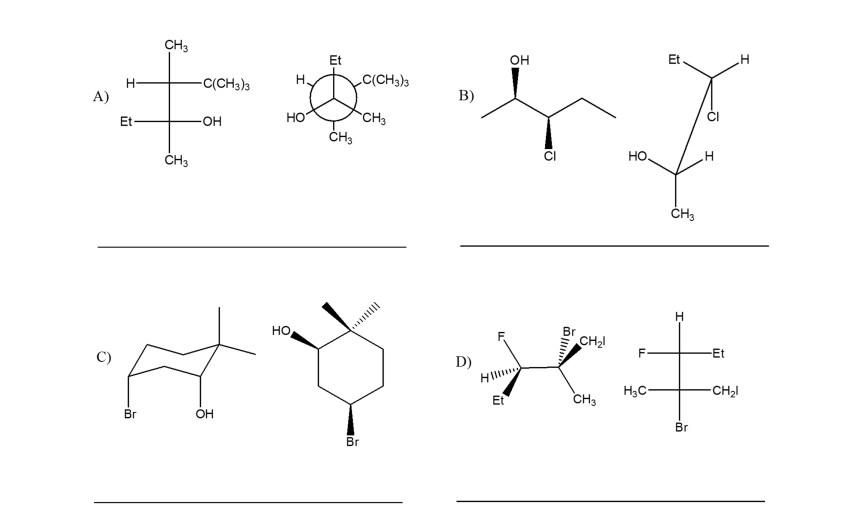
5. Stabilire le configurazioni assolute dei carboni chirali presenti nelle seguenti molecole (NB: la notazione va riportata vicino ai carboni cui fa riferimento) e dire qual è la relazione stereochimica esistente tra i composti di ciascuna coppia (isomeri conformazionali/enantiomeri/diastereoisomeri/stesso composto/altro):
6. Esistono due isomeri geometrici del 3-esene. Per reazione con Br2 in CH2Cl2, uno dei due darà due prodotti, l’altro solo uno.
A) Spiegare perché.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________B) Mostrare il meccanismo della reazione che porta alla sintesi di un unico prodotto, seguendo anche la stereochimica della reazione.
7. L’aggiunta di HBr al 2-metil-1-propene procede attraverso la formazione di un intermedio carbocationico.
a) Completare il meccanismo riportato in basso, disegnando le frecce ricurve e gli stati di transizione.
b) Per ogni stadio, identificare la specie nucleofila con N ed elettrofila con E.
c) Scrivere ogni lettera riportata sul diagramma della coordinata di reazione nel quadrato tratteggiato corrispondente nel meccanismo di reazione.
d) Individuare ΔG0 della reazione e l’energia di attivazione dello stadio cineticamente determinante, scrivendone i simboli accanto alla freccia corrispondente sul diagramma.
e) Il secondo stadio della reazione è esoergonico o endoergonico?_______________________________ f) Cosa possiamo dire circa la Keq della reazione?____________________________________________
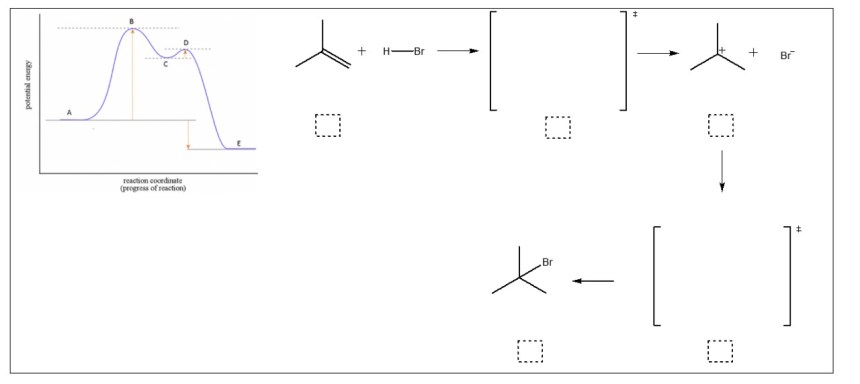
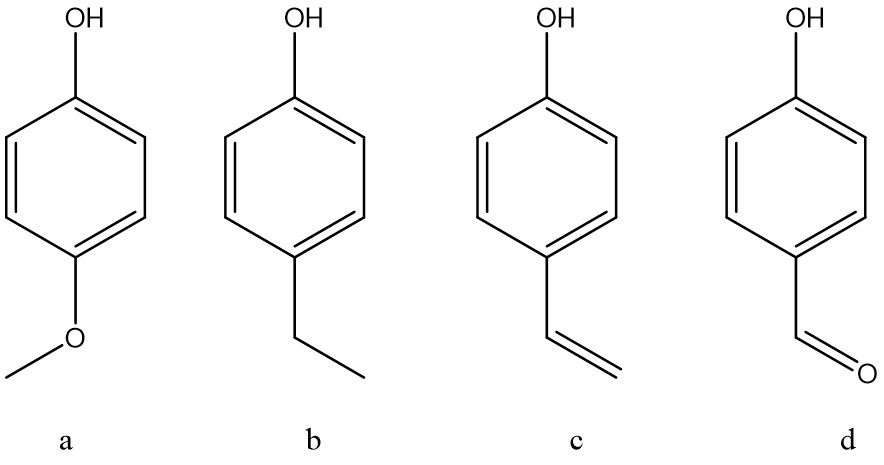
8. Spiegare e dimostrare perché il para-nitrofenolo (b) è più acido del fenolo (a).
9. La disidratazione acido-catalizzata del (1R,2R)-2-metil-1-ciclopentanolo porta alla sintesi di tre alcheni diversi. Mostrare il meccanismo di formazione dei tre prodotti.
10. Mostrare il meccanismo per la seguente trasformazione

11. Scrivere la struttura della L-alanina in proiezione di Fischer, sapendo che la catena laterale è -CH3

Suggerimento: per poter usare questi set di esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 2 ore per ciascun set.
PRIMO SET
1. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:

2. Disegnare la struttura di Lewis della seguente molecola: CH3CHO. Calcola le cariche formali per tutti gli atomi diversi dall’idrogeno
3. Qual è il più corto tra i legami indicati dalle frecce nella seguente molecola?
a) Cerchiare la lettera corrispondente.
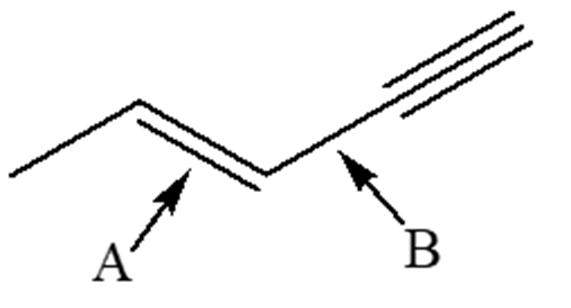
b) In riferimento al legame A, dire:
I) quali orbitali molecolari sono presenti
II) quali orbitali atomici o ibridi sono coinvolti nella formazione del legame
4. Il composto mostrato di seguito è l’acido nicotinico
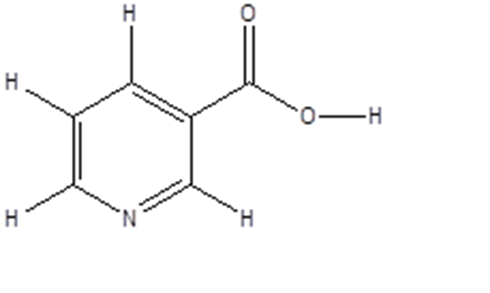
a) indicare con una freccia l’idrogeno più acido;
b) dire quale orbitale occupa la coppia solitaria dell’atomo di azoto
5. Disporre i seguenti composti in ordine di punto di ebollizione crescente. Indicare l’ordine inserendo i numeri nei riquadri sotto le strutture: 1= quello col punto di ebollizione più basso, 5= quello col punto di ebollizione più alto

6. Per l’1,4-dimetilcicloesano esistono due isomeri configurazionali (I e II); per l’1,2-dimetilcicloesano esistono tre isomeri configurazionali (I, II, III). Completare la seguente tabella.

7. Attribuire la configurazione assoluta al seguente carbonio chirale:
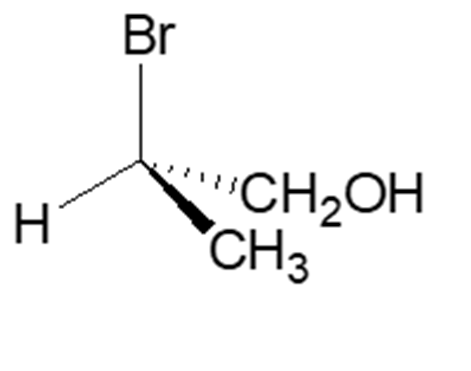
8. Dire quale dei seguenti composti non è otticamente attivo (è possibile scegliere più opzioni):

9. Il 2-metil-2-butene reagirà con Br2 in acqua per dare un’aloidrina (ignorare la stereochimica). La reazione ha Keq>1. Mostrare il meccanismo di reazione, inclusi gli stati di transizione. Poi, disegnare il diagramma energetico della reazione. Indicare nel diagramma le parti corrispondenti a reagenti, prodotti, stato di transizione, intermedio, variazione dell’energia libera di Gibbs, energia di attivazione di ciascuno stadio della reazione.
10. Scrivere i prodotti principali delle seguenti reazioni (se avvengono), indicando la stereochimica quando opportuno. Se la reazione non avviene, scrivere “nessuna reazione”
SECONDO SET
1. Assegnare il nome IUPAC, comprensivo di stereochimica, al seguente composto:
2. Disporre i seguenti composti in ordine di acidità crescente (dal meno acido al più acido) e spiegare sinteticamente il perché
a) CH3CH2SH
b) CH3CH2NH2
c) CH3CH2OH
d) CH3CH2CH3
3. In riferimento ai composti dell’esercizio 2, rispondere alle seguenti domande:
a) quale di esso sarà caratterizzaro dal valore di pKa più elevato?
b) quale dal valore di Ka più elevato?
4. Scrivere la struttura a segmenti del seguente composto e dire se il nome IUPAC è corretto; se non lo è, scrivere il nome corretto: 2-ciclopropilesano
5. Disegnare e scrivere il nome IUPAC di un composto di formula C9H18 che contenga solo idrogeni primari
6. Stabilire le configurazioni assolute dei carboni chirali presenti nelle seguenti molecole (NB: la notazione va riportata vicino ai carboni cui fa riferimento) e dire qual è la relazione stereochimica esistente tra i composti di ciascuna coppia (isomeri conformazionali/enantiomeri/diastereoisomeri/stesso composto/altro):


7. Prendendo in considerazione il legame C3-C4 del 2-metilpentano, scrivere la proiezione di Newman del conformero meno stabile in assoluto e la struttura a cavalletto del conformero più stabile in assoluto
8. Disporre i seguenti composti in ordine di basicità crescente e motivare la risposta data

9. Mostrare il meccanismo di apertura del seguente epossido a) con metanolo in ambiente acido; b) con ione metossido. Mostrare la stereochimica dei prodotti. Attribuire il nome IUPAC all’epossido e ai prodotti formati.

10. Spiegate perché il trattamento con base del (1R,2R)-1-bromo-2-metilcicloesano genera il 3-metilcicloes-1-ene, un prodotto di eliminazione non Zeitzev
11. Scrivere iol D-glucosio e mostrare il meccanismo di riarrangiamento enediolico e quello di epimerizzazione.
12. Scrivere un L-amminoacido generico in proiezione di Fischer.
TERZO SET
1. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:

2. Disponi i seguenti composti in ordine di basicità crescente (dal meno basico al più basico), motivando sinteticamente la scelta
3. L’acido acetico ha pKa=4.8.
a) Quale sarà la forma predominante in una soluzione a pH 2.8? Disegnarne la formula di Kekulé nel riquadro sotto.
b) In quale rapporto saranno la forma acida e la forma basica a questo valore di pH?
4. Scrivere il seguente composto in proiezione di Newman secondo i legami C1-C6 e C3-C4: (1R,3S,4R)-4-isopropil-3-metilcicloesan-1-olo. Poi, effettuare l’inversione d’anello e dire qual è il conformero più stabile
5. In riferimento alla conformazione più stabile del composto dell’esercizio 4, descrivere le interazioni 1,3-diassiali (se presenti) e altre interazioni gauche (se presenti). NB: è sufficiente indicare i gruppi tra cui si instaurano tali interazioni (es.: tra il sostituente X in assiale e…).
6. Calcolare il numero massimo di stereoisomeri possibili per la seguente struttura. Scriverne uno a scelta e assegnargli il nome IUPAC completo di stereochimica

7. Partendo dall’opportuno alchene, illustrare il meccanismo di reazione della sintesi del seguente composto utilizzando una reazione di idroborazione/ossidazione. Indicare eventuali altri prodotti fornendo per tutti il nome IUPAC completo di stereochimica.
8. Mostrare il meccanismo e i prodotti della seguente reazione:
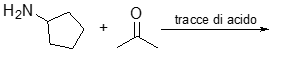
9. Scrivere un legame peptidico tra due amminoacidi (usare R per indicare le catene laterali degli amminoacidi). Dimostrare che tale legame ha parziale carattere di doppio legame.
10. Scrivere la proiezione di Fischer dell’L-alanina (R=-CH3) e determinare la configurazione assoluta del carbonio chirale

| Giorno | Ora | Evento | Aula | Note |
|---|---|---|---|---|
| 21/01 | 9:30 | ESAME ORALE | D1 | |
| 28/01 | 9:30 | ESAME ORALE | L |
L’incontro pre-esame orale (inizialmente previsto per lunedì) è annullato, dato che nessuno ha espresso dubbi utilizzando l’apposito form.

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomenti, ma potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti. In fondo alla lista, troverete anche un’indicazione del livello di difficoltà delle domande.

2. Che succede se mettiamo il composto raffigurato in alto in presenza di ione metossido?
3. Nel composto 1 c’è un anello aromatico, in particolare un benzene sostituito. Immaginiamo di avere il nitrobenzene. Il gruppo nitro è un gruppo fortemente disattivante. Dimostare quest’affermazione.
4. In che modo il gruppo nitro orienta eventuali altri sostituenti.
5. Che effetto ha il gruppo nitro sull’acidità del fenolo? Prendere in considerazione il fenolo sostituito col gruppo nitro in diverse posizioni (orto/meta/para).
6. Definire l’ibridazione di tutti gli atomi di ossigeno della molecola in 1.
7. In che modo possiamo predire le proprietà fisiche dei composti organici? Fornire degli esempi pratici.
8. Spiegare in che modo la geometria molecolare influenza il momento dipolare di una molecola.
9. Per una stessa molecola, conformeri diversi possono essere caratterizzati da momenti dipolari diversi. Spiegare questa affermazione e fornire degli esempi concreti.
10. Il composto 1,4-diclorobenzene non ha momento dipolare. Momento dipolare che è invece presente nel cis-1,4-diclorocicloesano. Spiegare perchè.
11. Per l’1,4-diclorocicloesano esistono due isomeri geometrici. Per ciascuno degli isomeri geometrici, disegnare i conformeri a sedia e individuare il conformero più stabile, spiegando il perchè.
12. Confrontando tra loro gli alogeni per quel che concerne l’influenza sulla costante di equilibrio per i cicloesani monosostituiti (Tabella 3.9 del Bruice), si osserva un trend interessante. Quale? Fornire una spiegazione plausibile per i dati sperimentali.
13. Come sintetizzeresti il terz-butossicicloesano mediante sintesi di Williamson? Dopo aver scelto la strategia sintetica migliore, valutare l’effettiva efficacia della sintesi proposta ed eventualmente proporre metodi alternativi.
14. Confronta lo ione terz-butossido e lo ione metossido dal punto di vista della basicità e dal punto di vista della nucleofilicità. Definisci, inoltre, in maniera chiara i due concetti (basicità e nucleofilicità).
15. Fai degli esempi di acidi organici e di basi organiche.
16. Parla degli effetti della struttura sull’acidità.
17. In che modo possiamo utilizzare l’equazione di Henderson-Hasselbalch per capire se un composto ionizzabile si troverà in soluzione nella sua forma acida o nella sua forma basica?
18. Parlare dell’acidità degli idrogeni in alfa ad un gruppo carbonilico. Confrontare tra loro i diversi composti carbonilici definendo anche una scala di acidità per gli idrogeni legati al carbonio alfa.
19. A proposito di composti carbonilici, confronta tra loro i meccanismi di sostituzione nucleofila acilica e quelli di addizione nucleofila.
20. Se alcuni tra i composti carbonilici vanno incontro a reazioni di addizione nucleofila, gli alcheni vanno incontro a reazioni di addizione elettrofila. Fare degli esempi di addizione elettrofila agli alcheni, mostrando i meccanismi.
21. A differenza degli alcheni, il benzene va incontro a reazioni di sostituzione elettrofila. Spiegare perchè.
22. Gli alcheni possono essere sintetizzati a partire dagli alogenuri alchilici. In che modo? Quale sarà l’alchene principale ottenuto a partire da (2S,3R)-2-cloro-3-metilpentano? E a partire da (2S,3R)-2-fluoro-3-metilpentano?
23. La regola di Zeitzev non è sempre utile per identificare il prodotto principale di una reazione di eliminazione. Spiegare il perchè e fare degli esempi concreti.
24. Scrivere un monosaccaride che sia un aldopentoso e che abbia tutti i carboni chirali con configurazione S. Questo zucchero appartiene alla serie D o alla serie L?
25. A partire dallo zucchero in 24 mostrare il meccanismo di epimerizzazione e di riarrangiamento enediolico.
26. Cosa sono due epimeri?
27. Scrivere un legame peptidico.
28. Che tipo di legame è il legame peptidico? Che caratteristiche ha?
29. Immagina di voler sintetizzare un dipeptide, ma la sintesi coinvolge amminoacidi che hanno gruppi reattivi in catena laterale. Cosa faresti per evitare che questi reagiscano? (NB: la domanda è generica, non riguarda un gruppo in particolare)
30. Mostrare una strategia per la sintesi del 2-metil-1-propil-1-cicloesanolo a partire da 1-cloro-2-metilcicloesano (sono necessari più passaggi). Mostrare i meccanismi delle reazioni qualora siano tra quelli oggetto del programma.
Grado di difficoltà delle domande:
Alto (richiedono più passaggi e/o notevole padronanza della disciplina): 2, 5, 12, 13, 23, 29
Medio (domande che vanno al di là della mera esposizione/applicazione di concetti teorici): 30
Basso (domande che riguardano l’esposizione di concetti teorici, la dimostrazione di semplici meccanismi di reazione, l’applicazione diretta di concetti teorici di base): tutte le domande non incluse nelle due liste precedenti.

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomenti, ma potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti. In fondo alla lista, troverete anche un’indicazione del livello di difficoltà delle domande.

Grado di difficoltà delle domande:
Alto (richiedono più passaggi e/o notevole padronanza della disciplina): 27, 29
Medio (domande che vanno al di là della mera esposizione/applicazione di concetti teorici): 14, 22, 26, 28
Basso (domande che riguardano l’esposizione di concetti teorici, la dimostrazione di semplici meccanismi di reazione, l’applicazione diretta di concetti teorici di base): tutte le domande non incluse nelle due liste precedenti.

Nel testo di riferimento (il Bruice) alcuni meccanismi non sono esplicitati (o in alcuni casi non lo sono per esteso), data la somiglianza con altri meccanismi (o per il fatto che si tratta di meccanismi già spiegati altrove).
Qui troverete un elenco di questi meccanismi con indicazioni su dove trovarli o con spiegazioni relative alla loro estrapolazione da meccanismi già presenti sul libro:
Sintesi di Gabriel: Dopo aver sintetizzato l’immide N-sostituita, questa deve essere idrolizzata. Ci sono diversi metodi per ottenere questa idrolisi, quello indicato sul testo è l’idrolisi in ambiente acido. Il meccanismo ricorda quello dell’idrolisi di un’ammide catalizzata da acidi (la cui spiegazione potete utilizzare a supporto della comprensione del meccanismo qui riportato; NB: per visualizzare i commenti ai singoli passaggi, è necessario scaricare il file pdf).
Transesterificazione catalizzata da acidi: meccanismo identico all’idrolisi dell’estere catalizzata da acidi. Il meccanismo per esteso è presente nel file delle correzioni degli esercizi su Reazioni di sostituzione nucleofila acilica (Ex 1a). Per la spiegazione relativa ad ogni passaggio, far riferimento al meccanismo di idrolisi dell’estere catalizzata da acidi.
Transesterificazione favorita da base: meccanismo identico all’idrolisi dell’estere favorita da ione idrossido. Il meccanismo per esteso è presente nel file delle correzioni degli esercizi su Reazioni di sostituzione nucleofila acilica (Ex 1e). Per la spiegazione relativa ad ogni passaggio, far riferimento al meccanismo di idrolisi dell’estere favorita da ioni idrossido.
Esterificazione di Fischer: il meccanismo è l’esatto contrario del meccanismo di idrolisi dell’estere catalizzata da acidi. Esso è presente nel file delle correzioni degli esercizi su Reazioni di sostituzione nucleofila acilica (Ex 4c). Per la spiegazione relativa ad ogni passaggio, far riferimento al meccanismo di idrolisi dell’estere catalizzata da acidi (ovviamente tenendo conto che si tratta del meccanismo inverso).
Idrolisi di un nitrile catalizzata da acidi: il meccanismo è riportato sul libro, ma ad un certo punto, dopo la formazione dell’ammide protonata, si fa riferimento ad “alcuni stadi”. Questi stadi non sono altro che quelli descritti nel meccanismo di idrolisi di un’ammide catalizzata da acidi (pag. 712, a partire dal secondo passaggio).
Reazioni delle anidridi con acqua (idrolisi) e ammine: scaricare il file qui
Idrolisi immina: il meccanismo corrisponde alla reazione inversa rispetto alla sintesi dell’immina (ma fare attenzione alla irreversibilità dell’idrolisi, a causa delle condizioni di reazione–> vedi spiegazione a pag. 762) e sarà esplicitato nel file relativo alle correzioni degli esercizi del post relativo alle Biomolecole (correzioni che non sono state ancora caricate)
Idrolisi emammine: scaricare il file qui. Valgono le stesse considerazioni fatte per l’idrolisi dell’immina.
Idrolisi acetale: il meccanismo corrisponde alla reazione inversa rispetto alla sintesi dell’acetale ed è esplicitato sul libro nella “strategia per la risoluzione dei problemi” a pag. 771.
Meccanismo di ciclizzazione degli zuccheri: sarà riportato nel file relativo alla correzione degli esercizi sulle Biomolecole. NB: le correzioni saranno rese disponibili entro il prossimo fine settimana.
Sintesi di Kiliani-Fischer: Si tratta di reazioni già note, in ogni caso i meccanismi per esteso saranno riportati nel file relativo alla correzione degli esercizi sulle Biomolecole. Per le spiegazioni è possibile far riferimento ai paragrafi del libro in cui sono spiegati i singoli meccanismi.
Sintesi dei peptidi: Pur essendo i meccanismi coinvolti riportati sul libro, alcuni passaggi sono sottintesi. Un meccanismo più dettagliato sarà riportato nel file relativo alla correzione degli esercizi sulle Biomolecole. Da integrare con le spiegazioni presenti sul testo. Per l’ultimo passaggio (idrolisi con acido trifluoroacetico) non è richiesto il meccanismo.
Per finire, qui troverete la slide relativa allo ione tropilio (catione aromatico).
Utilizzando questo form è possibile segnalare eventuali meccanismi per cui non si ha ancora a disposizione materiale sufficiente. NB: Consultare attentamente il libro e il materiale caricato sul blog (incluse le correzioni degli esercizi) PRIMA dell’eventuale compilazione del form, che si chiuderà il 16/01.

Alcani policiclici –Composti biciclici
•Questi composti biciclici condividono due carboni (sistemi ad anelli condensati)

I carboni a e b sono comuni ai due anelli e sono chiamati “carboni a testa di ponte”.
Questi composti sono chiamati biciclo[x.y.z]alcani, dove x, y e z rappresentano il numero di atomi di carboni di ogni catena carboniosa che congiunge a con b, elencati in ordine decrescente; alcano rappresenta il numero totale di carboni nella molecola.

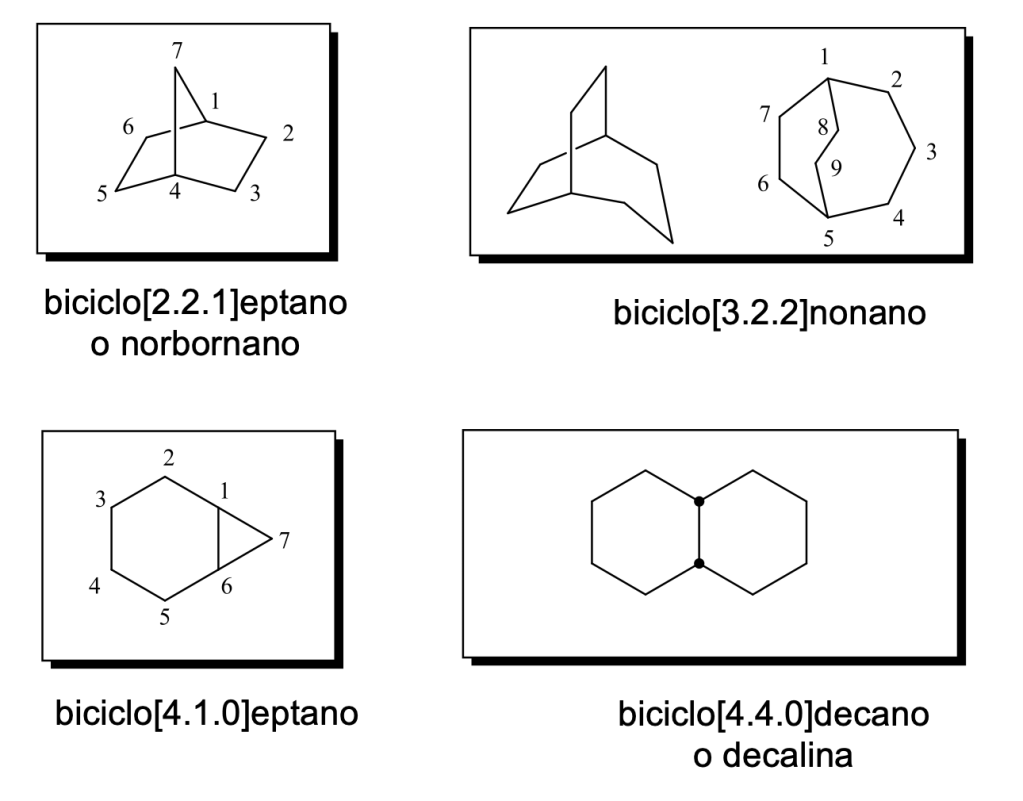
ESEMPI:

•per gli eteroatomi bisogna seguire un ordine di priorità
per composti biciclici contenenti eteroatomi, bisogna seguire un ordine di priorità: ossa> tia>aza>fosfa


Alcani policiclici – Spiro Composti
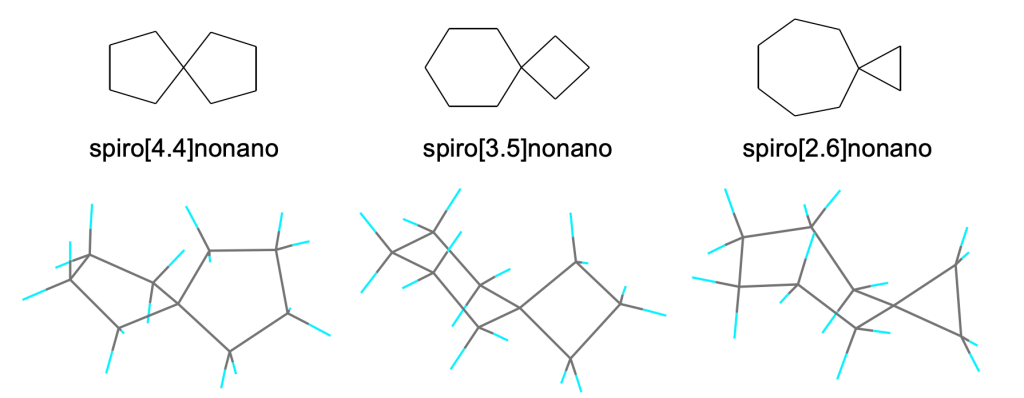
La radice del nome è data dal numero totale di atomi di carbonio
Per indicare la struttura biciclica con un atomo di carbonio in comune tra i due cicli si utilizza il prefisso spiro
Per distinguere tra tutti i possibili isomeri, il numero di atomi di carbonio in ogni anello (escluso l’atomo di carbonio in comune) è indicato tra parentesi quadre
[4.4] [3.5] [2.6]
Il nome indicante il numero totale di carboni si mette dopo il prefisso e le parentesi quadre
I sostituenti sugli anelli sono localizzati numerando gli anelli a cominciare dall’atomo di carbonio adiacente al carbonio comune nell’anello più piccolo

La numerazione fissa dell’anello idrocarburico spiro non viene modificata dall’introduzione di eteroatomi, doppi legami o gruppi funzionali.

ESEMPI

You must be logged in to post a comment.