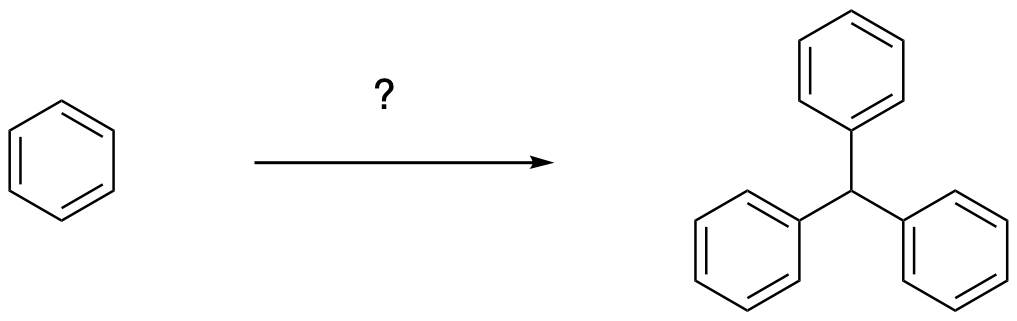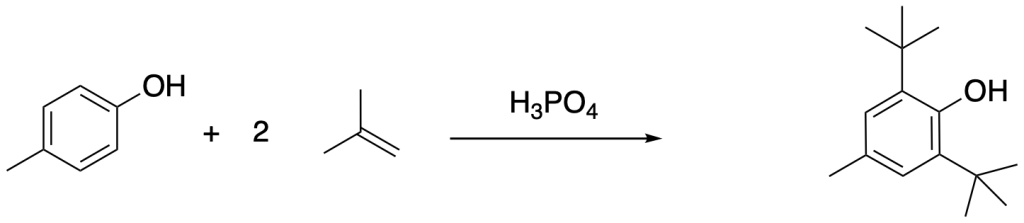Esercitazione prova scritta

Di seguito vengono proposte dei set di esercizi. Si consiglia di svolgere ciascun set dopo aver studiato tutti gli argomenti del programma in due ore di tempo.
SET 1
- Assegnare il nome IUPAC (comprensivo di stereochimica) ai seguenti composti:
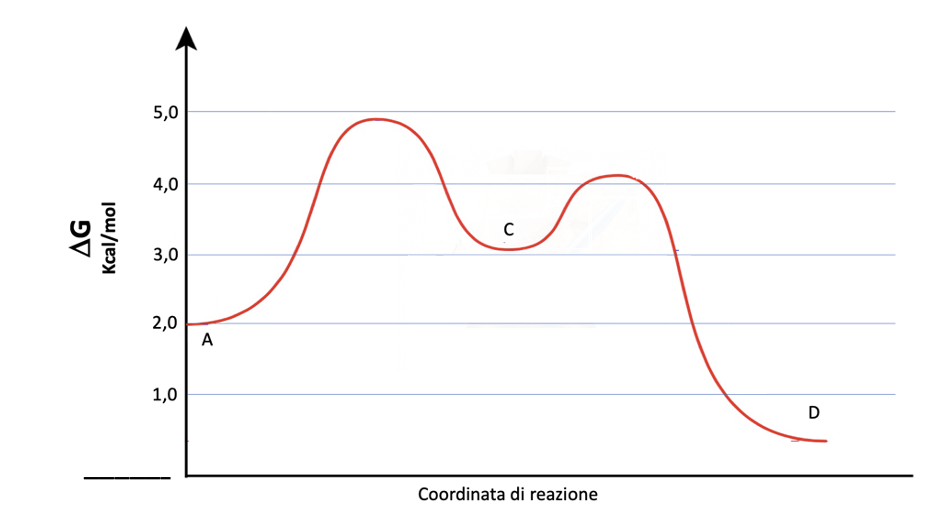
2. Considerando il diagramma dell’energia riportato in basso: a) Quanti stadi ci sono in questa reazione? b) Qual è lo stadio lento di A→D? c) Qual è il ΔG° di C→D? d) Qual è il ΔG‡ di A→C? e) Quale è il ΔG‡ di D→C?
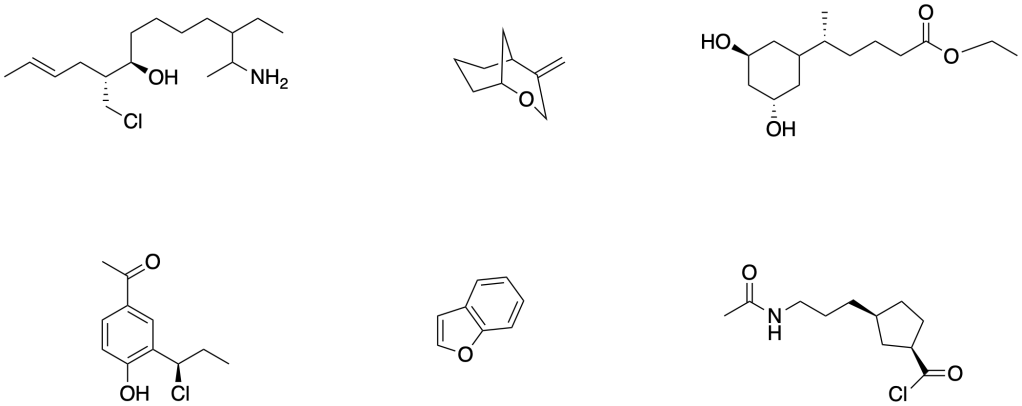
3. Scrivere le strutture dei seguenti composti:
- (3S,4R)-3-etil-2,4-dimetilesano
- (2Z,4S,6S)-4,6-dicloro-2-eptene
4. Scrivere le conformazioni a sedia di tutti gli stereoisomeri dell’1-etil-2-metilcicloesalo. Per ogni stereoisomero indicare quale conformero prevale all’equilibrio.
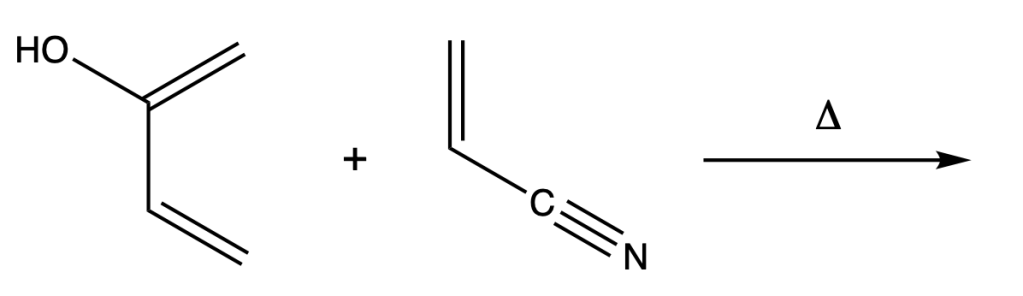
5. Scrivere il/i prodotto/i della seguente reazione di Diels-Alder. Specificare la regiochimica e la stereochimica, se necessario
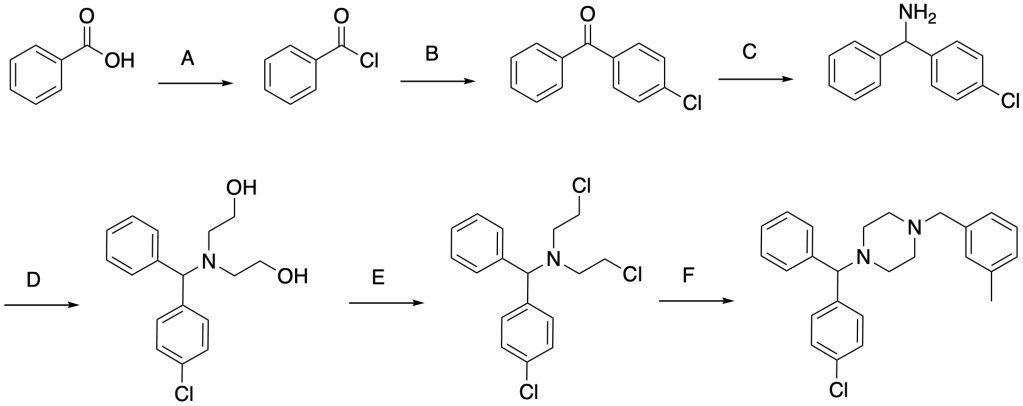
6. Proporre una metodica in più passaggi per effettuare la seguente trasformazione. Illustrare l’analisi retrosintetica e lo schema di sintesi commentando le scelte fatte.

7. In basso è riportata la curva di titolazione dell’aspartato, un amminoacido acido (R=CH2COOH. Quali specie si trovano in equilibrio a pH 9.82? Qual è il punto isoelettrico dell’aspartato? Disegnare la forma zwitterionica dell’aspartato e le specie in equilibrio a pH 9.82

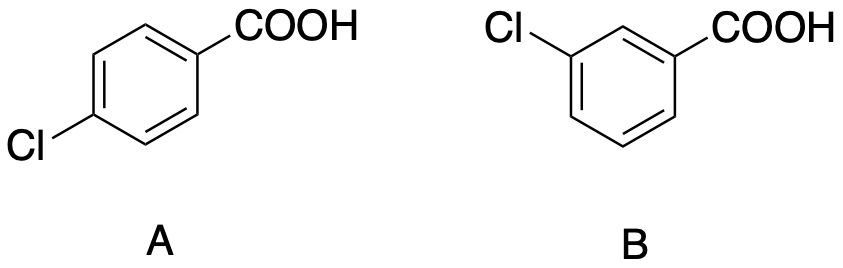
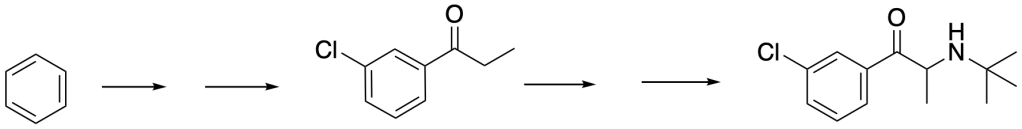
8. L’1-(3-clorofenil)propanone è un sintone nella sintesi del buproprione, il cui sale cloridrato è l’antidepressivo Welbutrina. (a) Proporre una sintesi di questo sintone a partire dal benzene. (b) Ipotizzare una sintesi del buproprione a partire da questo sintone.
SET 2
- Assegnare il nome IUPAC comprensivo di stereochimica ai seguenti composti

2. Trasformare le strutture in alto in proiezioni di Fischer ed assegnare la configurazione assoluta ai carboni chirali.
3. Disegnare un diagramma per una reazione che avviene con i seguenti criteri:
- Reazione esoergonica a tre stadi
- Il primo stadio è lo stadio cinetico
- Il secondo intermedio è più stabile del primo
- Il terzo stadio è più veloce della reazione inversa del secondo stadio
Indicare nel grafico reagenti (R) e prodotti (P), i tre stati di transizione (ST1, ST2, ST3) i due intermedi (I1 e I2); illustrare, inoltre il DG° dell’intera reazione e i DG‡ dei tre stadi.

4. Disegna le proiezioni di Fischer dei prodotti formati per reazione del D-galattosio (epimero in C-4 del glucosio) con (a) HNO3 e (b) AgNO3 in NH3, H2O (reazione di Tollens). Indicare se ciascun prodotto è otticamente attivo o inattivo.
5. Rappresentare gli intermedi delle seguenti reazioni:
(E)-3-metil-2-pentene e bromo in acqua
(R)-3-fenilbutanoato di etile e metanolo in presenza di un acido
1-metil-1,3-ciclopentadiene e cloro
6. scrivi il meccanismo della seguente trasformazione

7. L’ analisi retrosintetica costituisce un importante metodo per pianificare la sintesi di un prodotto organico indipendentemente dalla complessità molecolare. Mediante questo approccio, progettare la sintesi del (2S,3S)-2,3-dibromo-4,4-dimetil-pentano a partire dal 2-cloro-3,3-dimetilbutano.
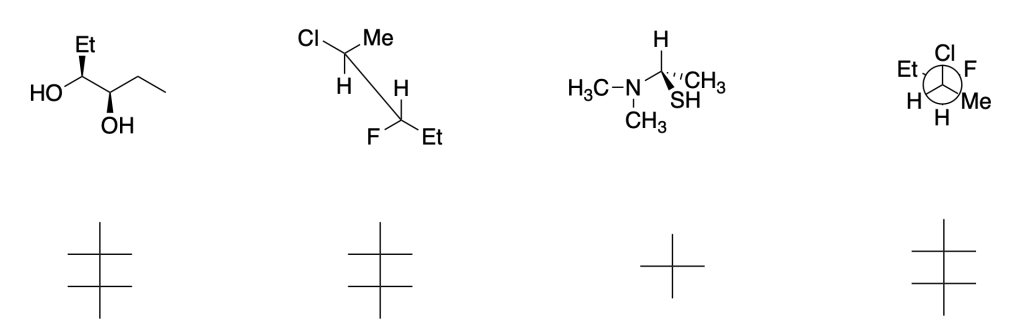
8. Ordina i seguenti composti da quello con momento dipolare maggiore (4) a quello minore (1)