Esercitazione

Completare i seguenti schemi di sintesi. Indicare la stereochimica quando opportuno.
1)

2)

3)
Università degli Studi della Campania "Luigi Vanvitelli"

Completare i seguenti schemi di sintesi. Indicare la stereochimica quando opportuno.
1)

2)

3)


1) Scrivere i prodotti di reazione (se la reazione avviene) con a) ione idrossido, b) ione t-butossido, c) acqua di:
I) (1R,2R)-1-bromo-2-metilcicloesano
II) (1R,2S)-1-bromo-2-metilcicloesano
III) (1S,2S)-1-bromo-2-metilcicloesano
IV) 2-bromo-2-metilpropano
V) 1-bromopentano
VI) 2-bromo-2,3,3-trimetilbutano
VII) 1-(1-bromopropil)benzene
VIII) (Z)-6-bromo-7-metil-3-ottene
MOSTRARE il meccanismo di reazione e la STEREOCHIMICA quando rilevante.
2) Dire quale composto delle seguenti coppie reagisce più velocemente in una reazione di eliminazione E2 e spiegare perchè
a) (1R,3S)-1-bromo-3-isopropilcicloesano o (1R,3R)-1-bromo-3-isopropilcicloesano
b) cis-1-bromo-4-isopropilcicloesano o trans-1-bromo-4-isopropilcicloesano
c) (1R,3S,4S)-1-bromo-4-isobutil-3-metilcicloesano o (1R,3S,4R)-1-bromo-4-isobutil-3-metilcicloesano
3) Completare il seguente schema sintetico
Indicare anche tra i prodotti qual è quello principale (quando applicabile). NB: per capire se i sostituenti sono addizionati al doppio legame in sin o in anti, utilizzare le strutture a cavalletto

4) Scrivere il prodotto o i prodotti principale della disidratazione con acido solforico ad alta temperatura per ciascuno dei seguenti alcoli. Mostrare il meccanismo di reazione.
a) (1S,2R)-2-metilcicloesanolo
b) (S)-2-pentanolo
c) (1S,3R)-3-metilcicloesanolo
5) Completare le seguenti reazioni. Per ciascuna reazione, mostrare il meccanismo.

6) Proporre una metodica in più passaggi per ottenere l’ (1S,2S)-1,2-dimetil-1,2-cicloesandiolo a partire da (1S,2R)-1-cloro-1,2-dimetilcicloesano. Mostrare il meccanismo di reazione e rispondere alle seguenti domande:
I) si formano altri prodotti oltre a quello indicato?
II) la stereochimica del composto di partenza è vincolante al fine di ottenere questo specifico prodotto?
III) Proporre una strategia che permetta di ottenere un diastereoisomero del (1S,2S)-1,2-dimetil-1,2-cicloesandiolo a partire dallo stesso composto di partenza

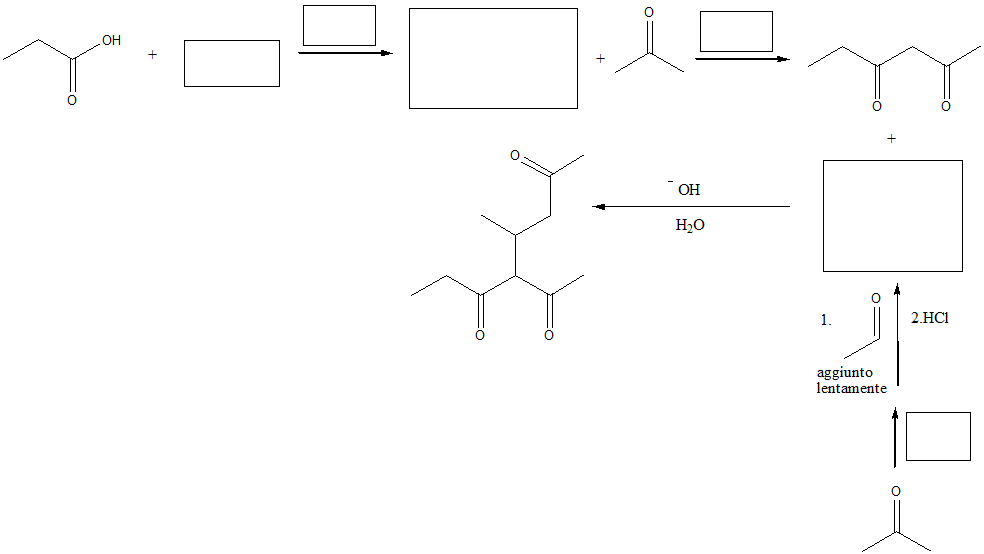
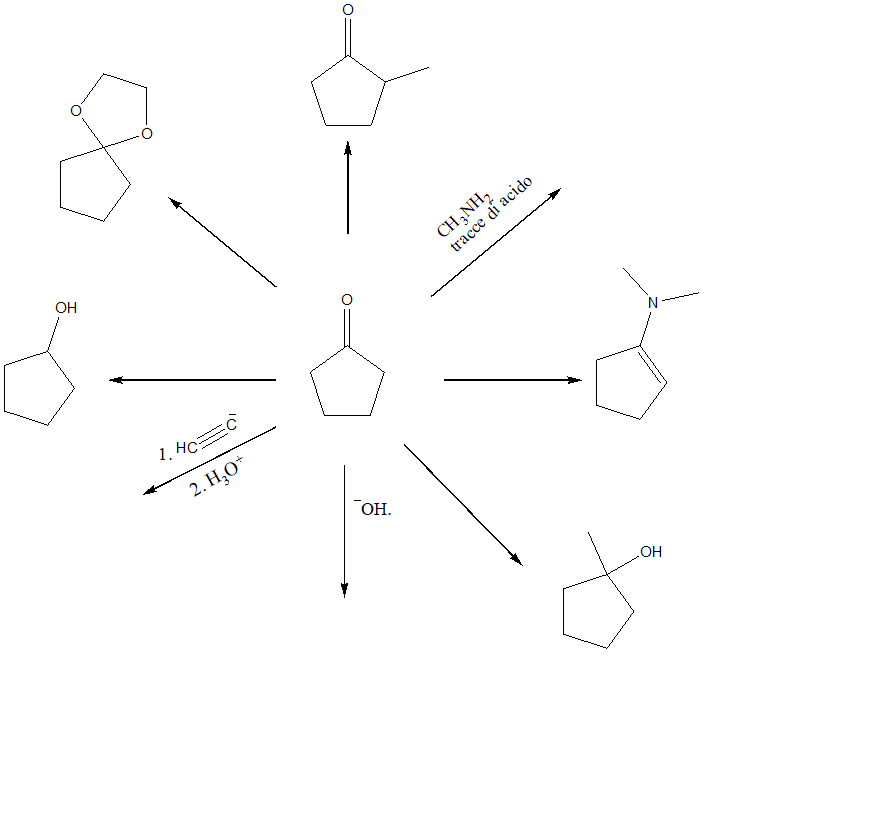
1) Completare il seguente schema aggiungendo le condizioni di reazione o i prodotti. Per ciascuna reazione scrivere il meccanismo dettagliato.
2) Proporre una strategia e il meccanismo di reazione per sintetizzare il 3-metil-2-cicloesenone mediante condensazione aldolica
3) Proporre una strategia e il meccanismo di reazione per sintetizzare l’1,3-cicloesandione mediante condensazione di Claisen
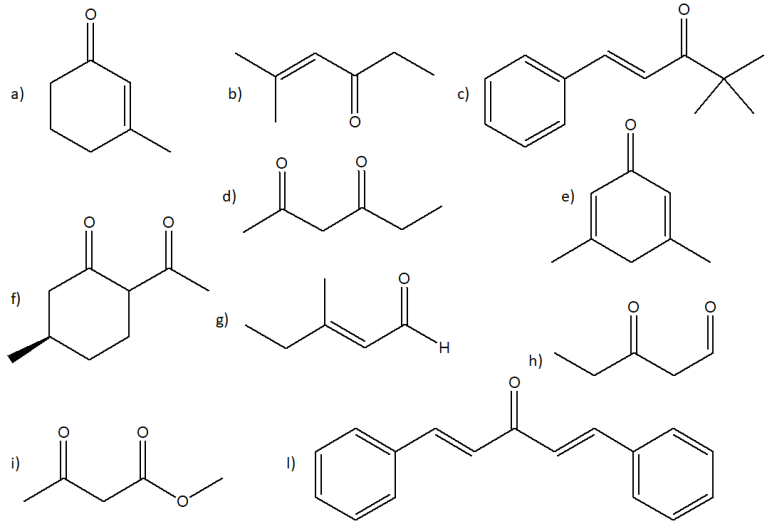
4) Sintetizzare i seguenti composti mediante condensazione aldolica o di Claisen. Indicare per ciascuno le condizioni di reazione, i reagenti, la strategia di sintesi e mostrare il meccanismo.
5) Partendo da acido acetico (=acido etanoico) indicare le condizioni e il maccanismo di reazione (quando possibile) per ottenere i seguenti composti:
a) cloruro di acetile
b) anidride acetica
c) acetato di etile
d) N-metilacetammide
e) etanale
6) Mostrare il meccanismo e i prodotti delle seguenti reazioni

7) Le seguenti reazioni non sono utilizzabili per ottenere il prodotto mostrato in alte rese. Individuare e correggere l’errore in ciascuna reazione.


Suggerimento: per poter usare questi set di esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 2 ore per ciascun set.
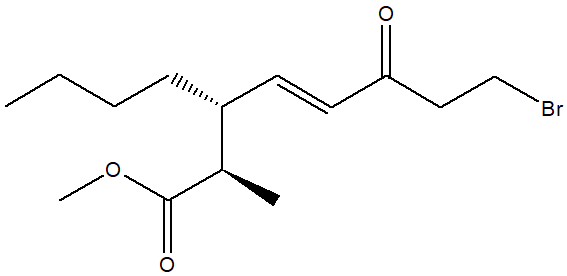
1. Attribuire il nome IUPAC, comprensivo di stereochimica, al seguente composto:
2) Dire se il seguente nome è un nome IUPAC corretto. Se non lo è, scrivere il nome corretto.
5-isopropil-3-otten-6-ino
3) Scrivere un composto chirale di formula C4H8Br2
4) Assegnare le configurazioni assolute ai carboni chirali della seguente molecola. Poi disegnarne a) un diastereoisomero in proiezione di Newman e b) l’enantiomero su una struttura a cavalletto.

5) Disegnare il conformero sfalsato meno stabile del 1-bromo-2,4-dimetilpentano lungo il legame C2-C3 del 1-bromo-2,4-dimetilpentano. Spiegare i fattori che lo rendono il conformero sfalsato meno stabile.
6) Scrivere la strategia di sintesi, il meccanismo e il prodotto (o i prodotti) della reazione di condensazione di Claisen tra il propanone e il propanoato di etile
7) Scrivere il prodotto/i prodotti delle seguenti reazioni. Indicare la stereochimica quando opportuno.
8) Scrivere il dipeptide Ala-Gly (RAla=CH3; RGly=H). Che tipo di legame è quello che si instaura tra i due amminoacidi?
9) Scrivere l’L-glucosio ed il suo epimero in 4 in proiezione di Fischer.
Cosa fare se si riscontrano difficoltà o se si hanno dubbi:
-rivedere gli argomenti problematici (NB: non si possono risolvere gli esercizi senza aver studiato la teoria, per cui sarà necessario studiare e approfondire l’argomento ed eventualmente-successivamente-esercitarsi ulterioremente utilizzando sia gli esercizi del libro sia quelli presenti su questo blog).
-contattare il docente: è possibile sia chiedere spiegazioni, sia fare ricevimento (anche in gruppo) o organizzare esercitazioni dedicate

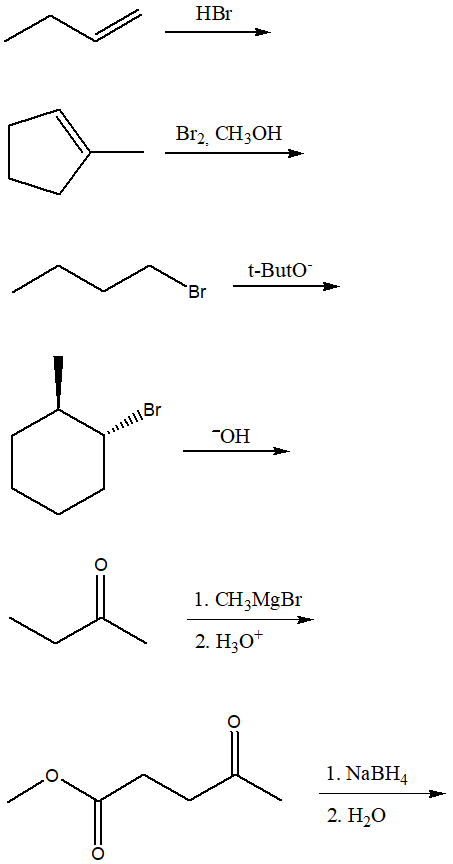
1) Scrivere il meccanismo di reazione e il prodotto (o i prodotti) principale delle seguenti reazioni. Indicare la stereochimica, se appropriato.
2) Quale/i delle seguenti reazioni non dà 3-metil-2-butanolo come prodotto principale?

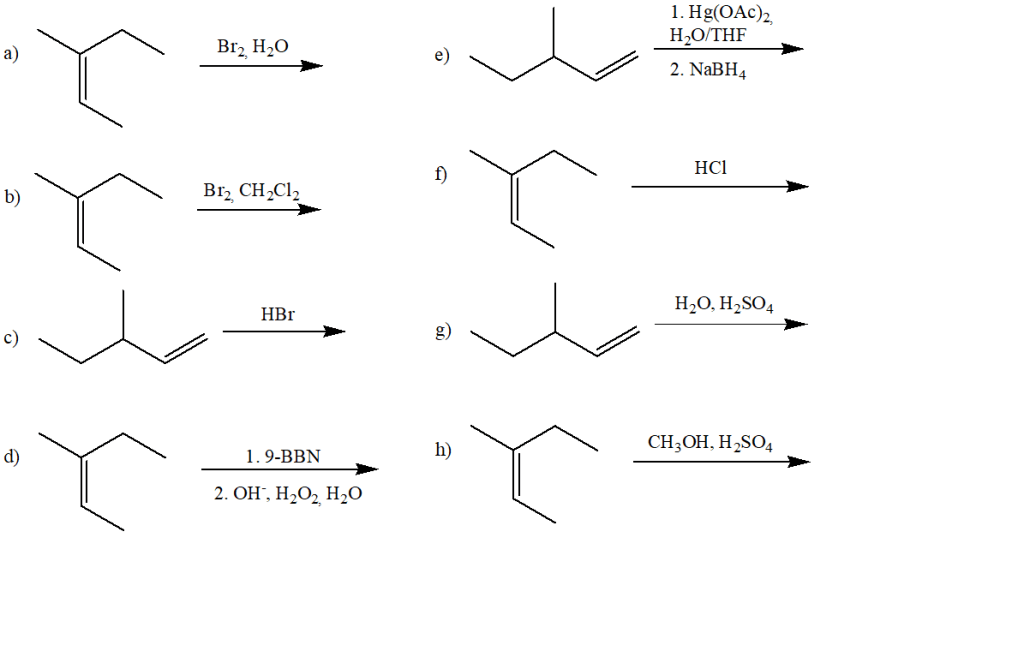
3) Quale/i dei seguenti alcheni darà come prodotto l’1-bromo-1,2-dimetilciclopentano come prodotto principale della reazione con HBr?
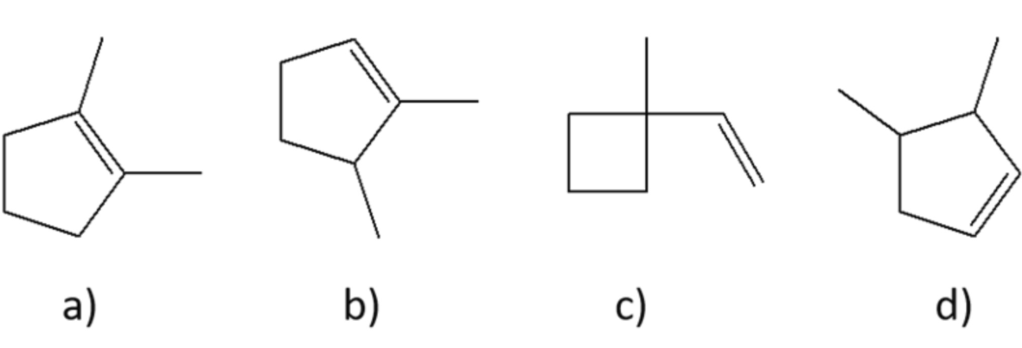
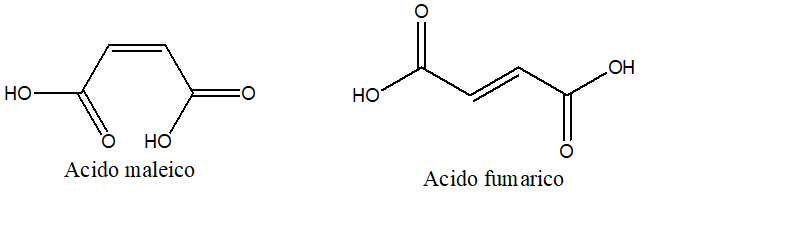
4) Quando l’acido maleico e l’acido fumarico reagiscono con Br2, si forma acido 2,3-dibromosuccinico e il prodotto di reazione non ruota il piano della luce polarizzata. Nel caso dei prodotti ottenuti dall’acido maleico, è però poi possibile risolvere la miscela racemica, ottenendo i due enantiomeri, cosa che non è possibile fare nel caso della reazione a carico dell’acido fumarico. Cosa ci dice questo circa il meccanismo di addizione del bromo?
5) Da quali alcheni derivano i seguenti dioli vicinali?
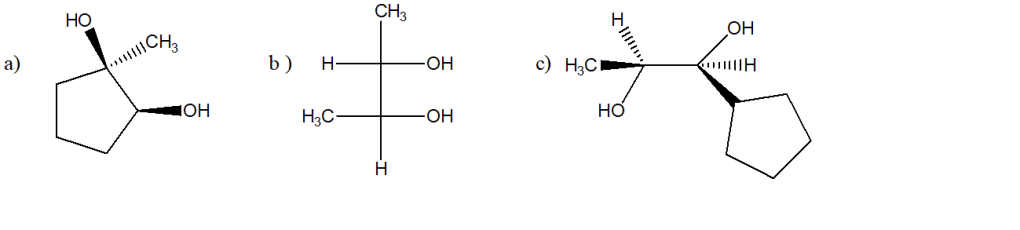
6) Per ciascuna delle seguenti reazioni, scegliere le condizioni di reazione tra le opzioni indicate sotto:

7) Sintetizzare il seguente composto utilizzando 1-butene come unica fonte di atomi di carbonio
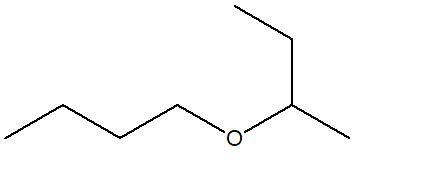
8) Spiegare perché è impossibile sintetizzare il seguente etere utilizzando la reazione tra un alchene e un alcol:

9) A partire dall’opportuno alchene, mostrare il meccanismo di sintesi del seguente composto. Indicare eventuali altri prodotti formati nel corso della reazione
a)

b)
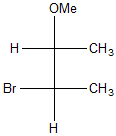
c)
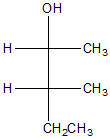
10) Scrivere il nome IUPAC (comprensivo di stereochimica) dei prodotti che si formano quando si fa reagire I) 2-metil-2-butene; II) (R)-3-metil-1-pentene; III) (E)-1-ciclobutil-1-butene con ciascuno dei seguenti reagenti. NB: mostrare il meccanismo per ciascuna reazione, indicando chiaramente anche la stereochimica!
a) HCl
b) Br2 in acqua
c) Br2
d) 1. BH3:THF; 2. H2O2, OH–
e) H2O in ambente acido
f) Hg(OAc)2 in THF e H2O; 2. NaBH4, H2O
g) acido perossiacetico
h) 9-BBN; 2. H2O2, OH–
i) KMnO4

1) Completare la seguente struttura di Lewis e calcolare la carica formale per tutti gli atomi diversi dall’idrogeno:
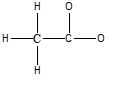
2) Per ogni atomo di carbonio e legame C-C presente nella seguente molecola,
a) definire l’ibridazione, la geometria e l’angolo di legame.
b) Individuare gli orbitali molecolari
c) dire quali orbitali atomici sono coinvolti
d) Individuare, inoltre, il legame C-C più corto
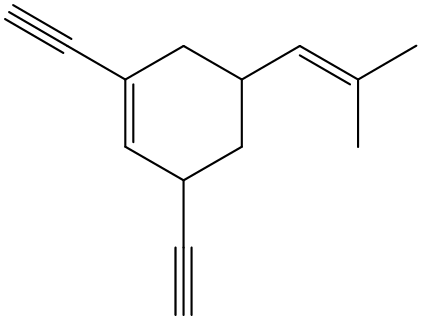
3) Per ciascun gruppo di composti (NB: ogni riga definisce un gruppo), definire l’ordine di acidità crescente:

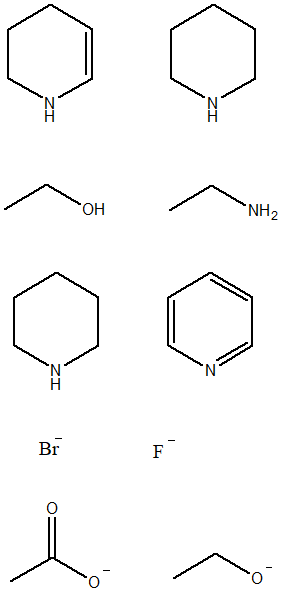
4) Per ciascuna coppia dei seguenti composti, dire qual è il più basico
5) Disegnare la proiezione di Newman del conformero più stabile del 2-metilpropano.
6) Di seguito sono riportati dei composti in proiezione di Newman o rappresentati con le formule a cavalletto:
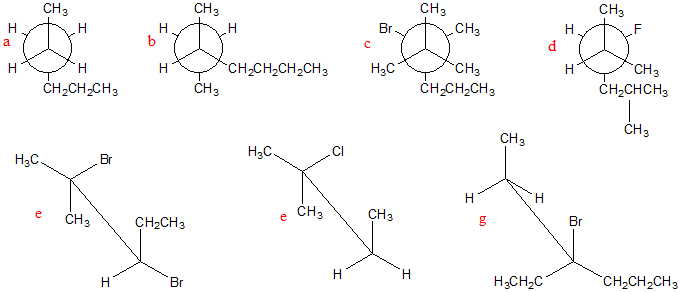
a) attribuire il nome IUPAC a ciascuno composto; b) per tutti i composti rappresentati in proiezione di Newman, scrivere le formule a cavalletto corrispondenti; c) per tutti i composti rappresentati con le formule a cavalletto, scrivere la proiezione di Newman corrispondete; d) dire, per ciascun composto, se quello rappresentato è il conformero più stabile.
7) Scrivere i conformeri sfalsati ed eclissati dei seguenti composti (formule proiettive di
Newman e formule a cavalletto):
a) metilbutano, rispetto al legame C2-C3;
b) 1,2-dibromoetano;
c) 1,2-dicloro-1-fluoroetano;
d) esano, rispetto al legame C3-C4;
e) 2-cloro-3-metilpentano, rispetto al legame C2-C3;
f) 2-metilpentano, rispetto al legame C2-C3;
8) Disegnare i due conformeri a sedia dei seguenti composti e dire qual è il più stabile dei due. Spiegare perchè
a) cis-1-bromo-2-metilcicloesano
b) cis-1-isopropil-3-metilcicloesano
c) trans-1-butil-2-isopropilcicloesano
d) trans-1-t-butil-2-metilcicloesano
9) Disegnare il diagramma di energia potenziale per le conformazioni di etano e 2-cloro-3-metilpentano (prendere in considerazione il legame C2-C3). Indicare anche i conformeri che corrispondono ai massimi e ai minimi di energia.
10) Attribuire il nome IUPAC completo di stereochimica ai seguenti composti

11) Dire se il seguente nome è corretto. Se non lo è, scrivere il nome IUPAC corretto.
1-bromo-3-etil-4-metilcicloesano
12) Scrivere e attribuire il nome IUPAC al composto di formula C8H16 che possiede quattro carboni terziari e quattro carboni primari.
13) Dire qual è la relazione esistente tra i seguenti composti (enantiomeri/diastereoisomeri/ isomeri geometrici/isomeri conformazionali/ stesso composto/isomeri costituzionali/altro) NB: confrontare a/b; a/c; b/c
A)
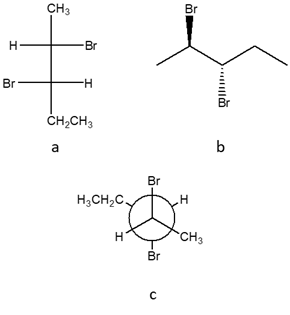
B)

14) Quali dei seguenti composti è otticamente attivo? NB: è possibile scegliere più opzioni
a) (2S,3S)-2,3-diclorobutano
b) (2S,3R)-2,3-dicloropentano
c) (2S,3R)-2,3-diclorobutano
d) (1S,2S)-1,2-diclorociclopentano
15) Dire quale tra le strutture a-d rappresenta l’enantiomero del seguente composto
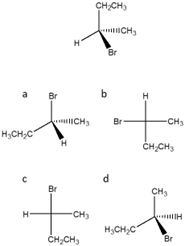

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomentii…e a breve altre saranno pubblicate. In ogni caso, potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti.


Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomentii…e a breve altre saranno pubblicate. In ogni caso, potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti.
La molecola qui sotto riportata è il NAD+/NADP+, ossia il nicotinammide adenina dinucleotide/ nicotinammide adenina dinucleotide fosfato. Si tratta di due coenzimi comunemente usati dagli enzimi per catalizzare reazioni redox. Quella qui mostrata è la forma ossidata.


Suggerimento: per poter usare questi set di esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 2 ore per ciascun set.
PRIMO SET
1. Attribuire il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:
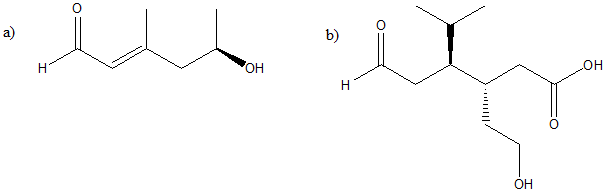
2) Indicare qual è la relazione (isomero strutturale, conformero, enantiomero, diastereoisomero, stesso composto, etc.) delle strutture a, b, c, d con il composto qui mostrato:

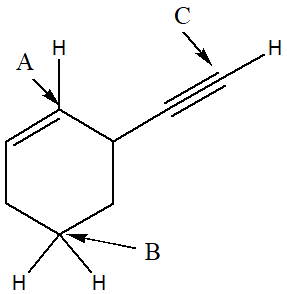
3) Per i carboni indicati da freccia (A, B, C) nella figura seguente, indicare: a) ibridazione, b) angolo di legame, c) geometria. Dire inoltre quale dei legami C-H degli idrogeni evidenziati è il più lungo spiegando sinteticamente perchè.
4) Scrivere il conformero più stabile del trans-1-bromo-4-isopropilcicloesano. Spiegare i fattori che lo rendono più stabile rispetto all’altro conformero. Dire, inoltre, quale tra l’isomero cis e l’isomero trans reagisce più velocemente in una reazione E2.
5) Disegnare il diagramma energetico per la reazione di addizione di acido bromidrico al propene.
6) Mostrare le condizioni e il meccanismo per la seguente trasformazione:

7) Completare le seguenti equazioni indicando le condizioni di reazione o i prodotti

8) Scrivere l’L-galattosio (il galattosio è l’epimero in 4 del glucosio)
SECONDO SET
1. Attribuire il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:

2. Quale delle seguenti strutture è la (2S,3R)-3-bromo-2-butanammina? (NB: è possibile scegliere più di una opzione):

3. Ordina i seguenti composti per acidità crescente e motivare la scelta
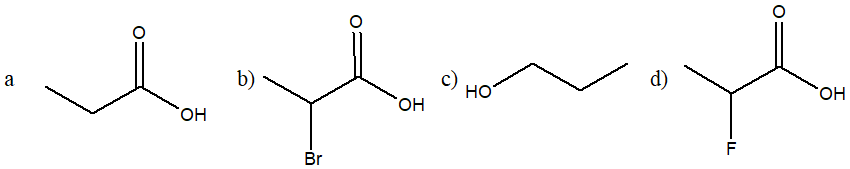
4. Quali sono l’ibridazione, la geometria e l’angolo di legame di un carbonio carbocationico?
5) Scrivere tutte le strutture di risonanza dello ione carbossilato che si ottiene quando l’acido propanoico reagisce con una base. Confrontando il doppio legame C=O dell’acido propanoico con quello presente nel propanone, che considerazioni è possibile fare circa la lunghezza e forza dei legami in questione?
6) A partire dall’opportuno alchene, mostrare il meccanismo che porta alla formazione del seguente prodotto mediante una reazione di idroborazione-ossidazione. Indicare altri prodotti che si formano nel corso della reazione.

7) Le seguenti reazioni daranno, come prodotto principale, degli alcheni che non rispondono alla regola di Zeitzev. Disegnare i prodotti principali e argomentare.

8) Completare il seguente schema sintetico. Indicare la stereochimica quando opportuno

9) Quello mostrato di seguito è un disaccaride, il saccarosio. Dire se è o meno uno zucchero riducente spiegando brevemente perchè

TERZO SET
1. Scrivere il seguente composto e dire se il nome è corretto. Se non lo è, attribuire il nome IUPAC corretto.
4-(3-idrossipropil)-cicloesene
2. Assegnare il nome IUPAC, comprensivo di stereochimica, al seguente composto:
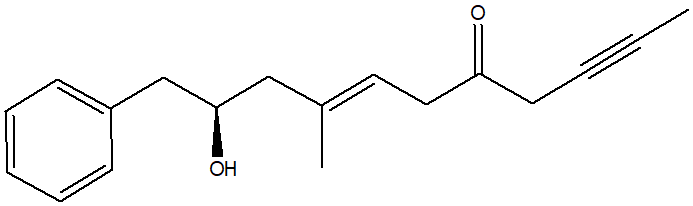
3. Dire se le seguenti molecole sono chirali

4. Qual è la relazione stereochimica che intercorre tra le seguenti strutture?
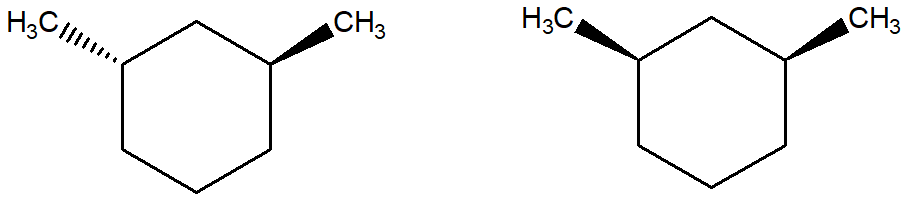
5) Giustificare il carattere aromatico, antiaromatico o non aromatico dei seguenti composti e ioni

6) Quale tra i seguenti è il conformero più stabile del 3-metil-1-butanolo?
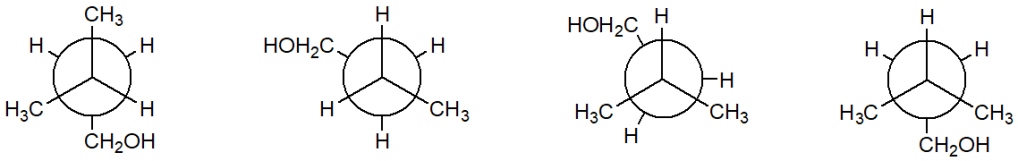
7) Individuare gli idrogeni più acidi per ognuno dei seguenti composti:
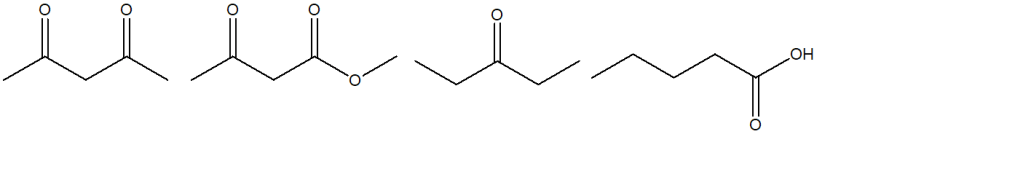
8) A partire da uno dei composti riportati nel riquadro e utilizzando qualsiasi altro reagente necessario, suggerire la sintesi del seguente prodotto, indicando sulle frecce le condizioni di reazione.


9) Mostrare la sintesi del 4-metil-3-penten-2-one a partire dal propanone.
10) Scrivere i prodotti principali delle seguenti reazioni. Indicare la stereochimica dei prodotti quando opportuno

12) Scrivere l’α-D-glucopiranosio in proiezione di Haworth
Cosa fare se si riscontrano difficoltà o se si hanno dubbi:
-rivedere gli argomenti problematici (NB: non si possono risolvere gli esercizi senza aver studiato la teoria, per cui sarà necessario studiare e approfondire l’argomento ed eventualmente-successivamente-esercitarsi ulterioremente utilizzando sia gli esercizi del libro sia quelli presenti su questo blog).
-contattare il docente: è possibile sia chiedere spiegazioni, sia fare ricevimento (anche in gruppo) o organizzare esercitazioni dedicate

1) Un composto è aromatico se:
1) ha una nuvola ininterrotta di elettroni π (per cui il composto deve essere ciclico, planare e ogni atomo dell’anello deve possedere un orbitale p);
2) contiene 4n+2 elettroni π (ovvero un numero dispari di coppie di elettroni π).
Un composto è antiaromatico se soddisfa il primo ma non il secondo criterio per l’aromaticità. I composti antiaromatici sono quindi ciclici, planari, costituiti da una nube ininterrotta di elettroni π, ma hanno numero pari di coppie di elettroni π. I composti antiaromatici non possono riempire i loro orbitali molecolari di legame, per cui risultano molto instabili e altamente reattiviti:

Classifica i seguenti composti o ioni come aromatici, antiaromatici o non aromatici, giustificando la scelta:

2) Assegnare il nome IUPAC ai seguenti composti

3) Mostrare la sintesi delle molecole a-e dell’esercizio 2 a partire dal benzene.
4) In relazione ai composti sintetizzati nell’esercizio 3, che effetto hanno i sostituenti introdotti sulla reattività del benzene? Come orientano eventuali ulteriori sostituenti? Motivare la risposta.
5) Come sintetizzeresti il composto h dell’esercizio 3 a partire dal benzene?