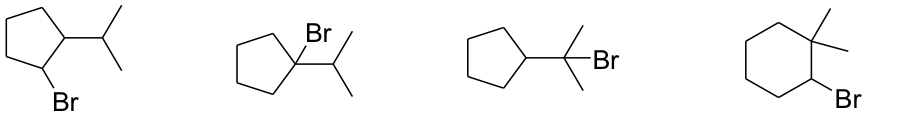
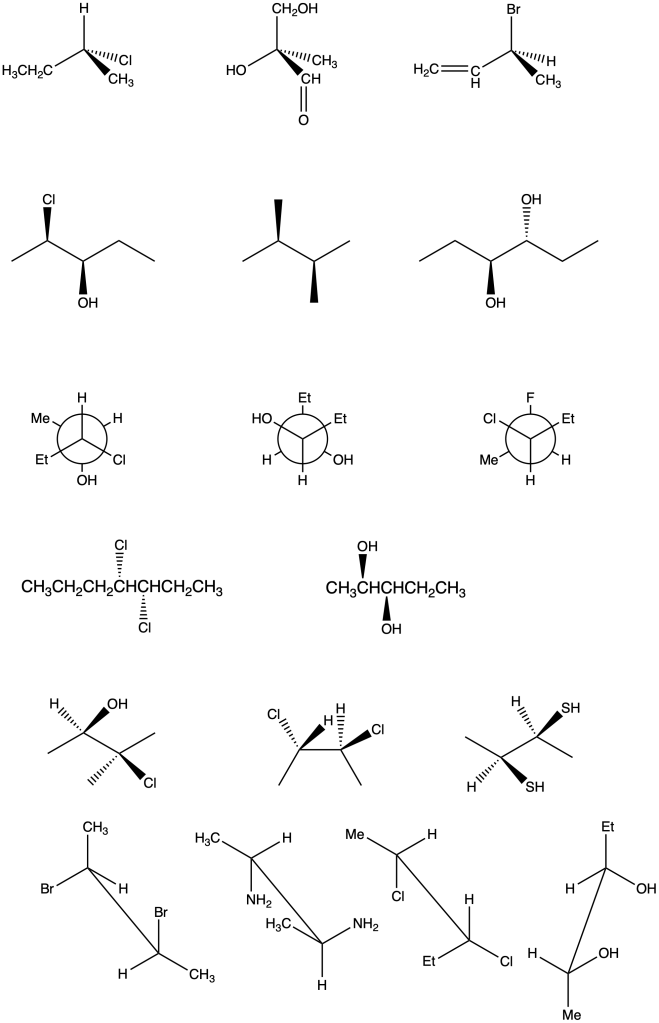
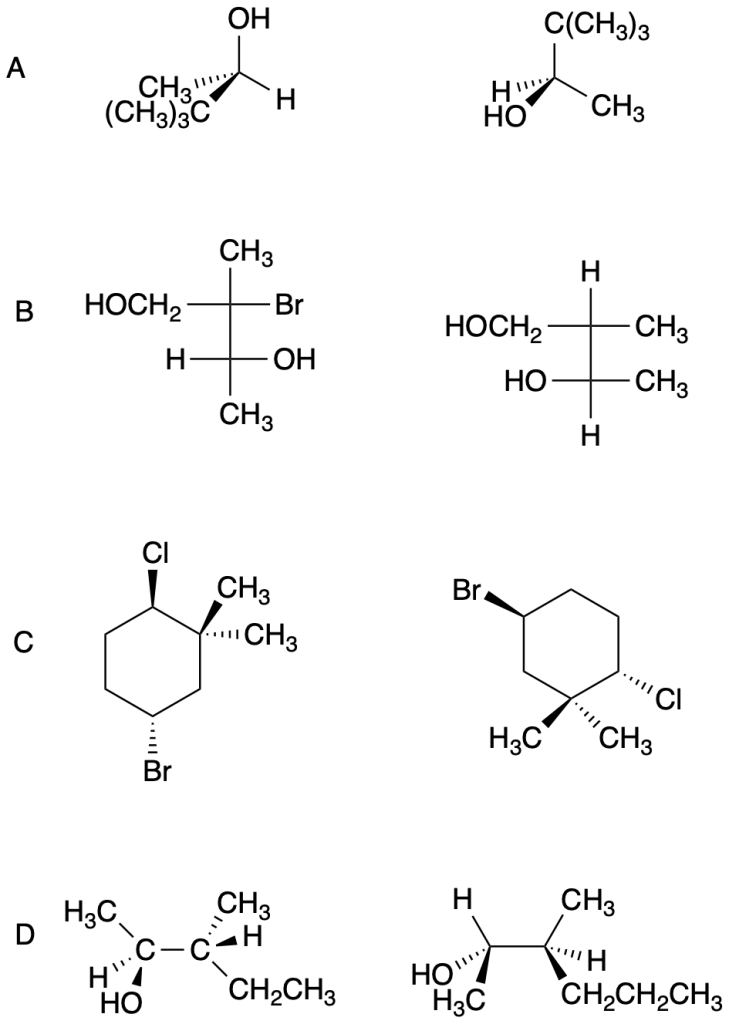
Esercizio n. 1
Osservando il seguente diagramma di energia potenziale /coordinata di reazione che da A porta a I, rispondi alle seguenti domande:
a. Quanti intermedi ci sono nella reazione?
b. Quali lettere indicano gli stati di transizione?
c. Qual è lo stadio più veloce della reazione?
d. Chi è più stabile, A o I?
e. Partendo da C, si forma più velocemente A o E?
f. Qual è il reagente dello stadio cineticamente determinante?
g. Il primo stadio della reazione è esorgonico o endoergonico?
h. La reazione complessiva è esoergonica o endoergonica?
i. Qual è l’intermedio più stabile?
j. Quale stadio nella reazione diretta ha la costante cinetica più piccola?
k. Quale stadio nella reazione inversa ha la costante cinetica più piccola?
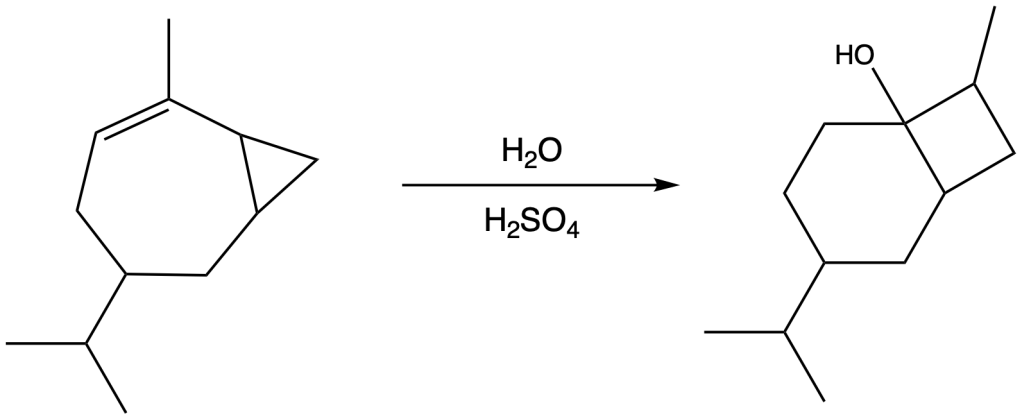
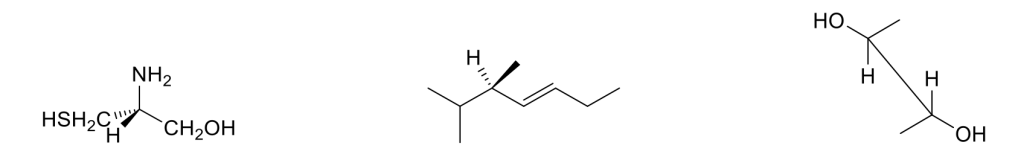
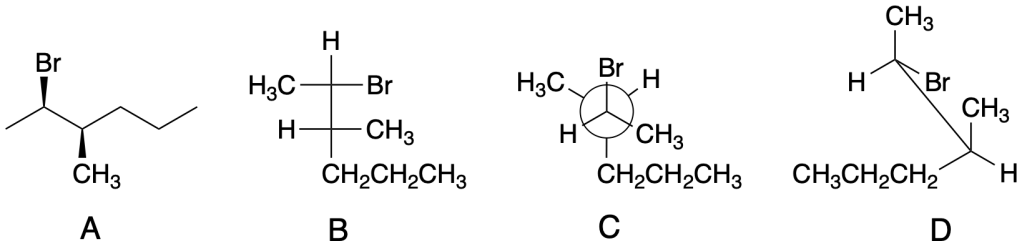
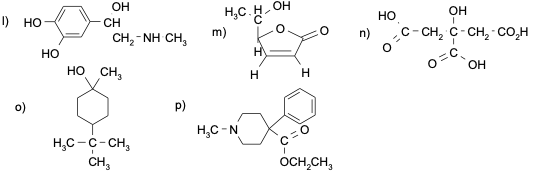
Esercizio n. 2
Osservando il seguente diagramma di energia potenziale /coordinata di reazione che da A porta a G, rispondi alle seguenti domande:
a. Quanti intermedi ci sono nella reazione?
b. Quali lettere indicano gli stati di transizione?
c. Qual è lo stadio più veloce della reazione?
d. Chi è più stabile, A o G?
e. Partendo da C, si forma più velocemente A o E?
f. Qual è il reagente dello stadio cineticamente determinante?
g. Il primo stadio della reazione è esorgonico o endoergonico?
h. La reazione complessiva è esoergonica o endoergonica?
i. Qual è l’intermedio più stabile?
j. Quale stadio nella reazione diretta ha la costante cinetica più piccola?
k. Quale stadio nella reazione inversa ha la costante cinetica più piccola?
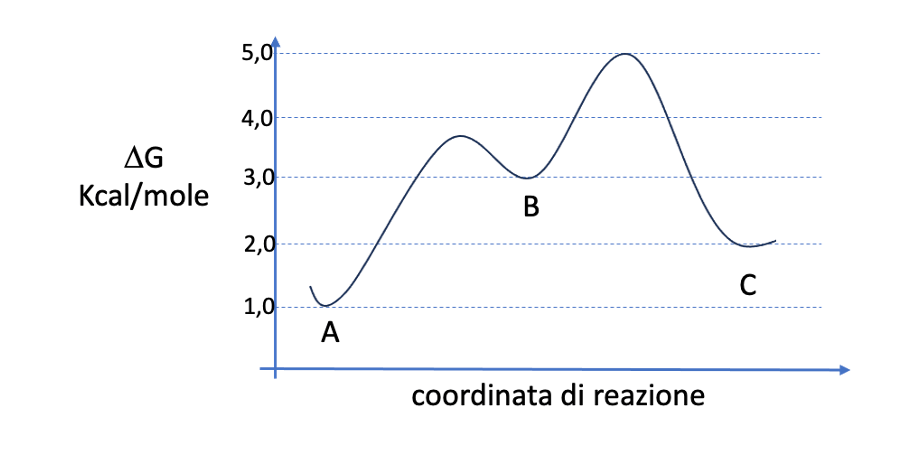
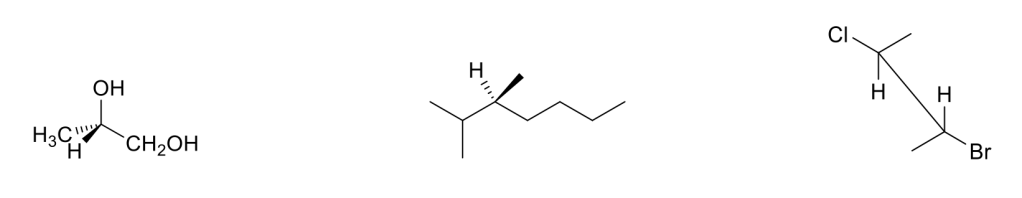
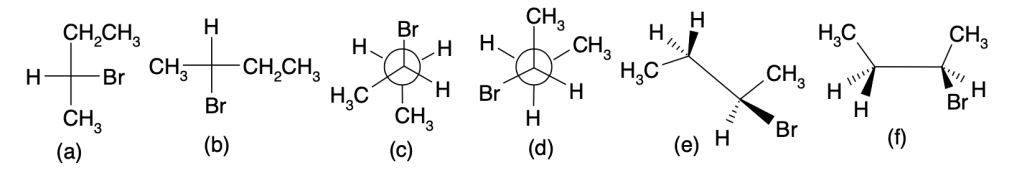
Esercizio n. 3
4. Considerando il diagramma dell’energia riportato nella pagina seguente:
a) Qual è lo stadio lento di A→C?
b) Qual è il ΔG° di B→C?
c) Qual è il ΔG‡ di A→B?
d) Qual è ΔG‡ di C→B? (3 pt):
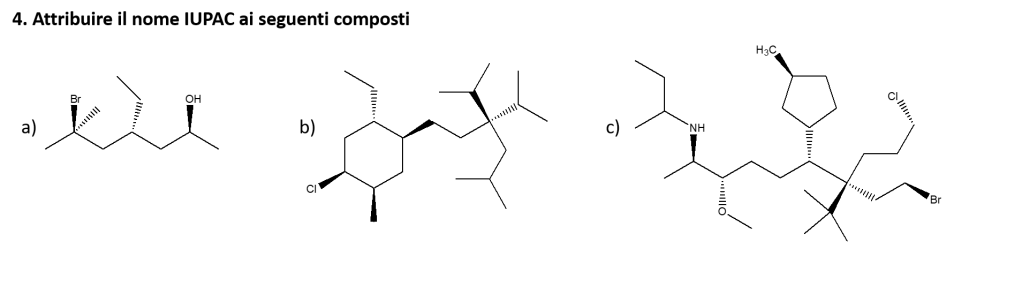
Esercizio n. 4
Disegna il diagramma dell’energia libera in funzione della coordinata di reazione per la seguente trasformazione, in cui C è il composto più stabile e B il meno stabile delle tre specie e lo stato di transizione da A a B è più stabile dello stato di transizione da B a C:
a. Quanti intermedi ci sono?
b. Quanti stati di transizione?
c. Quale stadio ha la maggiore costante cinetica per la trasformazione diretta?
d. Quale stadio ha la maggiore costante cinetica per la reazione inversa?
e. Dei quattro stadi, quale ha la costante cinetica maggiore?
f. Qual è lo stadio cineticamente determinante pe rla reazione diretta?
g. Qual è lo stadio cineticamente determinante per la reazione inversa?
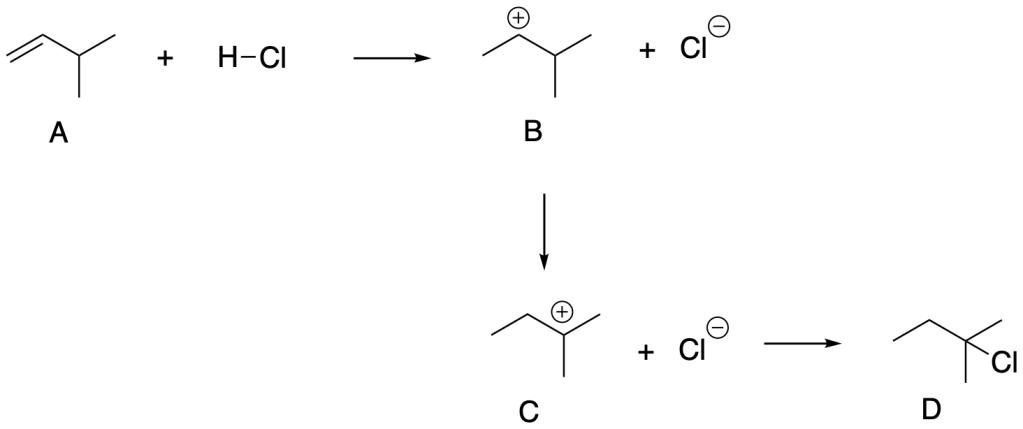
Esercizio n. 5
Data la seguente reazione in cui D è il composto più stabile e A :
a. Indica il movimento degli elettroni con le frecce ricurve
b. Dsegna il diagramma dell’energia libera in funzione della coordinata di reazione
c. Quanto stati di transizione ?
d. Disegna tutti gli stati di transizione































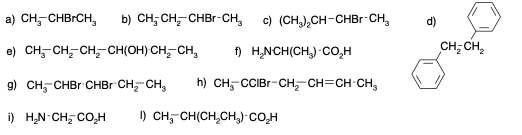



You must be logged in to post a comment.