Corso di Laurea Magistrale in Farmacia – PRIMA PROVA INTERCORSO DI CHIMICA ORGANICA
La prima prova intercorso di Chimica Organica si terrà
VENERDI’ 14 OTTOBRE ALLE ORE 16:30
in aula A2
Università degli Studi della Campania "Luigi Vanvitelli"
La prima prova intercorso di Chimica Organica si terrà
VENERDI’ 14 OTTOBRE ALLE ORE 16:30
in aula A2

Esercizio n. 1
Assegna un nome ai seguenti composti:
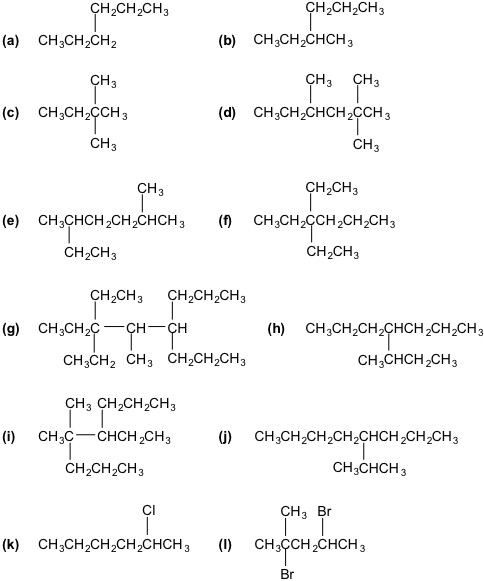

Esercizio n. 2
Scrivi le formule di struttura dei seguenti composti:
| (a) 2,3-dimetilesano (b) 4,4-dietildecano (c) 4-isopropil-2,4,5-trimetileptano (d) 2,2-dimetil-4-propilottano (e) 4-isobutil-2,5-dimetilottano (f) neopentil bromuro (g) 4,5-diisopropilnonano (h) 4-terz-butileptano | (i) 5,5-dibromo-2-metilottano (j) 3,4-dimetilottano (k) 2,2,4-trimetilesano (l) 5-butil-2,2-dimetilnonano (m) 3,3-dimetilpentano (n) 1,1,1-tricloroetano (o) 3-etil-2,4,5-trimetilottano (p) 3-etil-5-iodoeptano |
Esercizio n. 3
Spiega perché ognuno dei seguenti nomi non è un corretto nome IUPAC. Scrivi il nome IUPAC corretto.
| (a) 1,3-dimetilbutano (b) 4-metilpentano (c) 2,2-dietilbutano (d) 2-etil-metilpentano (e) 4,4-dimetilesano (f) 2-propilpentano | (g) 2,2-dietileptano (h) 5-butilottano (i) 2,2-dimetilciclopropano (j) 2-sec-butilottano (k) 4-isopentileptano (l) 1,3-dimetil-6-etilcicloesano |

Esercizio n. 1
Scrivi le strutture dei seguenti composti:
a) 4,6-dietil-3,4,5,6-tetrametildecano
b) 7-etil-4-isopropil-3,4-dimetilnonano
c) 4-etil-3-isopropil-2-metilesano
d) 3-etil-3,4,5-trimetilnonano
e) 3-etil-4,4-dimetileptano
Esercizio n. 2
Scrivi il nome IUPAC dei seguenti alcani
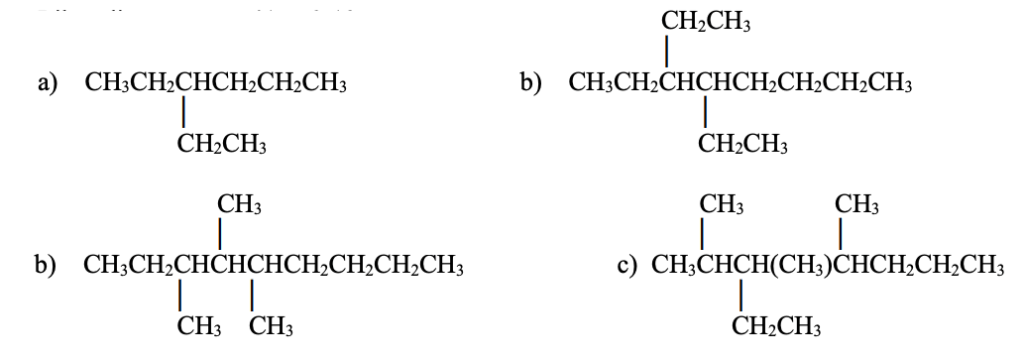
Esercizio n. 3
Scrivi il nome IUPéAC dei seguenti composti:
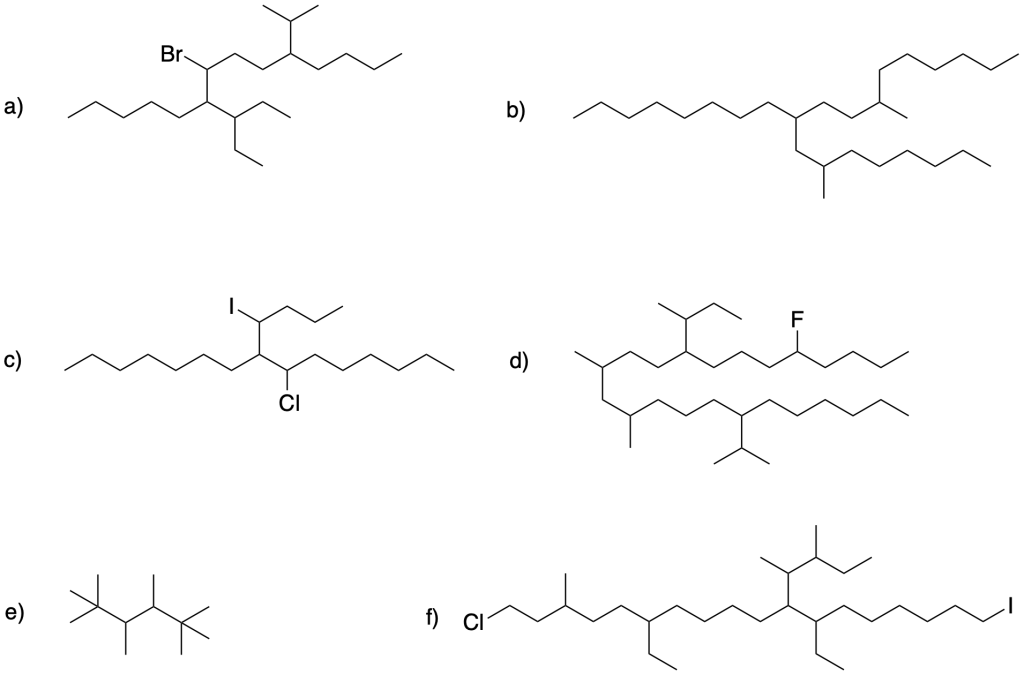

Esercizio n. 1
A) determinate se ciascuna delle specie che compaiono nelle seguenti equazioni si comporta da acido o da base di Brønsted e indicatelo sopra la formula.
B) indicate se l’equilibrio è spostato a sinistra o a destra.
C) utilizzate le frecce curve per mostrare il movimento degli elettroni in ciascuna reazione acido-base.

Esercizio n. 2
Identificate ciascuna delle specie seguenti come acido di Lewis o come base di Lewis e per ognuna scrivete un’equazione che mostri una reazione acido-base di Lewis. Utilizzate le frecce curve per rappresentare il movimento dei doppietti di elettroni. Controllate che il prodotto di ciascuna reazione sia rappresentato da una struttura di Lewis completa e corretta.
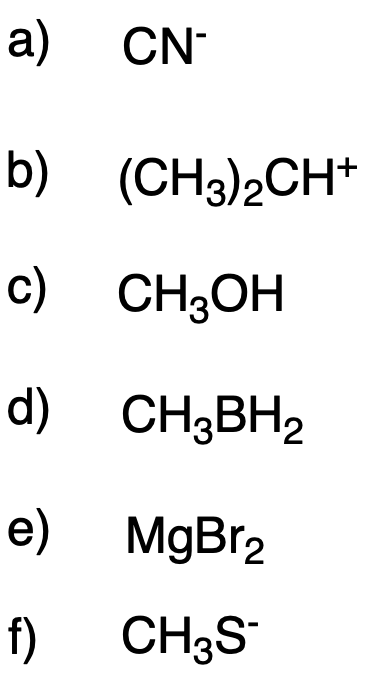
Esercizio n. 3
Sulla base delle informazioni riportate sotto, indicare dove è spostato il seguente equilibrio acido-base:
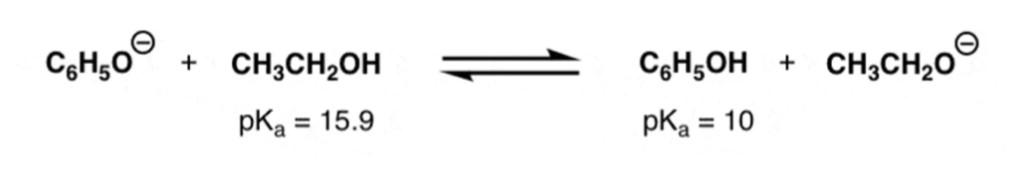
Esercizio n. 4
Di seguito sono riportate delle coppie di composti, dire quale composto di ciascuna coppia ha il pK. più basso

Esercizio n. 5
Disporre i seguenti composti in ordine di acidità crescente
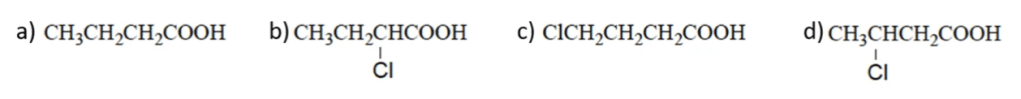
Esercizio n. 6
Disporre i seguenti composti in ordine di acidità crescente
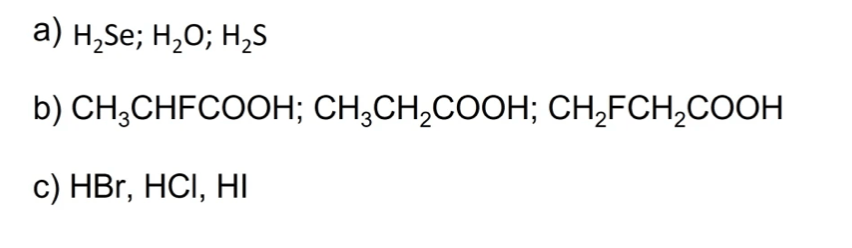
Esercizio n. 7
Metti i seguenti composti in ordine di acidità crescente:
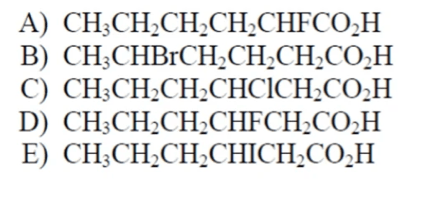
Esercizio n. 8
Metti i seguenti composti in ordine di basicità crescente


Esercizio n. 1
Per ciascuna delle molecole sottostanti:
a) prevedete approssimativamente la geometria di oguno degli atomi indicati dalla freccia. Specificare il tipo dio ibridazione che giustifica tale geometria;
b) descrivete gli orbitali utilizzati per formare ciascun legame agli atomi indicati dalle frecce (s, p, ibridi sp, sp2, sp3);
c) disegnate e mostrate la sovrapposizione degli orbitali coinvolti nei legami indicati al punto b);
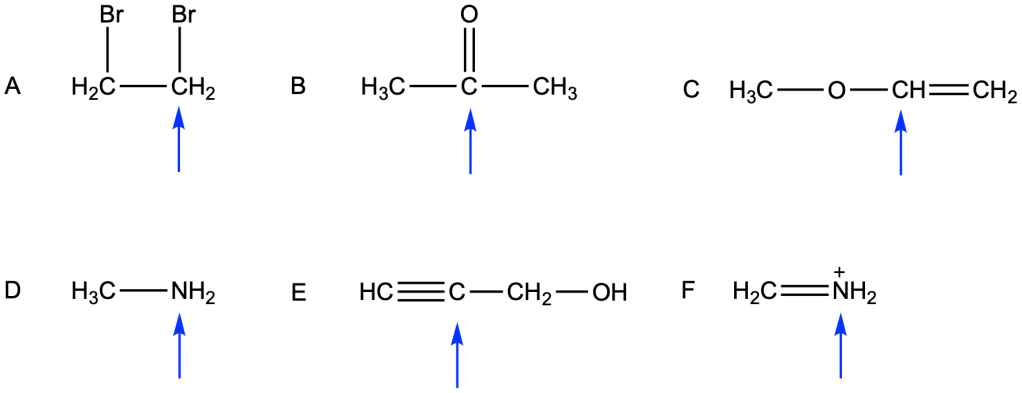
Esercizio n. 2
Certi composti, come quello rappresentato in basso, sono dotati di una potente attività biologica contro tipi di cellule caratteristici del cancro alla prostata. In questa struttura, individuate in esempio di ciascuno dei seguenti tipi di atomi o legami:
a) un legame covalente singolo fortemente polarizzato;
b) un doppio legame covalente fortemente polarizzato;
c) un legame covalente quasi polare;
d) un atomo di carbonio ibridato sp;
e) un atomo di carbonio ibridato sp2;
f) un atomo di carbonio ibridato sp3;
g) un legame tra atomi con ibridazione diversa;
h) il legame più lungo della molecola;
i) in legame più corto nella molecola (esclusi i legami agli atomi di idrogeno).

Esercizio n. 3
Nella seguente figura, alcuni dei legami sono indicati da freccia e da una lettera.
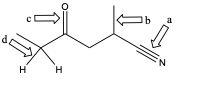
1) Etichettare i legami a-d come singoli, doppi o tripli;
2) indicare il tipo di orbitale/i molecolare/i;
3) dire quali orbitali atomici sono coinvolti nella formazione del legame.
4) Considerando tutti i legami singoli della molecola (ed escludendo i legami C-H) qual è il legame più corto?
Esercizio n. 4
Completare la seguente struttura di Lewis e calcolare la carica formale per tutti gli atomi diversi dall’idrogeno:


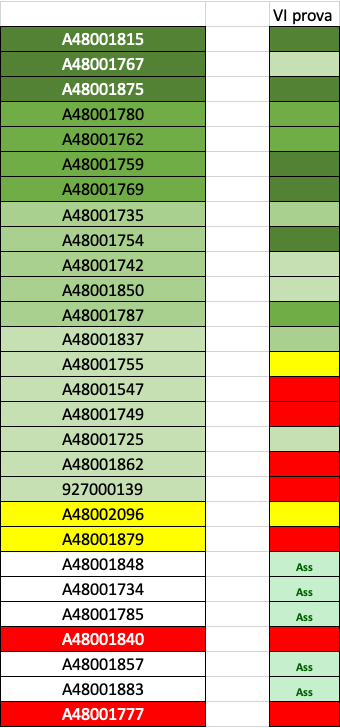
Di seguito sono riportati i risultati della prova in oggetto. In verde sono indicati gli studenti che hanno superato la prova scritta.
In giallo sono indicati gli studenti che hanno superato CON RISERVA (voto <18).
Per tutti gli altri studenti la prova si intende NON superata:
in rosso o nero è indicata una insufficienza gravissima (rosso–> voto<10, nero <2).
Si ricorda che i voti sono espressi in trentesimi!

La prova orale si terrà mercoledì 5 ottobre alle ore 15,00.
Tutti coloro che hanno sostenuto la prova potranno prenderne visione prenotandosi per il ricevimento e/o fissando appuntamento con il docente.
Link per fissare un appuntamento:
https://doodle.com/bp/antoniofiorentino/ricevimento-di-chimica-organica

Si suggerisce a coloro che incontrano difficoltà ma che vogliono affrontare seriamente lo studio della materia, di seguire il corso di chimica organica.
Si ribadisce la disponibilità del docente a ricevere gli studenti per spiegazioni e/o correzione di esercizi (evitare di chiedere appuntamento “per farsi vedere”)

Esercizio n.1
Calcolare la carica formale per tutti gli atomi (tranne idrogeno) delle seguenti specie.

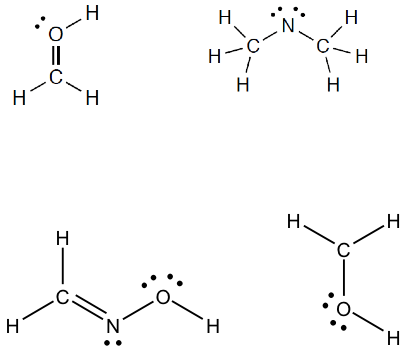
Esercizio n. 2
Scrivere la struttura di Lewis dell’anione nitrato
Esercizio n. 3
Rappresentare la struttura di Lewis dello ione idrogenosolfato. Calcolare le cariche formali e scrivere almeno due strutture di risonanza.
Esercizio n. 4
Rappresentare la struttura di Lewis, comprendendo i tipici contributi alla struttura di risonanza (ove appropriato) in relazione a: (a) cloruro di ammonio; (b) ipoclorito di calcio.
Esercizio n. 5
Scrivere tre strutture di risonanza a differente energia dello ione periodato. Determinare la carica formale di ciascun atomo ed identificare la struttura di energia minima
Esercizio n. 6
Rappresentare la struttura di Lewis dello:
(a) ione solfato
(b) ione solfito
Calcolare le cariche formali e scrivere almeno due strutture di risonanza per ogni specie

Esercizio n. 1
Un saggio per la presenza degli ioni ferro (III) in soluzione consiste nell’aggiungere una soluzione di tiocianato di potassio, KSCN, ciò fornisce la colorazione rosso-sangue di un composto ferro-ione tiocianato. Formulare tre strutture di Lewis con diversa disposizione degli atomi per lo ione tiocianato e individuare la struttura più plausibile come quella in cui le cariche formali si approssimano allo zero. Per semplicità consideriamo solamente le strutture che contengono doppi legami.
Esercizio 2
Suggerire una struttura plausibile per il gas tossico fosgene, COCl2. Formulare la struttura di Lewis e indicare le cariche formali
Esercizio n. 3
In quale dei seguenti composti i legami hanno maggiore carattere ionico? (a) CO2; (b) NO2
Esercizio n. 4
In quale tra i composti NaBr e MgBr2 i legami manifestano più accentuato carattere covalente?
Esercizio n. 5
Disporre le seguenti coppie di ioni in ordine di raggio atomico crescente: (a) Mg2+ e Al3+; (b) O2- e S2- ; Ca2+ e K+; S2- e Cl–
Esercizio n. 6
Il cloro può presentare stati di ossidazione sia positivi che negativi. Qual è il numero di ossidazione massimo (a9 positivo, (b) negativo che esso può manifestare? (c) formulare la configurazione elettronica di tali ststi. (d) spiegare come sono stati stabiliti i valori scelti.
Esercizio n. 7
rappresentare la struttura di Lewis, comprendendo i tipici contributori alla struttura di risonanza in relazione a (a) ione solfito; (b) ione idrogenosolfito; (c) ione perclorato; (d) ione nitrito.
Esercizio n. 8
Per ciascuna coppia, individuare il composto i cui legami manifestano ilo maggiore carattere ionico: (a) HCl e HI; (b) CH4 e CF4; (c) CO2 e CS2

Di seguito sono riportati i risultati della prova in oggetto. In verde sono indicati tutti gli studenti che hanno superato la prova scritta (tonalità diverse indicano l’appartenenza a diverse fasce di voto).
In giallo sono indicati gli studenti che hanno superato CON RISERVA (voto <18).
Per tutti gli altri studenti la prova si intende NON superata:
in arancione è indicata un’insufficienza grave (voto<15),
in rosso o nero è indicata una insufficienza gravissima (rosso–> voto<12, nero <3). In nero sono indicati anche gli studenti ritirati.
Si ricorda che i voti sono espressi in trentesimi!

La prova orale si terrà giovedì 28 luglio alle ore 10,00.
Tutti coloro che hanno sostenuto la prova potranno prenderne visione prenotandosi per il ricevimento e/o fissando appuntamento con il docente.
Link per fissare un appuntamento:
https://doodle.com/bp/antoniofiorentino/ricevimento-di-chimica-organica

Gli studenti che per l’ennesima volta non hanno superato la prova avranno capito che questo esame non si supera “per tentativi” o per “sfiancamento/sfinimento del docente” ma solamente con lo studio. Si suggerisce a coloro che incontrano difficoltà ma che vogliono affrontare seriamente lo studio della materia, di seguire il corso di chimica organica che inizierà il prossimo 26 settembre.
Si ribadisce la disponibilità del docente a ricevere gli studenti per spiegazioni e/o correzione di esercizi (evitare di chiedere appuntamento “per farsi vedere”)

Gli studenti riportati nel seguente elenco, con l’eccezione delle matricole nelle caselle rosse e bianche, sono ammessi alla prova orale di chimica organica.
Le prove hanno validità fino a settembre 2022. Nei prossimi giorni saranno pubblicate informazioni per gli esami orali.
You must be logged in to post a comment.