Esercizio n. 1
Completare le seguenti reazioni, scrivendo i prodotti di sostituzione. Illustrare il meccanismo e specificare la stereochimica, se necessario.
a) 1-bromoeptano + CN–;
b) iodociclopentano + etantiolato di potassio;
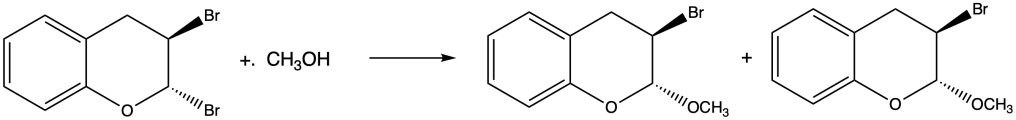
c) clorobenzene + metanolo;
d) bromuro di benzile + OH–;
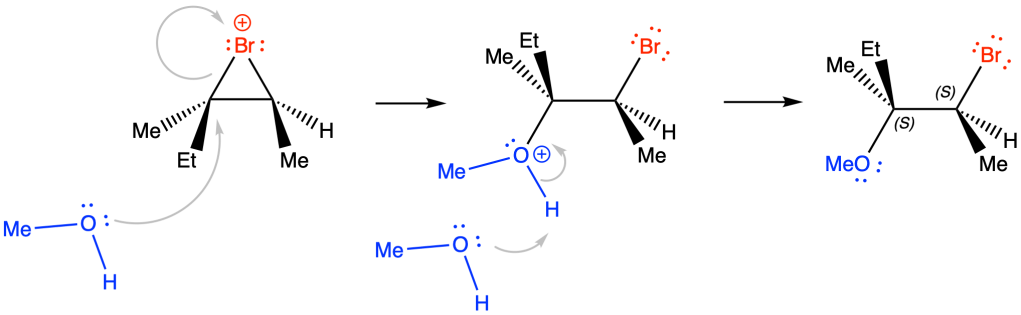
e) 1-cloro-1-butene + Br–
f) (R)-2-bromocicloesano + CH3CH2O–
g) cloruro di benzile + etanolo
h) 1-bromo-2-pentene + metossido di potassio
i) 1-bromo-2-butene + metanolo
l) 1-bromo-2-metilenecicloesano + CN-
m) 1-bromo-2-metilenecicloesano + metanolo
n) 1-bromo-2,4-eptadiene + metanolo
Esercizio n. 2
Quali delle seguenti affermazioni sono tipiche di un meccanismo SN2:
a) La reazione procede con inversione di configurazione
b) L’ordine di reattività dell’alogenuro alchilico è il seguente: metile (più veloce) > 1° >2° > 3°
c) Possono avvenire riarrangiamenti
d) La velocità di reazione dipende dalla concentrazione del nucleofilo e dell’alogenuro alchilico
e) La reazione è, generalmente, più veloce in solventi polari aprotici
f) la velocità dipende dalla concentrazione del nucleofilo
g) la reazione avviene in uno stadio
h) Si forma un intermedio carbocationico
l) Si ottiene un prodotto in cui l’ibridazione del C che ha reagito è diversa da quella che aveva nel prodotto di partenza.
Esercizio n. 3
Quali delle seguenti affermazioni sono vere per sostituzioni nucleofile che avvengono con meccanismo SN2 e quali sono vere per sostituzioni nucleofile che avvengono con meccanismo SN1?
a) gli alogenuri terziari reagiscono più velocemente dei secondari;
b) se si usa un substrato otticamente attivo, la configurazione del prodotto è opposta a quella del prodotto di partenza;
c) la velocità della reazione dipende solo dalla concentrazione del substrato;
d) la reazione avviene in un solo stadio;
e) i carbocationi sono intermedi della reazione;
f) la velocità della reazione dipende dalla natura del gruppo uscente;
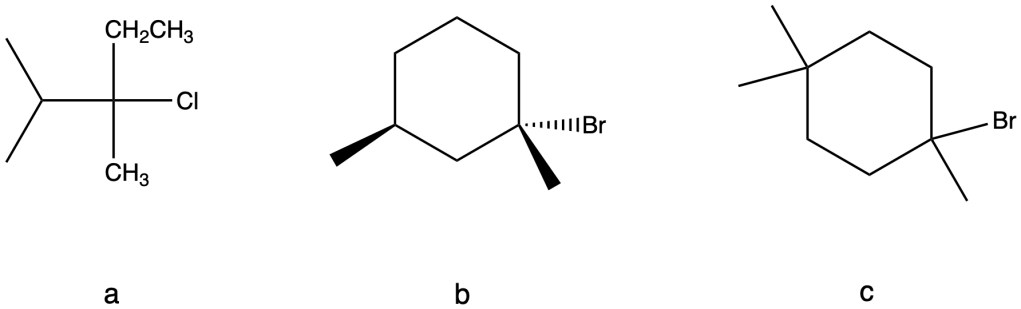
g) il 2,2-dimetil-1-cloropropano è poco reattivo.
Esercizio n. 4
Spiegare perché:
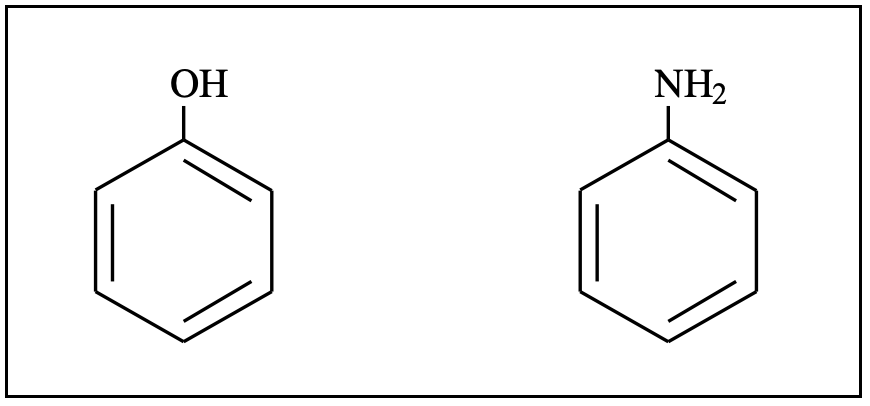
a) lo ione fenato (=fenossido) è un nucleofilo più forte dello ione p-nitrofenato;
b) la reazione del 2-cloropropano con KCN in acetone è più lenta di quella dell’1-cloropropano;
c) i derivati allilici reagiscono rapidamente sia in condizioni di sostituzione unimolecolare che bimolecolare;
d) il clorometil metil etere dà reazione SN1 molto velocemente.
Esercizio n. 5
Quale è il meccanismo di reazione (SN1, SN2, E1, E2) più probabile nelle seguenti condizioni di reazione. Argomentare la scelta fatta
a) 2-bromopropano + KI in acetone;
b) 2-bromopropano + acetato di sodio in acqua;
c) 2-bromopropano + etanolo;
d) 2-bromopropano + etanolo, a caldo.
Esercizio n. 6
Indicare il prodotto principale di eliminazione che si ottiene dalle seguenti reazioni. Specificare la stereochimica.
a) (R)-2-iodopentano + NaOH (alta concentrazione)
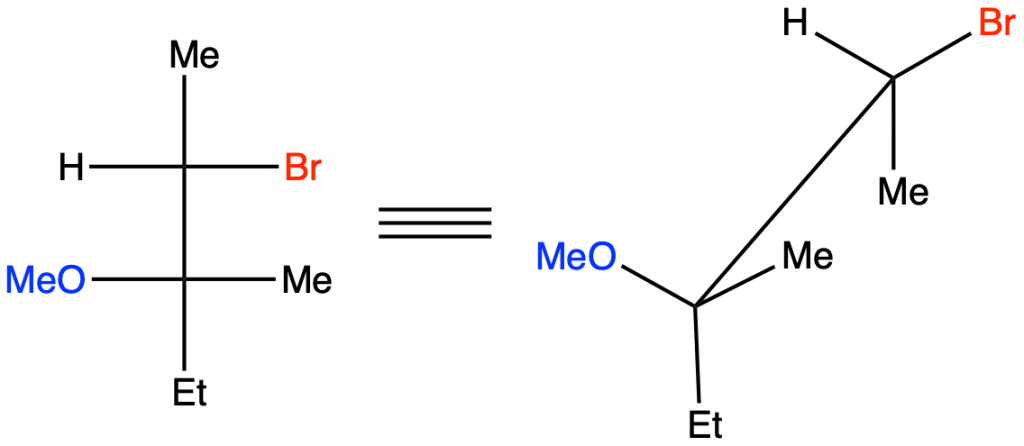
b) (R)-3-cloro-3-metileptano + isopropanolo
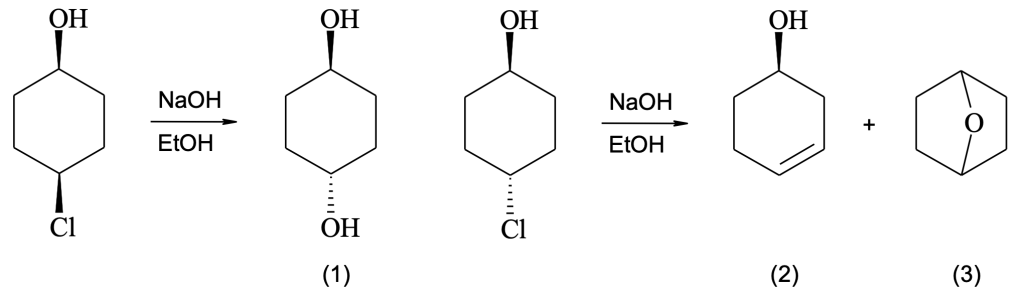
c) trans 1-cloro-2-metilcicloesano + NaOH (alta concentrazione)
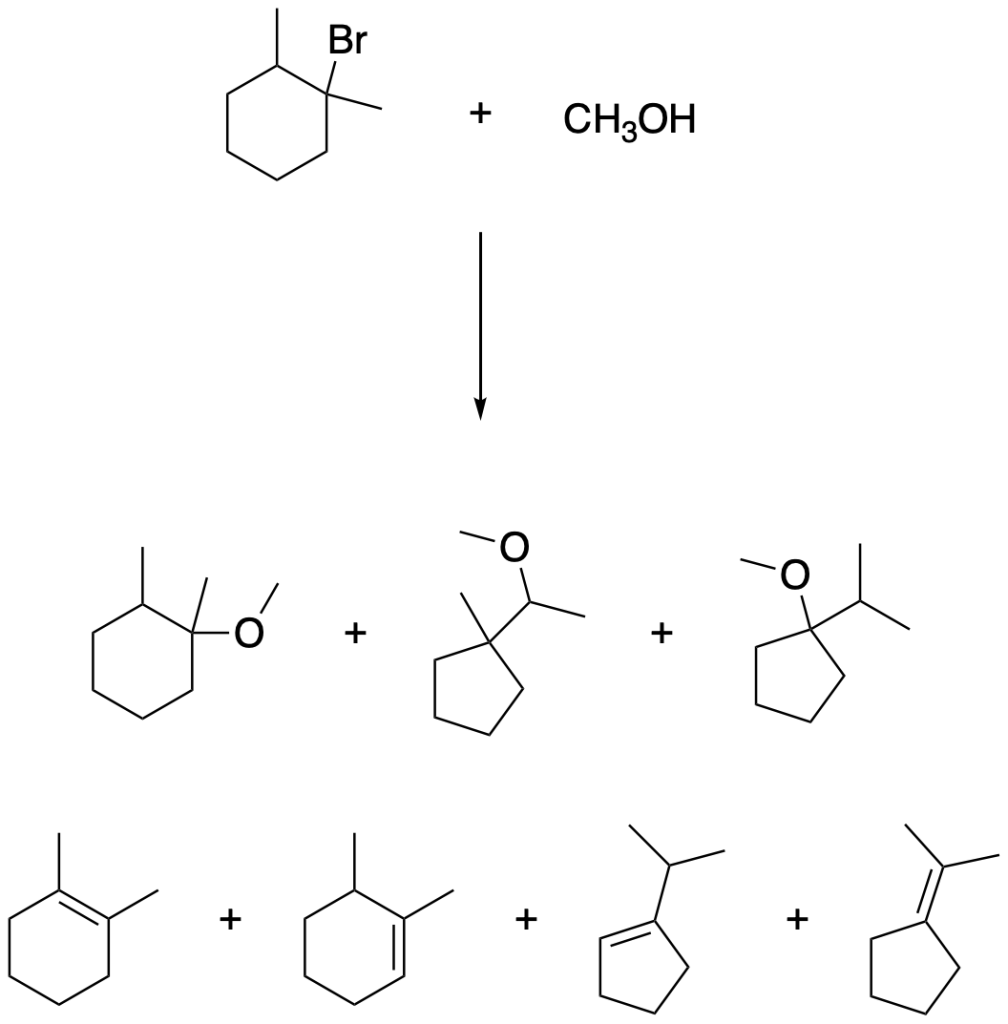
d) 3-cloro-3-metilesano + metanolo
Esercizio n. 7
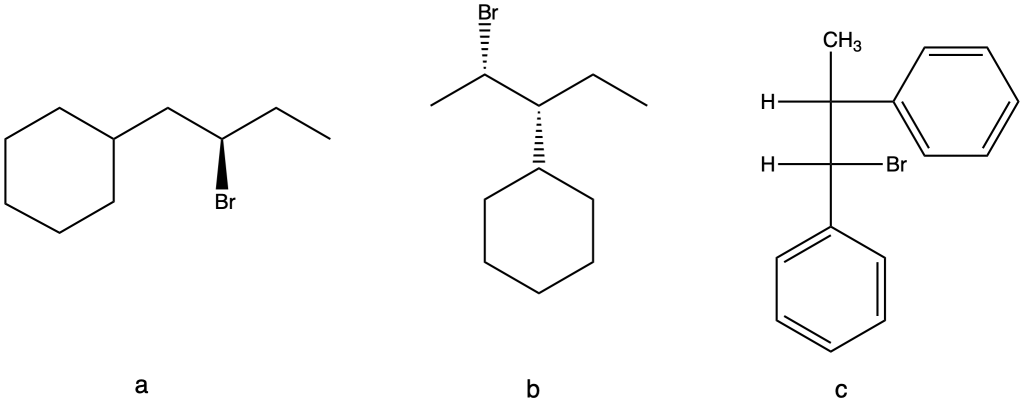
Rappresenta i prodotti delle seguenti reazioni SN2, tenendo presente la stereochimica
a) (3S,4S)-3-cloro-4-etil-eptano + CH3O-
b) (3S,4R)-3-cloro-4-etil-eptano + CH3O–
c) (3R,4R)-3-cloro-4-etil-eptano + CH3O–
d) (3S,4S)-3-cloro-4-etil-eptano + CH3O–
Esercizio n. 8
Rappresenta i prodotti delle seguenti reazioni E2, tenendo presente la stereochimica
a) 2S,3S-2-bromo-3-metilesano + OH– a caldo
b) 2S,3R-2-bromo-3-metilesano + OH– a caldo
c) 2R,3R-2-bromo-3-metilesano + OH– a caldo
d) 2R,3S-2-bromo-3-metilesano + OH– a caldo
e) 2S,3S-2-fluoro-3-metilesano + OH– a caldo



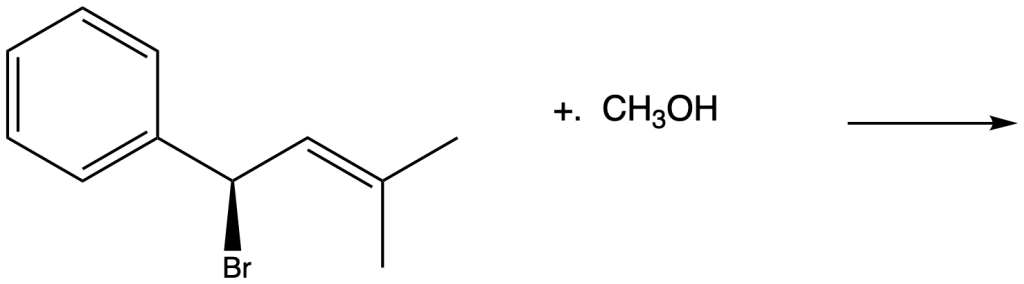





















































You must be logged in to post a comment.