REAZIONI DI SOSTITUZIONE E DI ELIMINZIONE DEGLI ALOGENURI ALCHILICI
Basicità e Nucleofilicità
La basicità è una misura della capacità di un composto a condividere la sua coppia di elettroni solitaria con un protone
La nucleofilicità è la misura della capacità di una specie con un doppietto elettronico libero di attaccare un atomo eletron-povero.
Nelle reazioni di Sostituzione Nucleofila, l’alogeno è sostituito da un altro atomo o gruppo, il nucleofilo
In una reazione di eliminazione, l’alogeno è eliminato insieme a un idrogeno dal carbonio adiacente (carbonio beta). L’idrogeno viene strappato da una base.
L’atomo o il gruppo che viene sostituito o eliminato è detto gruppo uscente
Il miglior gruppo uscente è la base più debole, pertanto, nelle reazioni di sostituzione e di eliminazione, le reattività di alogenuri alchilici che differiscono per l’atomo di alogeno sono:
RI > RBr > RCl > RF
I solventi protici hanno un idrogeno legato ad un atomo di ossigeno oppure di azoto. I solventi aprotici (DMSO, DMF) non hanno idrogeni legati a ossigeno o ad azoto.
Una base forte è un miglior nucleofilo. Tuttavia, se la reazione viene effettuata in un solvente protico, le basi più forti sono i nucleofili più scarsi a causa delle interazioni ione-dipolo tra ione e solvente.
Reazioni di sostituzione nucleofila alifatica
Una reazione SN2 è bimolecolare: sia l’alogenuro alchilico sia il nucleofilo sono coinvolti nello stato cineticamente determinante della reazione, per cui la velocità della reazione dipende dalla concentrazione di entrambi.
Una reazione SN2 ha un meccanismo a singolo stadio (concertato): il nucleofilo attacca il carbonio da retro rispetto al legame con l’alogeno. Pertanto, si ha inversione di configurazione.
Il nucleofilo reagisce con l’orbitale HOMO e l’alogenuro alchilico con quello LUMO.
A causa dell’impedimento sterico, le reattività relative degli alogenuri alchilici in una reazione SN2 sono:
metilico > primario > secondario > terziario
Una reazione SN1 è unimolecolare: solo l’alogenuro alchilico è coinvolto nello stato di transizione dello stadio lento della reazione, per cui la velocità dipende solo dalla sua concentrazione.
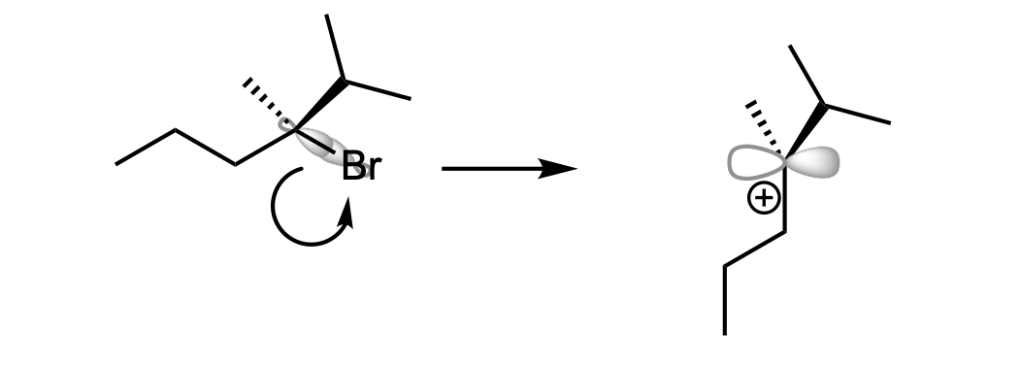
Una reazione SN1 ha un meccanismo a due stadi: nel primo stadio, l’alogeno si stacca formando un carbocarione intermedio che nel secondo stadio è attaccato da un nucleofilo. Queste reazioni sono dete anche reazioni di solvolisi, in quanto il solvente agisce da nucleofico.
La velocità di una reazione SN1 dipende dalla facilità di formazione del carbocatione.
A causa della stabilità dei carbocationi, le reattività relative degli alogenuri alchilici in una reazione SN1 sono:
terziario > secondario > primario > metilico
Le reazioni SN1 possono avvenire con racemizzazione.
Le uniche reazioni di sostituzione che gli alogenuri alchilici metilici, primari e secondari subiscono sono reazioni SN2
Le uniche reazioni di sostituzione che gli alogenuri alchilici terziari subiscono sono reazioni SN1
Reazioni di Eliminazione
La rimozione di un protone e uno di alogeno è chiamata deidroalogenazione. Il prodotto di una reazione di eliminazione è un alchene.
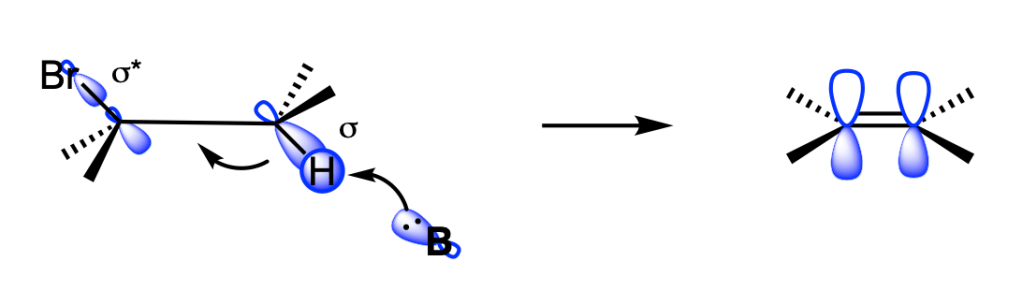
L’E2 è una reazione bimolecolare, concertata, ad uno stadio, in cui il protone e lo ione alogenuro vengono rimossi contemporaneamente.
Una reazione E2 è regioselettiva: il prodotto principale è l’alchene più stabile, a meno che i reagenti siano stericamente impediti o sia presente un cattivo gruppo uscente.
L’alchene più stabile è generalmente l’alchene più sostituito.
La maggiore sostituzione di un gruppo alchilico aumenta la stabilità del relativo carbocatione e diminuisce la stabilità del carbanione
Stabilità Carbocationi: 3° > 2° > 1° > metilico
Stabilità Carbanioni: metilico > 1° > 2° > 3°
La reazione E2 avviene solo se l’idrogeno e il gruppo uscente si trovano in una conformazione antiperiplanare: l’eliminazione sin è possibile ma quella anti è favorita.
La reazione E2 è stereoselettiva
Se il carbonio beta ha due atomi di idrogeno, allora si formano entrambi gli stereoisomeri E e Z; quello E si forma in maggiore quantità perché è più stabile.
Se il carbonio beta è legato a un solo idrogeno, allora in una reazione E2 si forma un solo alchene;
La struttura dipende dalla stereochimica dell’alogenuro alchilico (reazione stereospecifica)
Una reazione E1, unimolecolare, è una reazione in due stadi in cui l’alogenuro alchilico si dissocia formando un carbocatione intermedio. Poi, una base rimuove un protone da un carbonio adiacente al carbonio carico positivamente.
La reazione E1 è regioselettiva: il prodotto è l’alchene più stabile.
Le uniche reazioni che gli alogenuri alchilici primari e secondari subiscono sono reazioni E2.
Gli alogenuri alchilici terziari subiscono sia reazioni E2 sia E1; la reazione E2 è favorita da una base forte; la reazione E1 è favorita da una base debole.
Una reazione E1 è stereoselettiva. Si formano entrambi gli stereoisomeri E e Z indipendentemente dal numero di atomi di idrogeno legati al carbonio beta.
In una reazione E2 i due gruppi eliminati da un anello a sei termini devono essere entrambi in posizione assiale (non è così in una reazione E1.
L’eliminazione è più veloce quando H e X sono diassiali nel conformero più stabile.
Gli alogenuri alchilici primari subiscono reazioni SN2/E2: la reazione di sostituzione è favorita a meno che il nucleofilo/base sia impedito stericamente.
Gli alogenuri alchilici secondari subiscono reazioni SN2/E2: si formano entrambi oi prodotti di sostituzione ed eliminazione; basi fori ingombrate e alte temperature favoriscono il prodotto di eliminazione
Gli alogenuri terziari subiscono reazioni E2 con basi forti e reazioni SN1/E1 con basi deboli.























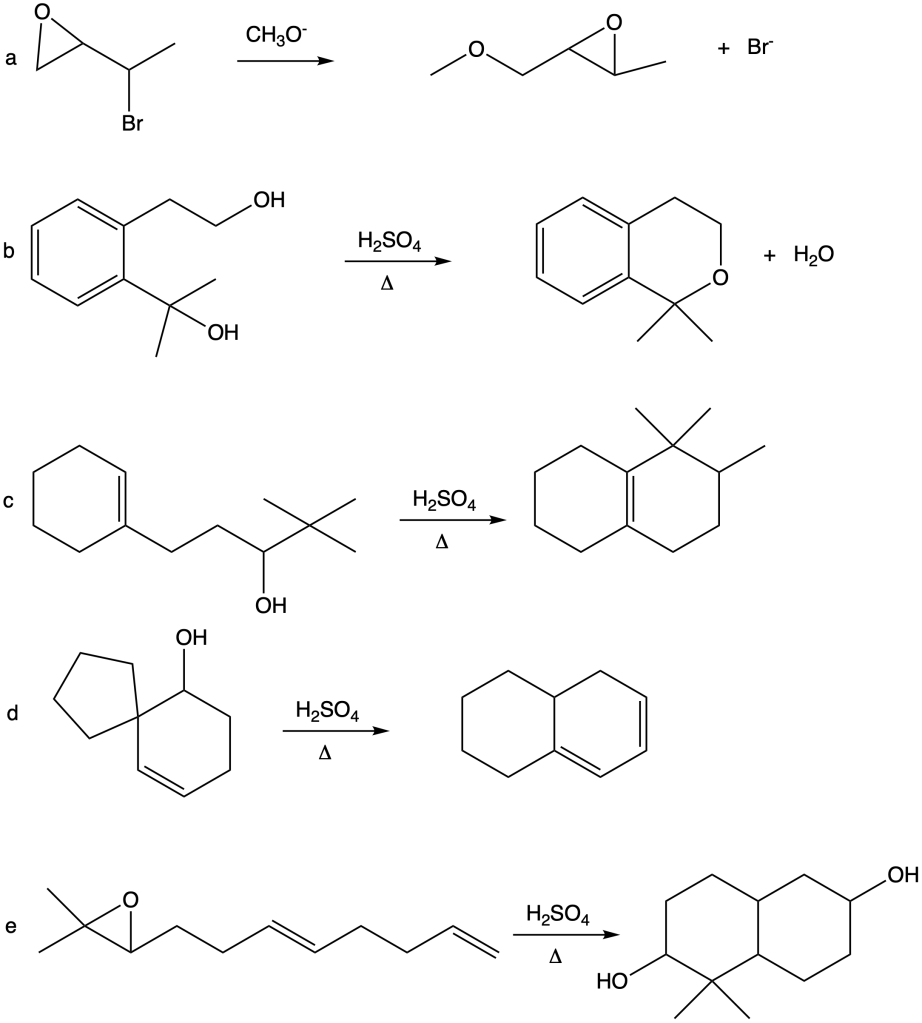

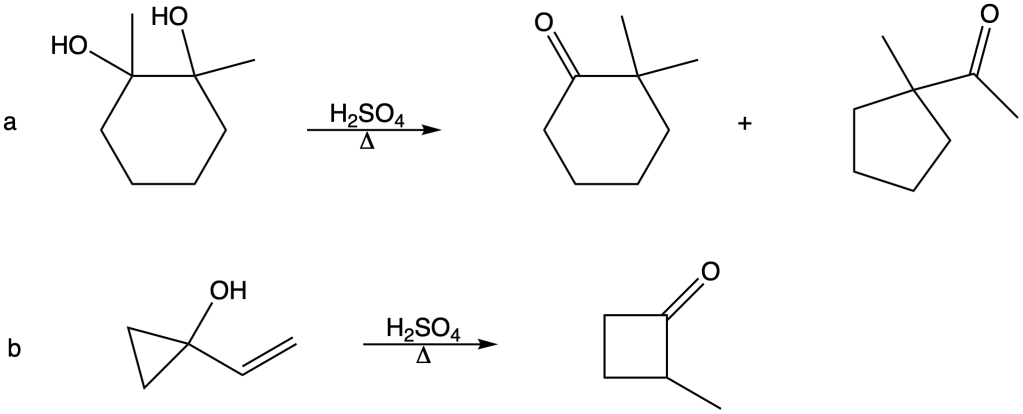






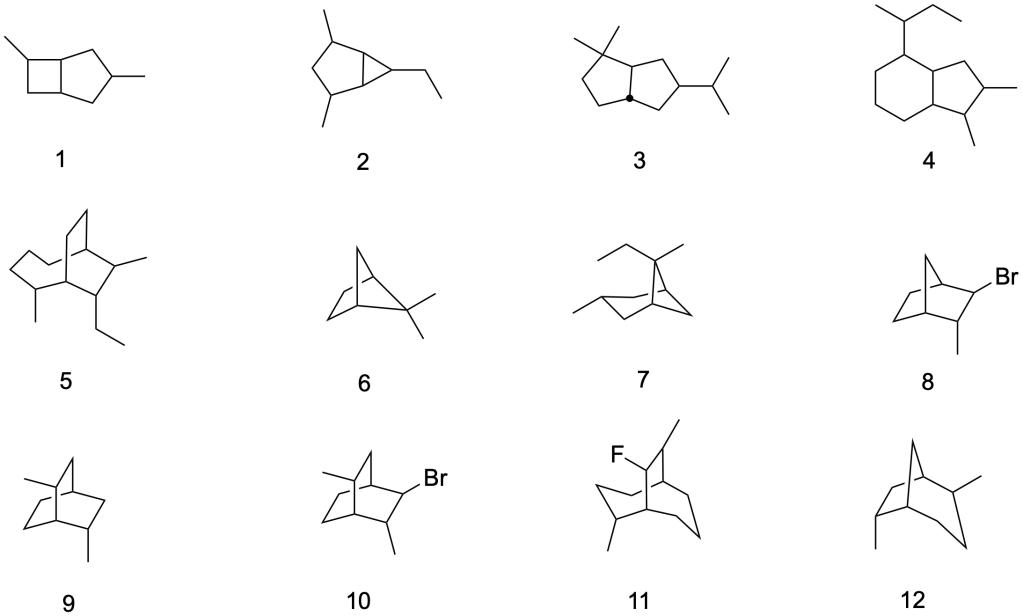










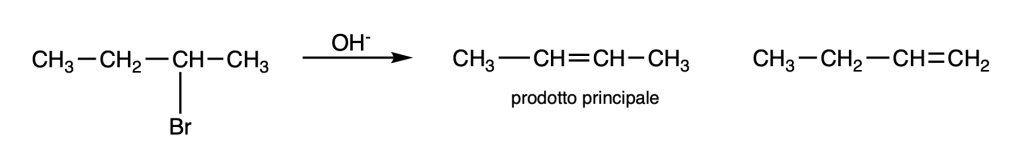






You must be logged in to post a comment.