Dieni coniugati: ancora reazioni

Esercizio n. 1
Prevedete la struttura del prodotto principale che si ottiene dall’addizione 1,2 di una mole di Br2 all’isoprene (2-metil-1,3-butadiene). Prevedete, inoltre, la struttura del principale prodotto di addizione 1,4 nelle medesime condizioni.
Esercizio n. 2
Scrivete le formule di struttura dei due isomeri strutturali a formula molecolare C5H6Br2 che si ottengono dall’addizione di 1 mole di D-Br al ciclopentadiene.
Esercizio n. 3
Quali sono i prodotti principali che si ottengono dall’addizione di una mole di Br2 ai seguenti dieni in condizioni di controllo cinetico o termodinamico?

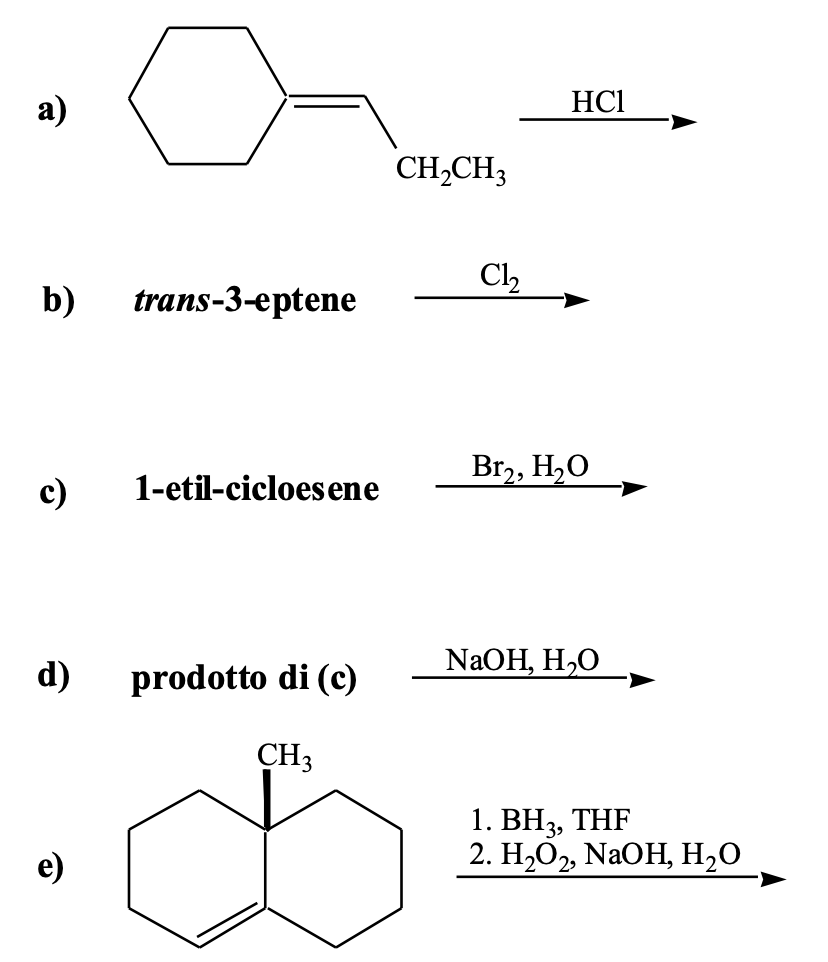
Esercizio n. 4
Dite quale dei seguenti composti reagisce con anidride maleica (=cis-butendioica) e quale no, spiegando e scrivendo l’equazione chimica delle reazioni che avvengono: a) 1,4-pentadiene; b) butadiene; c) ciclopentadiene; d) 1,4-cicloesadiene; e) 1,3-cicloesadiene; f) 1,3-esadiene; g) 1,4- esadiene; h) 1,5-esadiene.
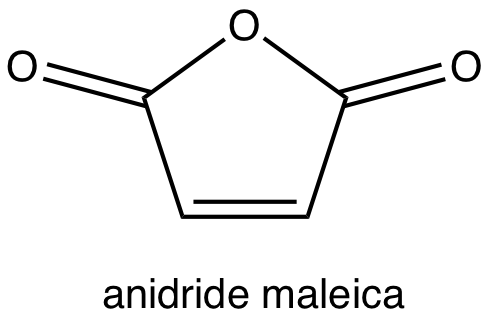
Esercizio n. 5
Anche gli alchini possono essere usati come dienofili nelle reazioni di Diels-Alder. Scrivere le strutture dei prodotti che si ottengono dalla reazione del 1-metossi-1,3-butadiene con: a) esafluoro-2-butino; b) propinoato di metile; c) butindioato dimetilico.

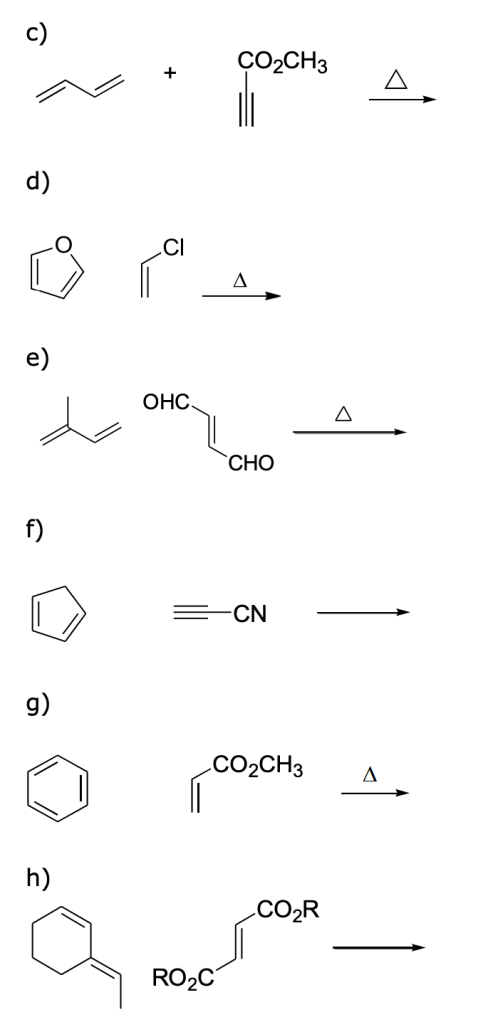
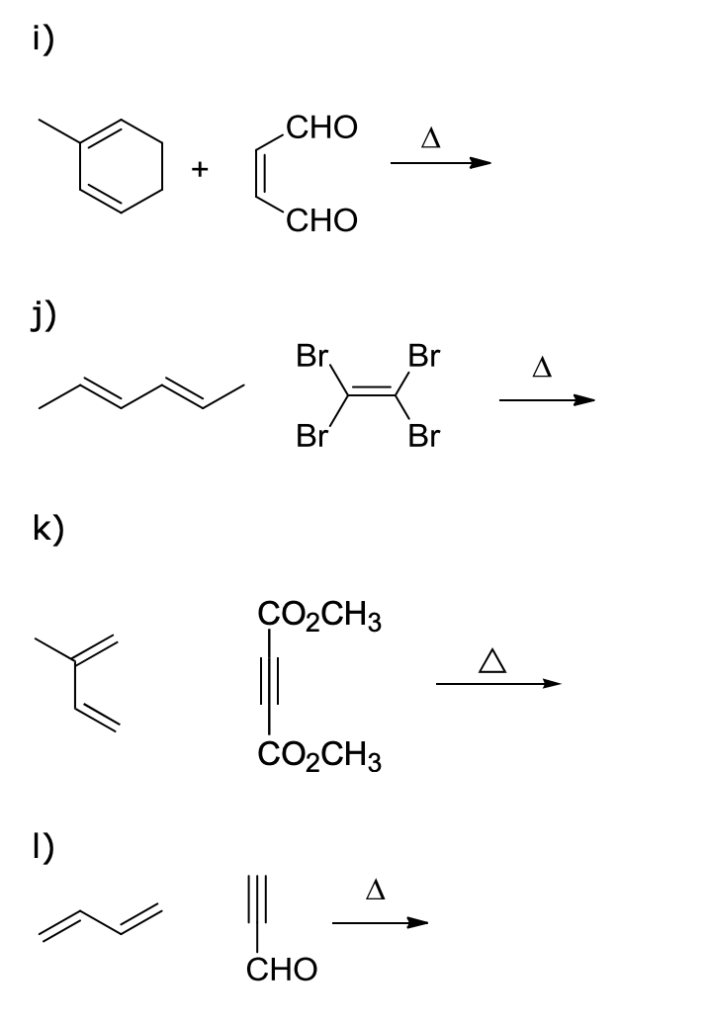
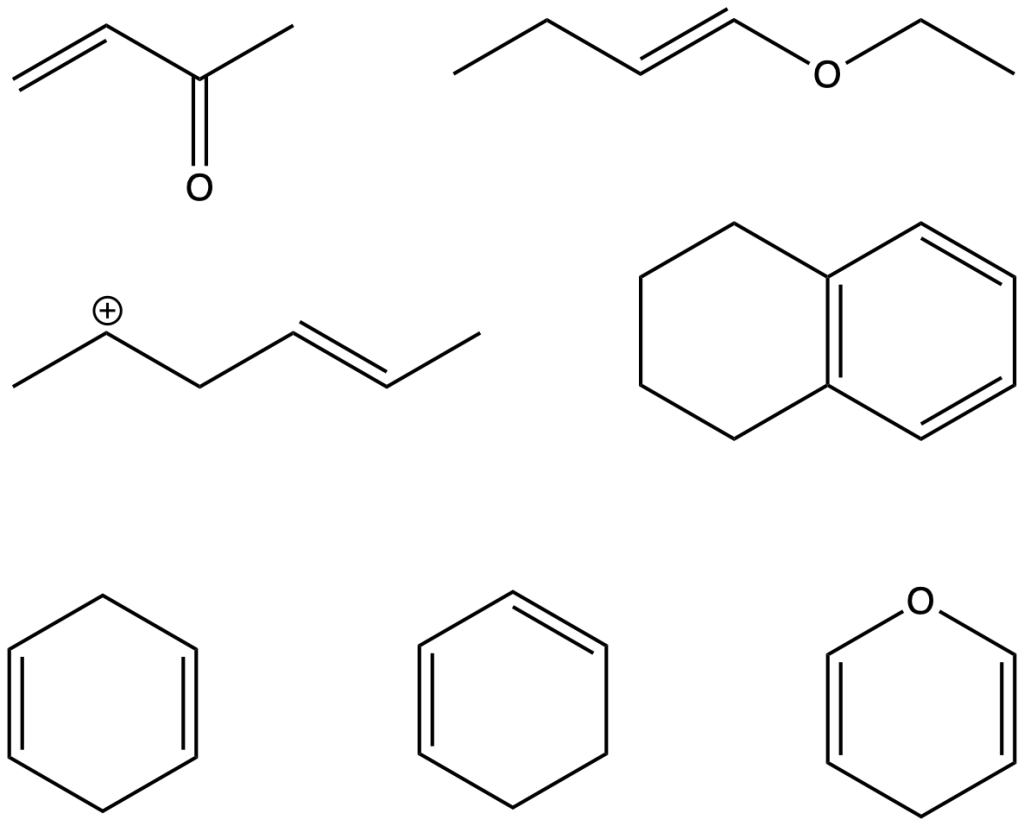
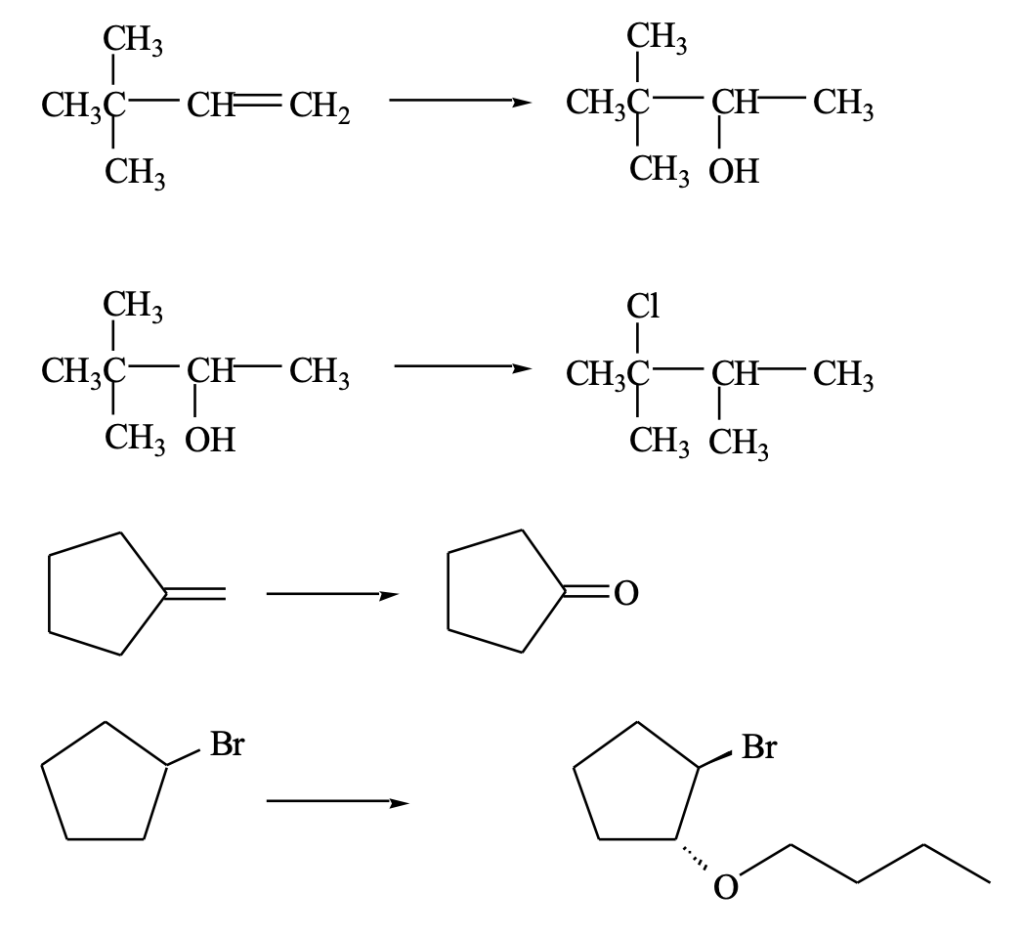
Esercizio n. 6
Prevedete i prodotti delle seguenti reazioni di Diels-Alder

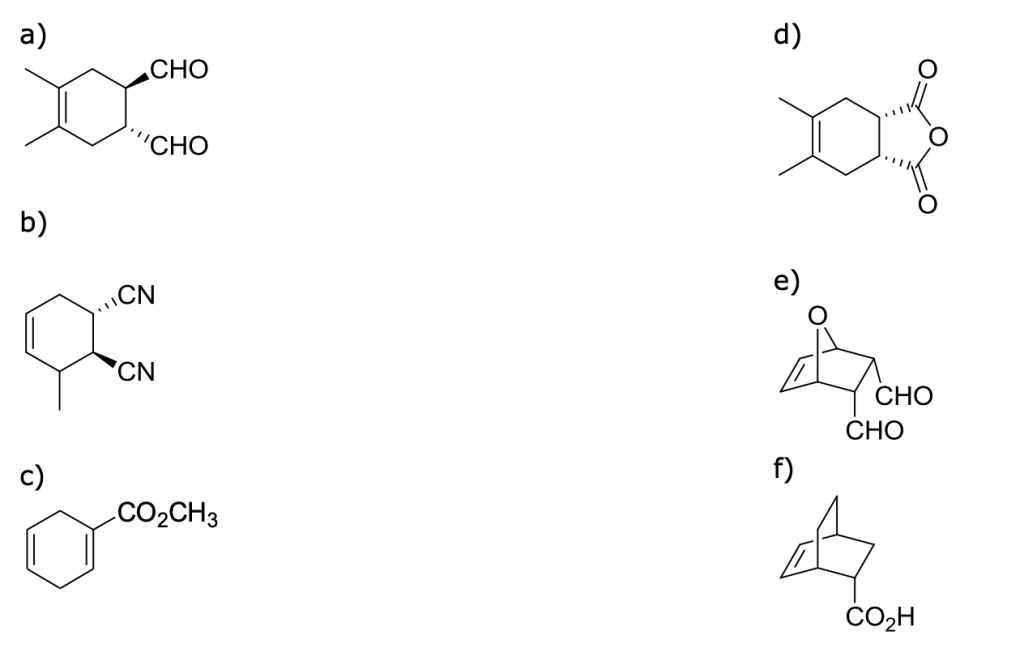
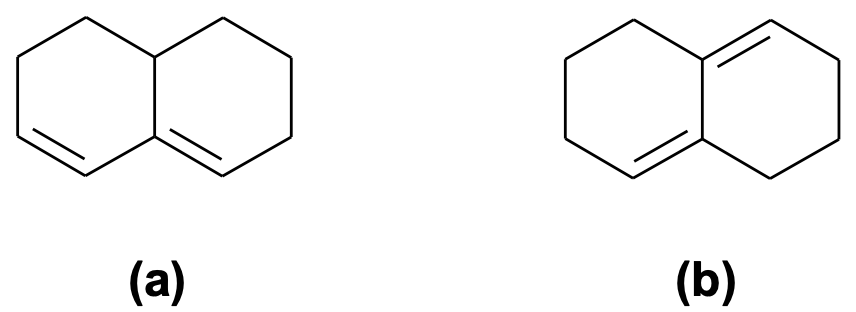
Esercizio n. 7
A partire da quali dieni e dienofili si ottengono i seguenti addotti di Diels-Alder ?
























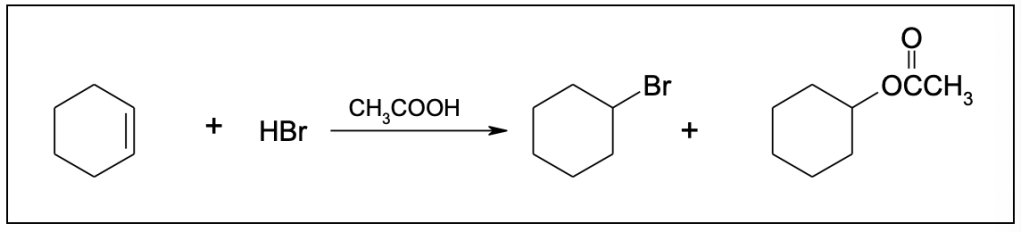
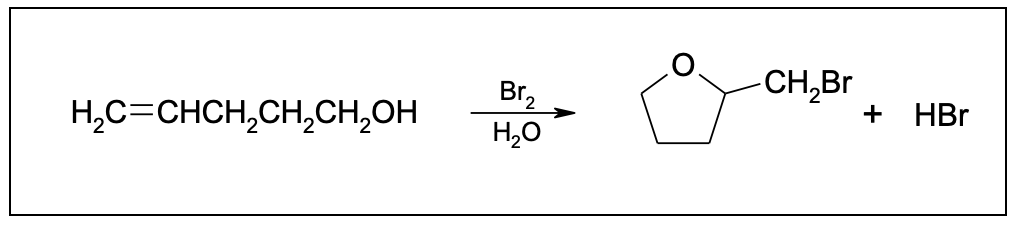


You must be logged in to post a comment.