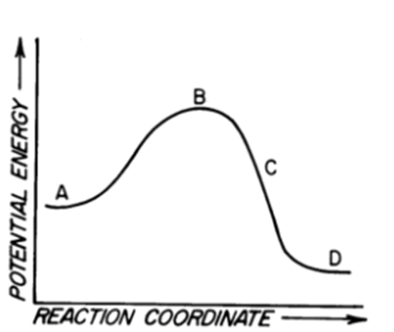
Esercizi su reazioni degli alcheni

NB: NON è POSSIBILE AFFRONTARE QUESTI ESERCIZI SENZA AVER STUDIATO TUTTI GLI ARGOMENTI TRATTATI A LEZIONE
PRIMA DI SVOLGERLI, Prendere visione del materiale didattico pubblicato
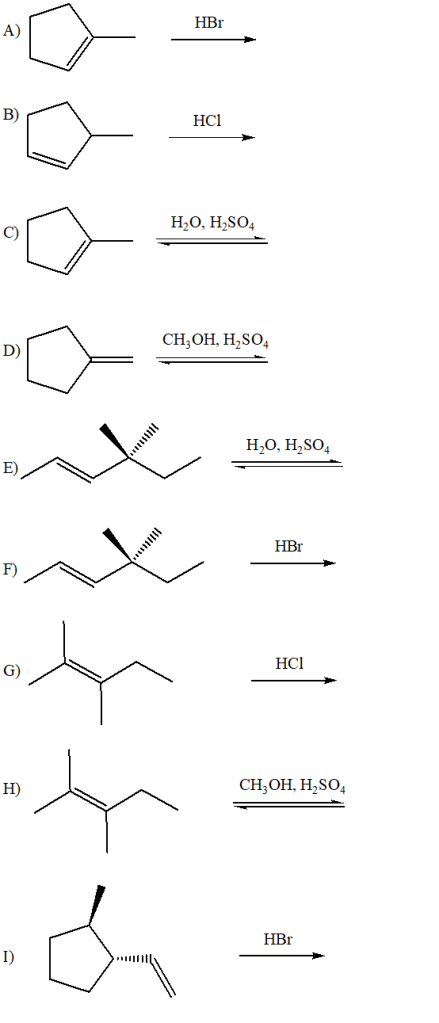
1) Per ciascuna delle seguenti reazioni mostrare il meccanismo che porta alla formazione del/dei prodotto/i principale/i. Quando necessario, tener conto della stereochimica.

2) Prevedere il (i) prodotto (i) di reazione del 3-metil-3-esene con ciascuno dei seguenti reagenti:
a) bromo
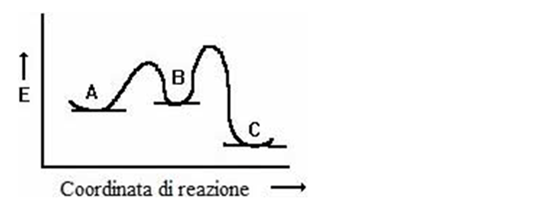
b) acetato mercurico [Hg(OAc)2], acqua; seguito da trattamento con NaBH4
c) bromo in acqua
d) cloro
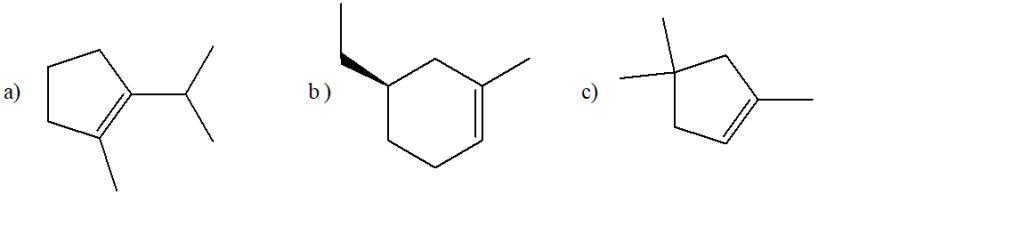
e) acido solforico diluito
3) La reazione del 2-metil-2-pentene con ciascuno dei seguenti reagenti è regioselettiva. Disegnare la formula di struttura del prodotto di ciascuna reazione e spiegare la regioselettività osservata:
a) HCl
b) acqua in presenza di acido solforico
c) bromo in acqua
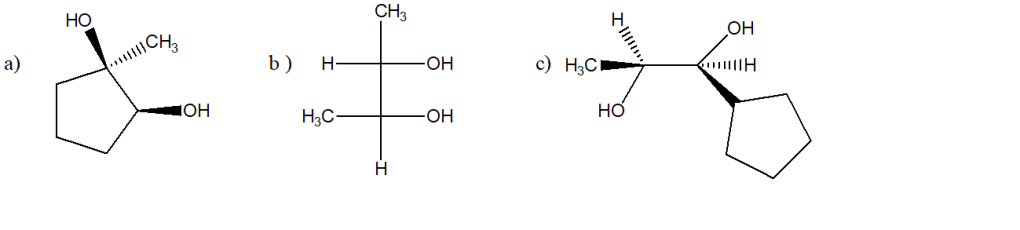
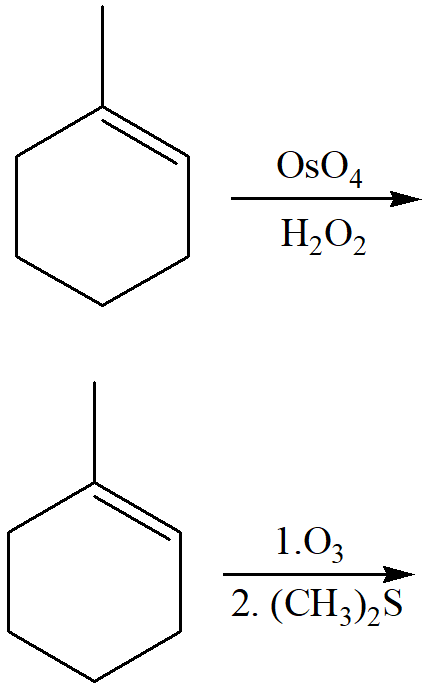
4) Spiegare la regioselettività e la stereoselettività osservate per la reazione del 1-metilcicopent-1-ene in una reazione di:
a) idroborazione/ossidazione
b) ossimercuriazione/riduzione
c) sintesi di una bromidrina
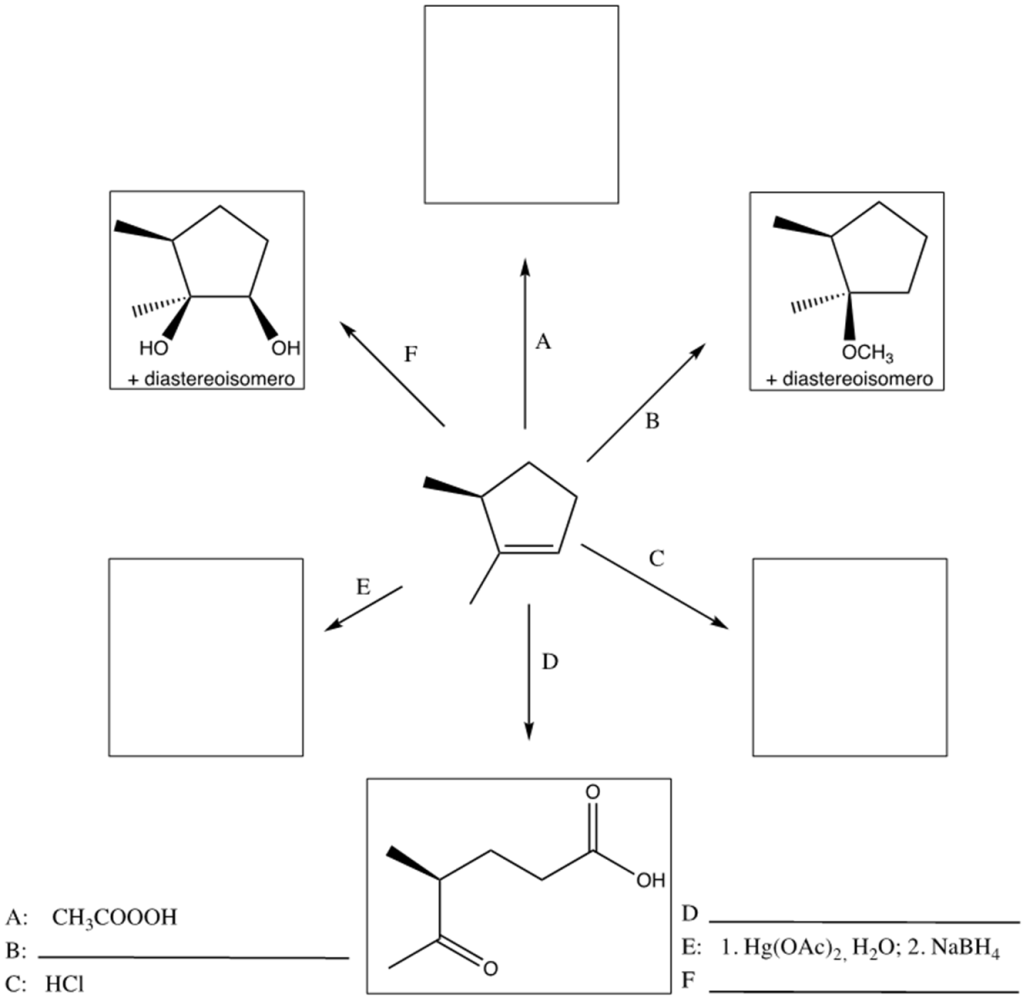
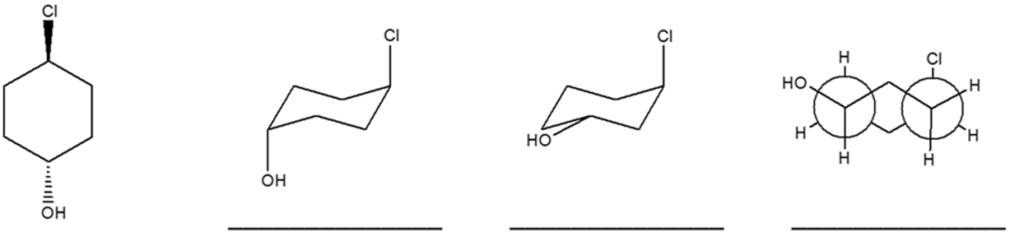
5) Completare il seguente schema inserendo le condizioni di reazioni o i prodotti mancanti. Evidenziare la stereochimica.
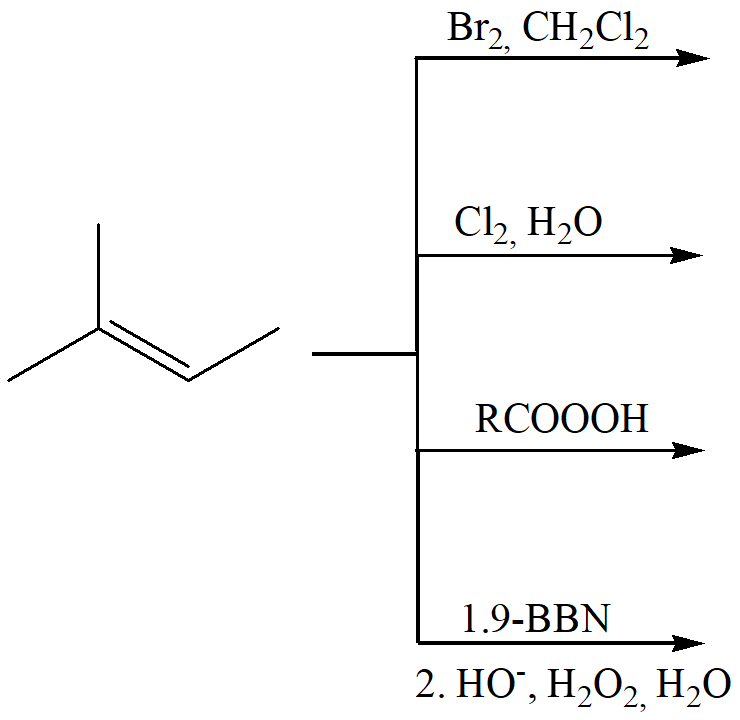
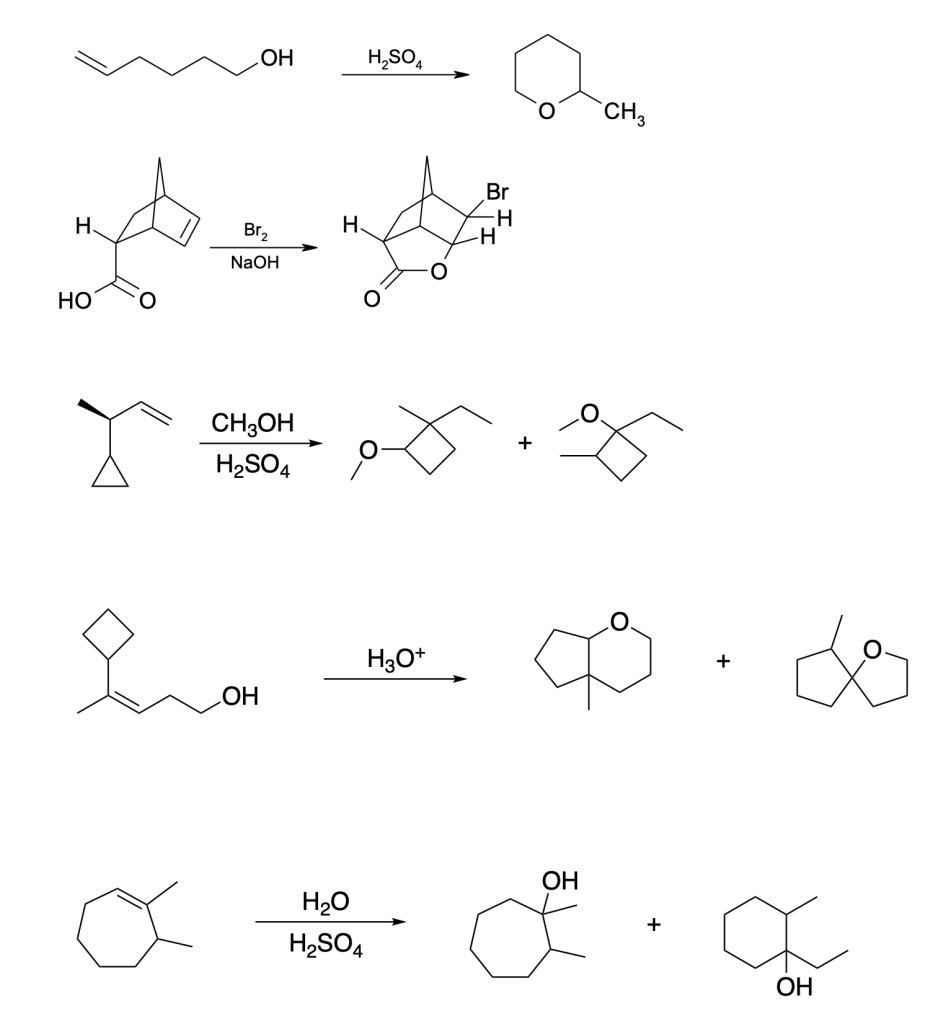
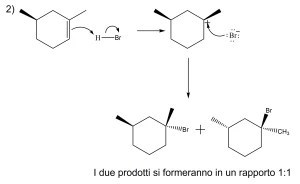
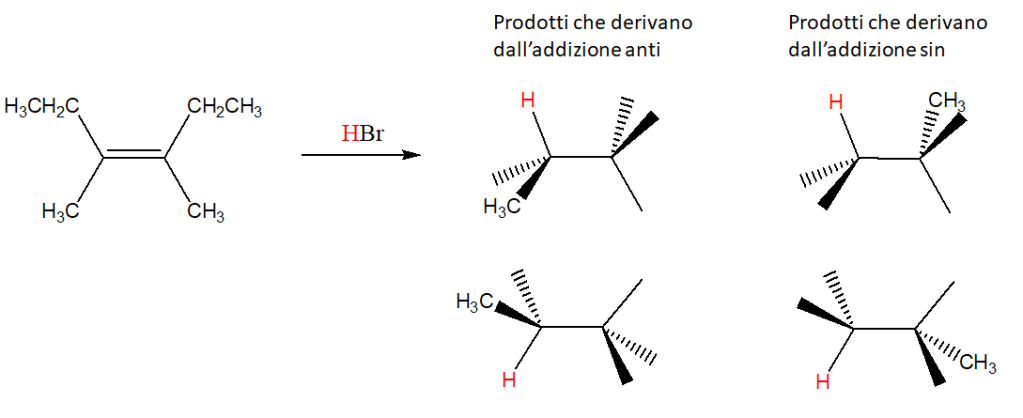
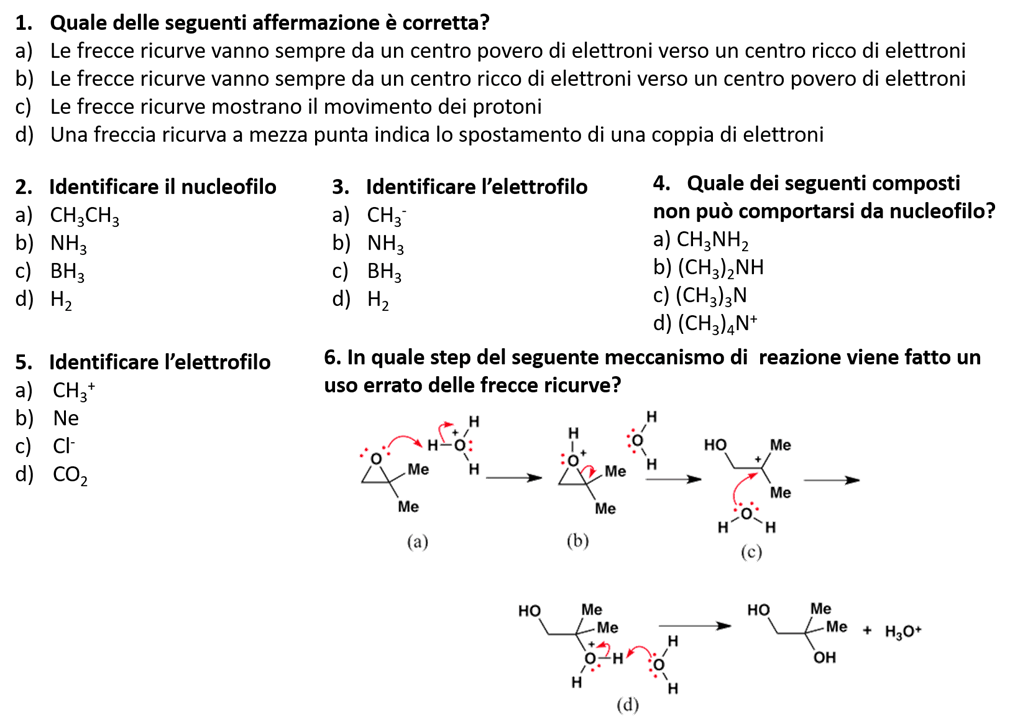
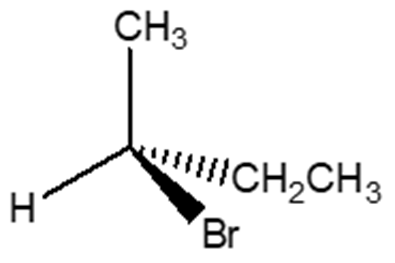
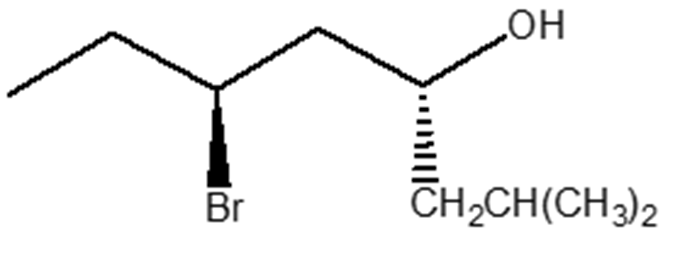
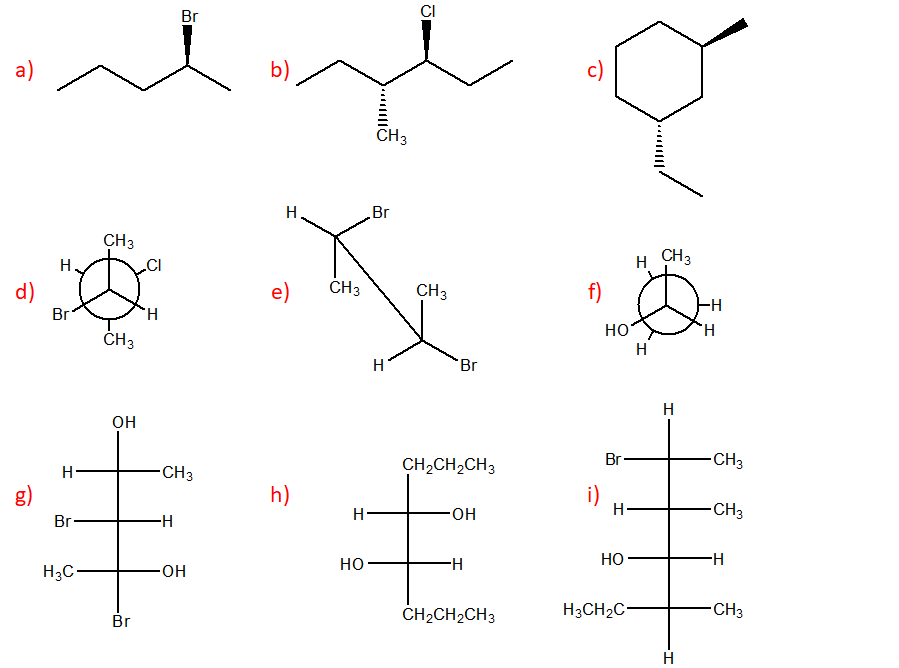
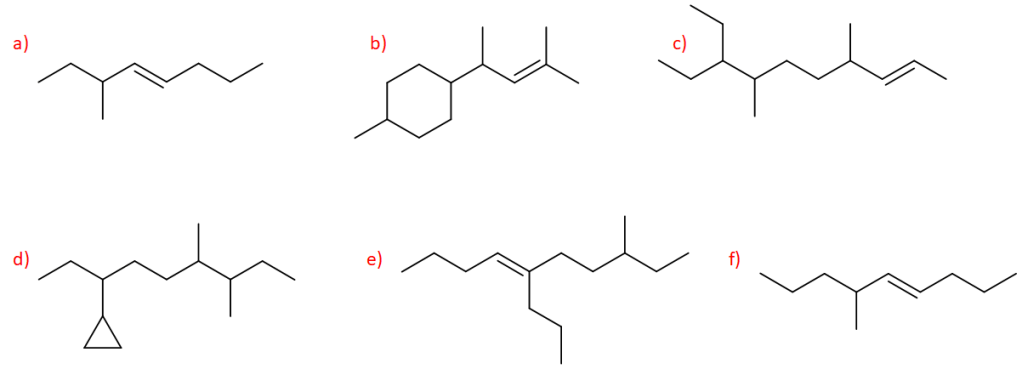
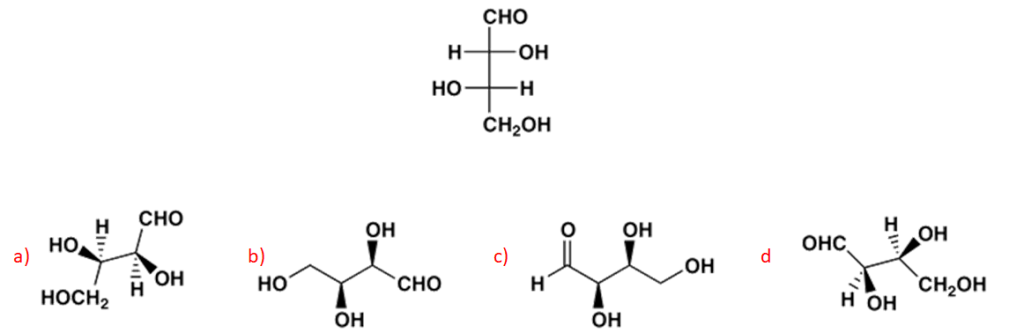
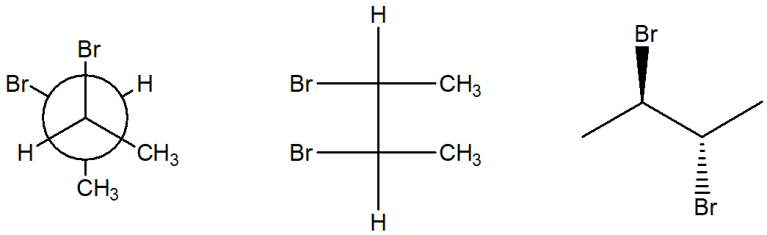
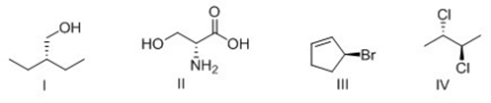
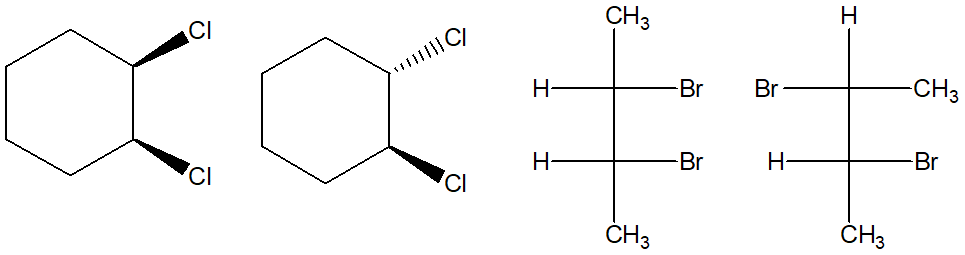
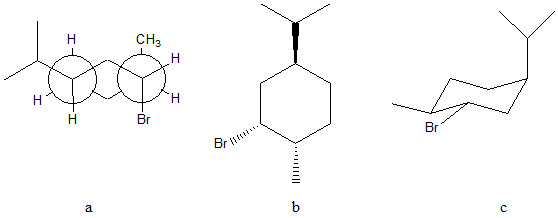
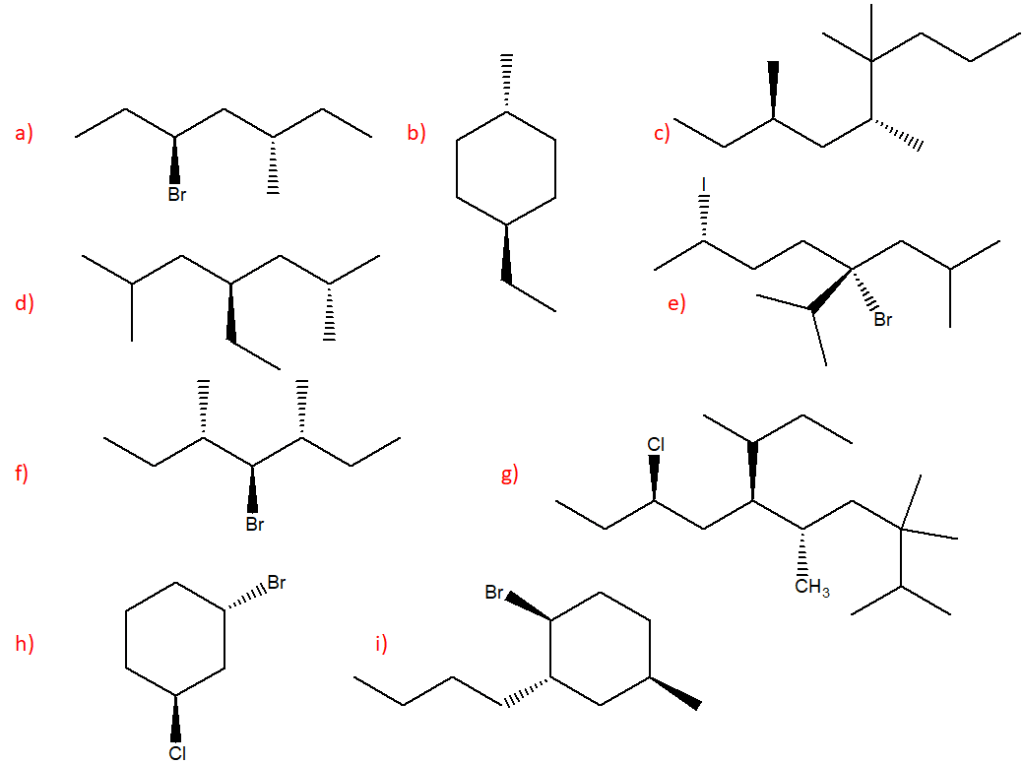
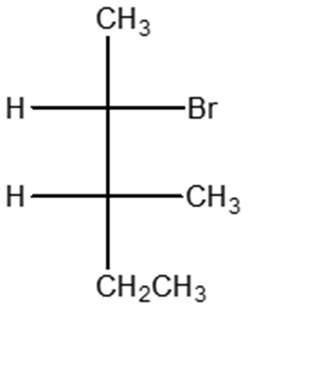
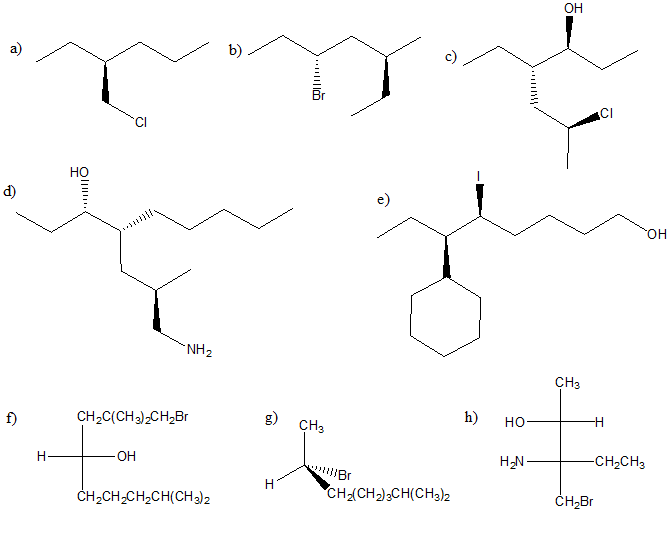
6) Scrivere i prodotti principali delle seguenti reazioni. Specificare la stereochimica quando opportuno

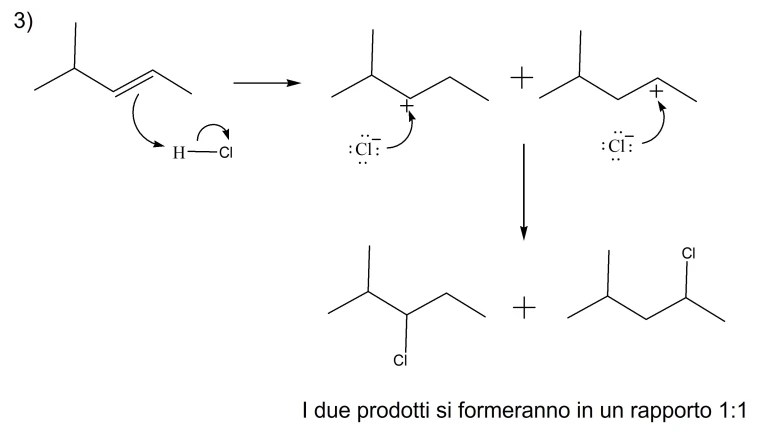
7) Mostrare il meccanismo di reazione e scrivere i prodotti principali delle seguenti reazioni.

8) Indicare le condizioni di reazione per ottenere le seguenti trasformazioni

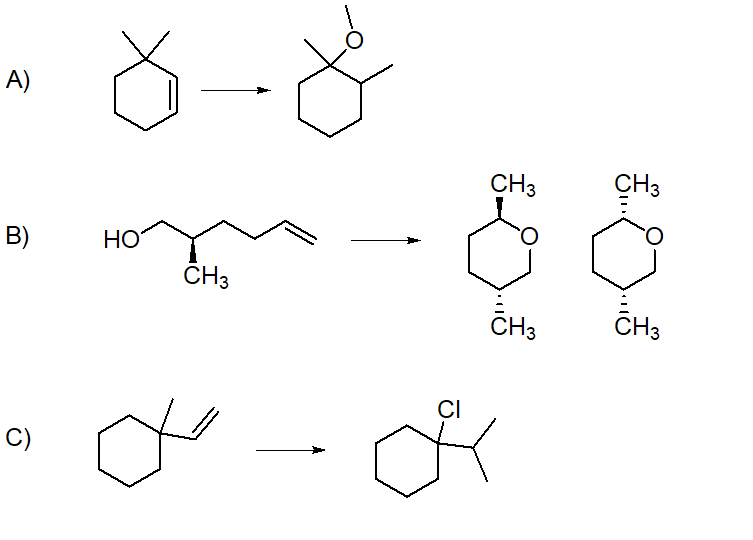
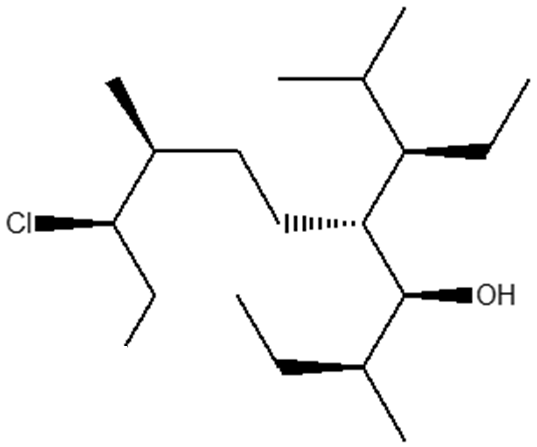
9) Partendo dall’opportuno alchene, illustrare il meccanismo di reazione della sintesi dei seguenti composti. Indicare eventuali altri prodotti fornendo per tutti il nome IUPAC completo di stereochimica.
A)
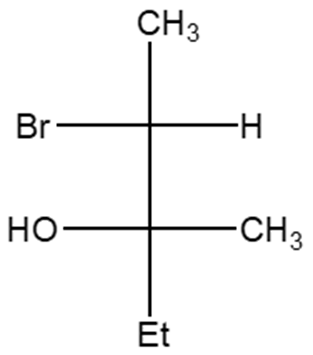
B)

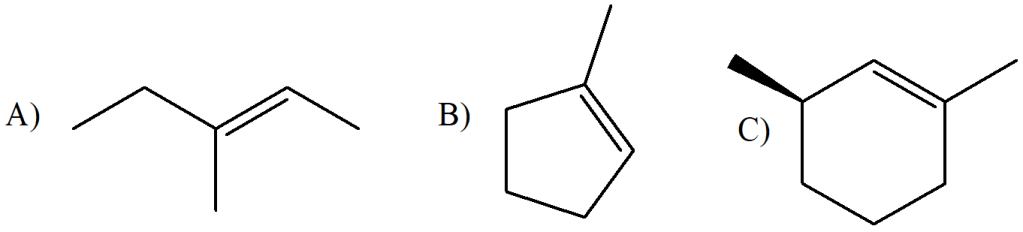
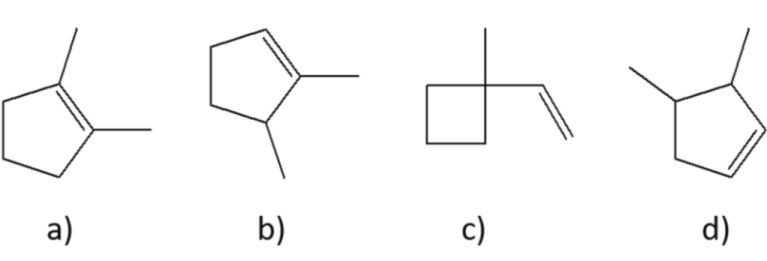
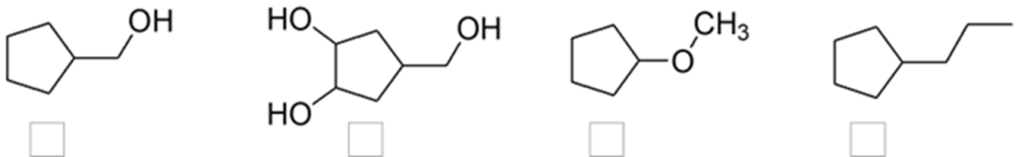
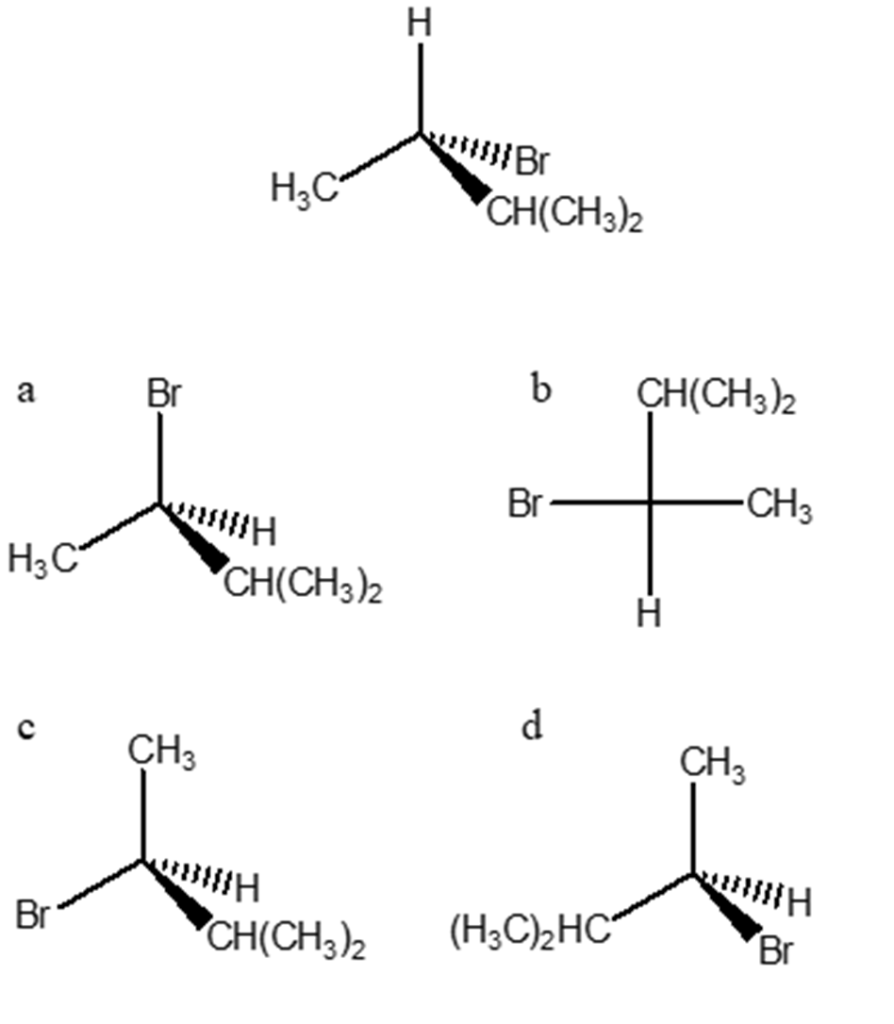
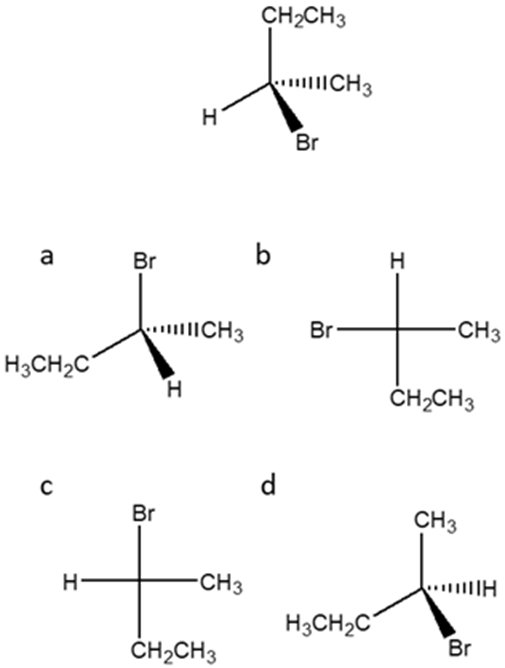
10) Quale, tra i seguenti prodotti A-D, si può ottenere dalla reazione dell’ (E)-3-metil-2-pentene con bromo in acqua?

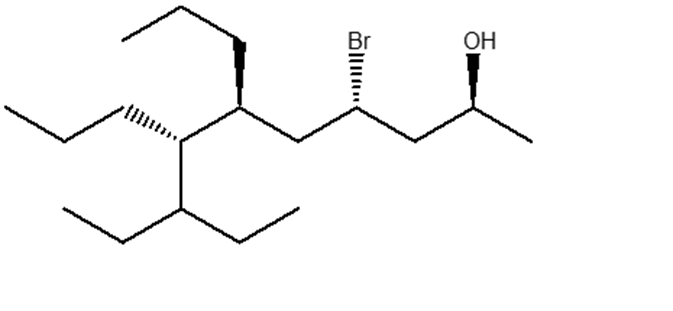
11) Partendo dall’opportuno alchene, illustrare il meccanismo di reazione della sintesi dei seguenti composti. Indicare eventuali altri prodotti fornendo per tutti il nome IUPAC completo di stereochimica.

12) Scrivere i prodotti ottenuti a seguito dell’idrogenazione catalitica degli alcheni individuati come composti di partenza per la sintesi dei composti dell’esercizio 11.
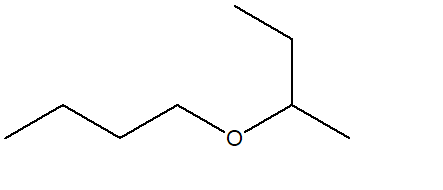
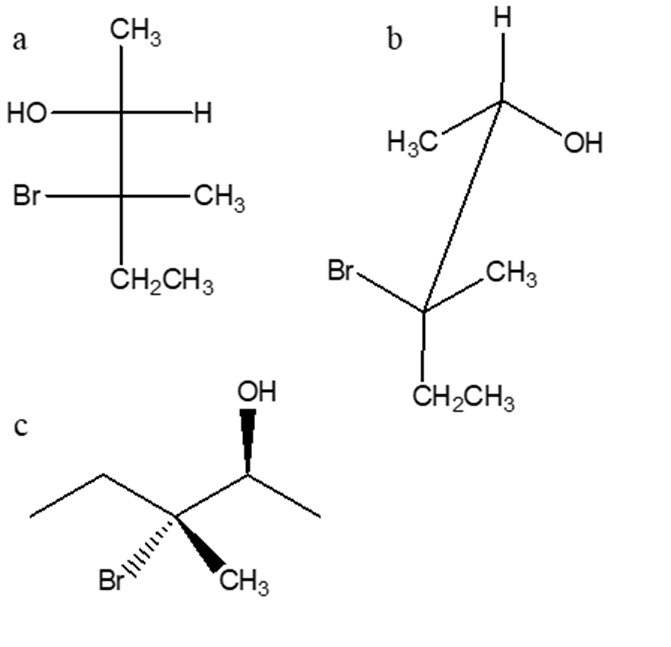
13) Quale alchene sarà il seguente composto come prodotto di una reazione di ozonolisi seguita da trattamento con dimetilsolfuro?
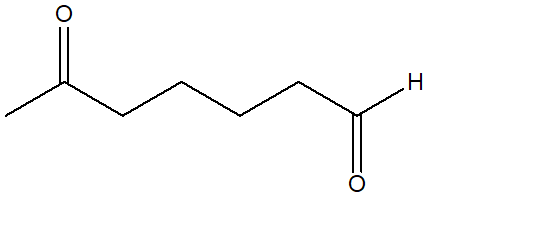
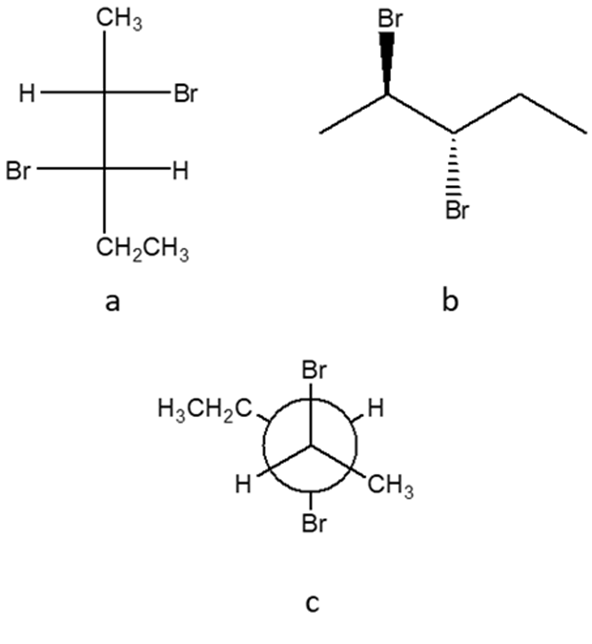
14) Indicare le condizioni ottimali per ottenere ciascuno dei seguenti composti a partire dal (R)-3-metilciclopentene. Se quello ottenuto non è l’unico prodotto di reazione, indicare gli ulteriori altri prodotti formati, dire in che relazione sono col prodotto riportato e indicare se si formano o meno in quantità equimolari rispetto a quest’ultimo. NB: se non si formano ulteriori prodotti, scrivere “nessuno” nella casella dedicata.

15) Indicare le condizioni ottimali per ottenere ciascuno dei seguenti composti a partire dal 3-metil-1-butene. Se quello ottenuto non è l’unico prodotto di reazione, indicare gli ulteriori altri prodotti formati, dire in che relazione sono col prodotto riportato e indicare se si formano o meno in quantità equimolari rispetto a quest’ultimo. NB: se non si formano ulteriori prodotti, scrivere “nessuno” nella casella dedicata

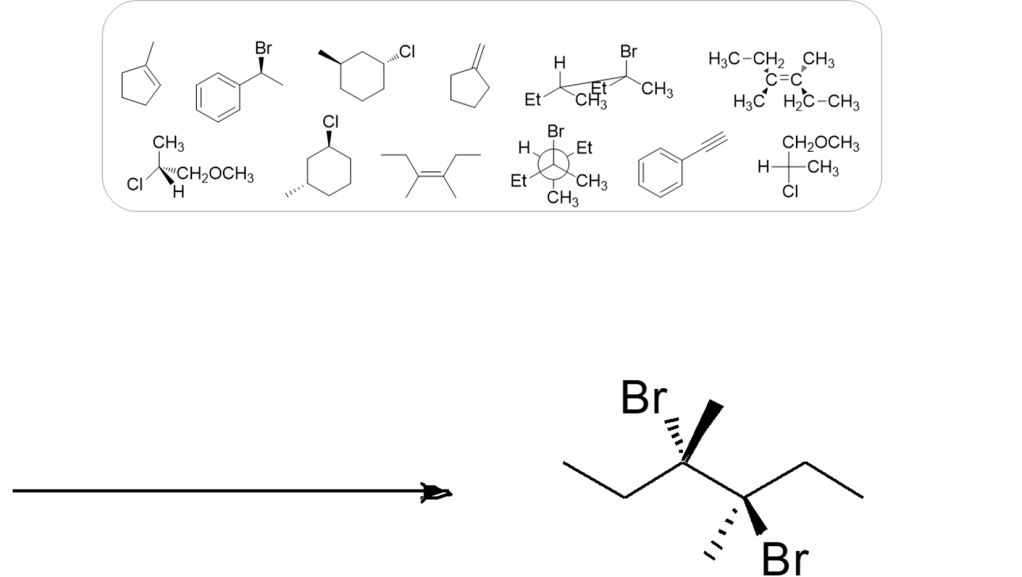
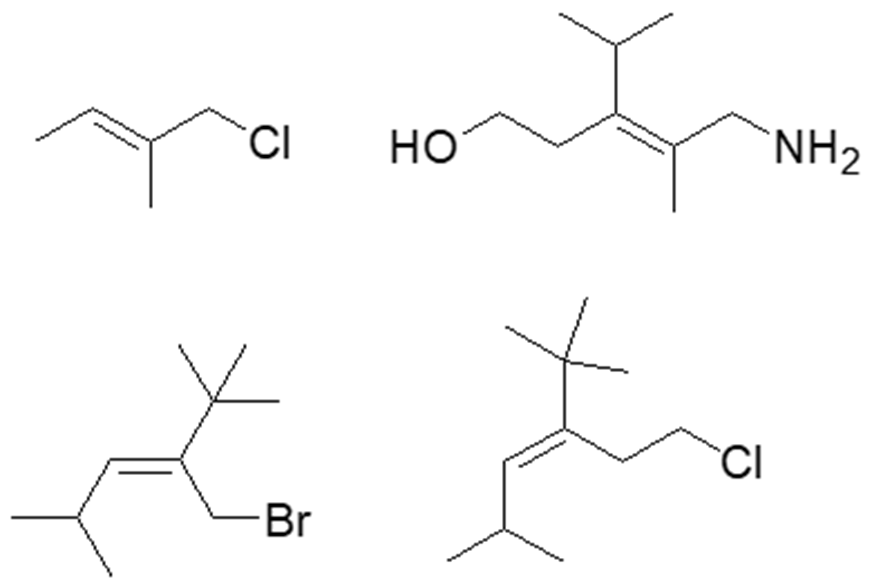
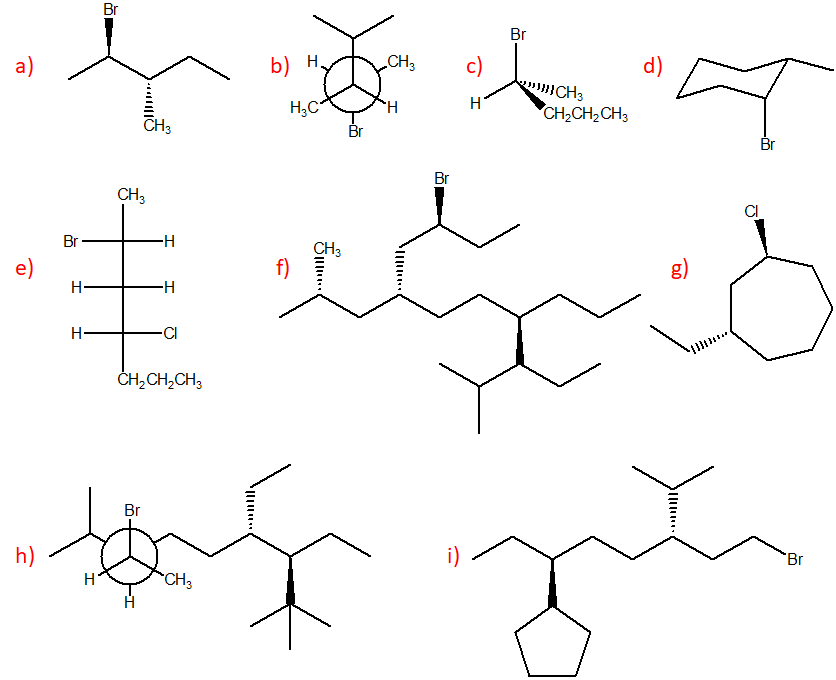
16) A partire da uno dei composti riportati nel riquadro e utilizzando qualsiasi altro reagente necessario, suggerire la sintesi di ciascuno dei seguenti prodotti, indicando sulle frecce le condizioni di reazione.
Gli esercizi che seguono richiedono uno sforzo di logica e ragionamento maggiore rispetto agli esercizi 1-16:
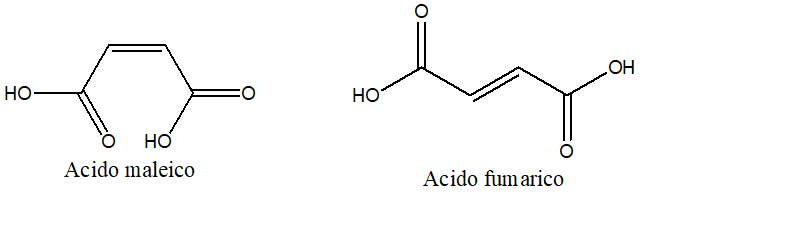
17) Quando l’acido maleico e l’acido fumarico reagiscono con Br2, si forma acido 2,3-dibromosuccinico e il prodotto di reazione non ruota il piano della luce polarizzata. Nel caso dei prodotti ottenuti dall’acido maleico, è però poi possibile risolvere la miscela racemica, ottenendo i due enantiomeri, cosa che non è possibile fare nel caso della reazione a carico dell’acido fumarico. Cosa ci dice questo circa il meccanismo di addizione del bromo?
18) Scrivere il prodotto della seguente reazione

19) Proponi un meccanismo per ciascuna delle seguenti reazioni:

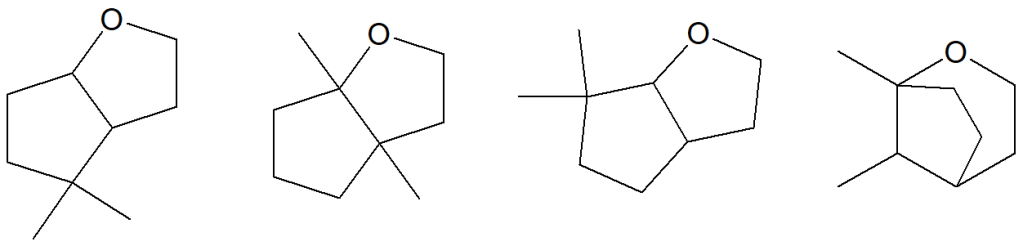
20) Proponi le condizioni di reazione e un meccanismo che spieghi la formazione di ciascuno dei seguenti composti a partire dal 3-(2,2-dimetilciclobutil)prop-2-en-1-olo


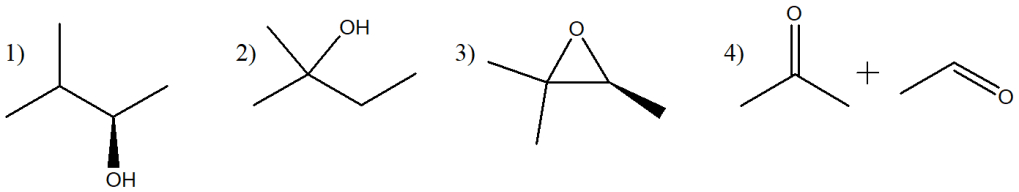














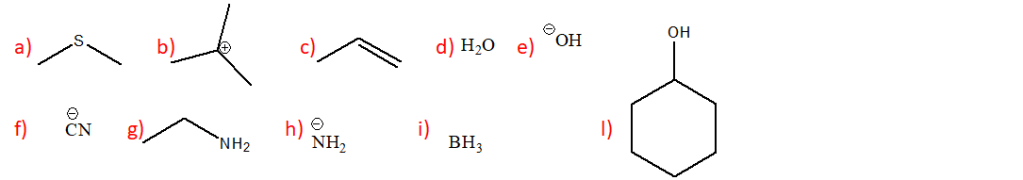
































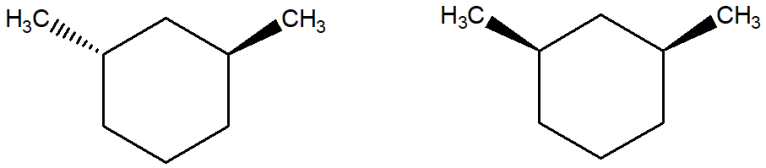




















You must be logged in to post a comment.