Esercitiamoci per la prova scritta II

Suggerimento: per poter usare questi set di esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 2 ore per ciascun set.
PRIMO SET
1. Attribuire il nome IUPAC, comprensivo di stereochimica, al seguente composto:
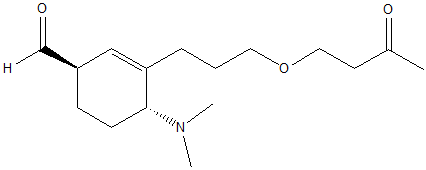
2) Scrivere l'(R)-3-bromo-5-ossoesanale
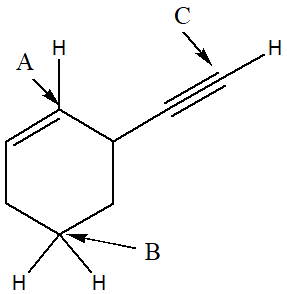
3) Il composto mostrato in figura è il paclitaxel. Indicare l’ibridazione dei carboni indicati dalle lettere A e B e dai numeri 1,2,3. Ai carboni indicati da numeri, attribuire anche la configurazione assoluta.

4) Disegnare la struttura di Lewis di ciascuna delle seguenti molecole: a) CH3CHO, b) CH3OCH3, c) CH3COO–, d) H2SO4. Scrivere anche eventuali strutture di risonanza e indicare le cariche formali quando esse sono diverse da 0.
5) Quale tra il bromoetano e il bromoetene ha il legame C-Br più corto. Spiegare perchè.
6) Come sintetizzeresti il seguente composto mediante condensazione di Claisen?

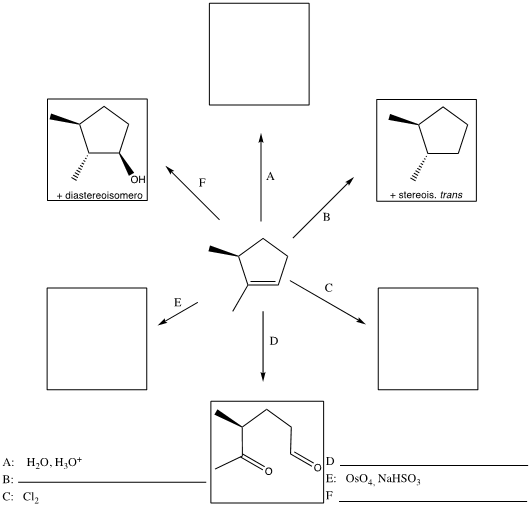
7) Completare il seguente schema sintetico

8) L’arginina è un amminoacido con un gruppo ionizzabile in catena laterale. I valori di pKa per questo amminoacido sono i seguenti: pKa (COOH)=2,17; pKa (NH2) =9.04, pKa (gruppo in catena laterale)= 12,48. Quale sarà il pI per questo amminoacido?
SECONDO SET
1. Attribuire il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:
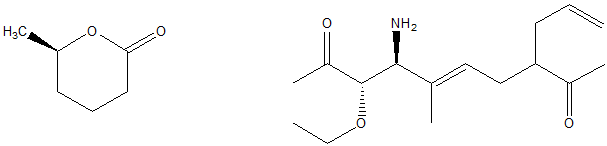
2. Dire quale/i tra i seguenti composti ha uno stereoisomero achirale: a) 1-etil-2-metilciclopentano, b) 1,2-dimetilciclopentano, c) 2,3-diclorobutano, d) 2,3-dicloropentano. Disegnare le strutture degli stereoisomeri achirali.
3. Ordina i seguenti composti per acidità crescente e motivare la scelta

4. Quali sono l’ibridazione, la geometria e l’angolo di legame di un carbonio carbanionico? Quale sarà più stabile tra un carbanione primario e uno secondario? Perchè?
5) Quale dei due ioni mostrati di seguito è più stabile? Spiegare perchè

6) A partire dall’opportuno alchene, mostrare il meccanismo di sintesi del seguente composto. Indicare eventuali altri prodotti formati nel corso della reazione

7) Scrivere i prodotti delle seguenti reazioni. Indicare la stereochimica, quando opportuno

9) Scrivere la struttura di un generico L-amminoacido
TERZO SET
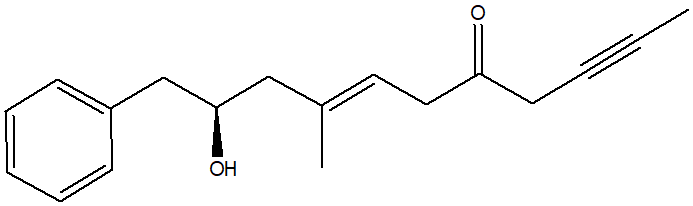
1. Assegnare il nome IUPAC, comprensivo di stereochimica, al seguente composto:
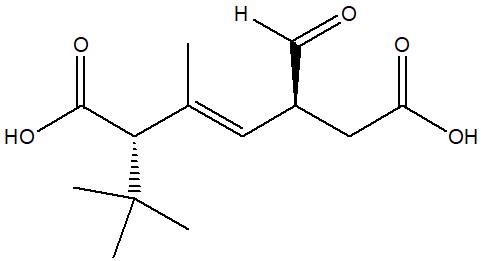
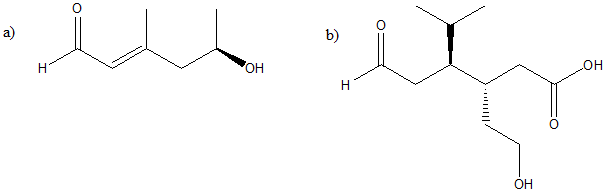
2. Scrivere 8 composti che abbiano formula molecolare C5H8O, almeno uno dei quali contenga un carbonio chirale.
3. Qual è il numero massimo di stereoisomeri per il seguente composto?
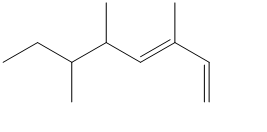
4. Quello riportato di seguito è il diagramma delle variazioni di energia potenziale rispetto all’angolo diedro per l’1,2-dicloroetano.

a) A cosa corrispondono A, C, E, G ? b) Disegnare le proiezioni di Newman di tutti i conformeri eclissati, indicandoli con la lettera corrispondente sul grafico. c) Discutere dei fattori che giustificano la minore energia potenziale dei conformeri più stabili.
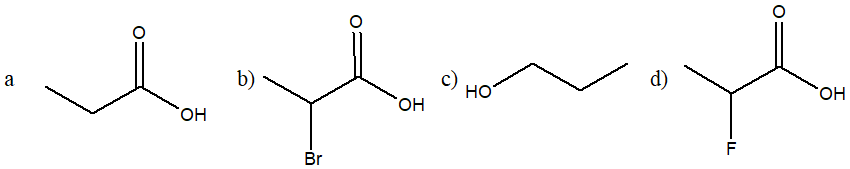
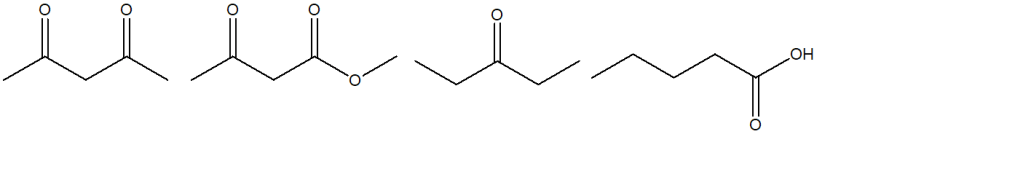
5) Disporre i seguenti composti in ordine di acidità crescente e giustificare la scelta

6) Completare il seguente schema inserendo le condizioni di reazioni o i prodotti mancanti. Evidenziare la stereochimica.
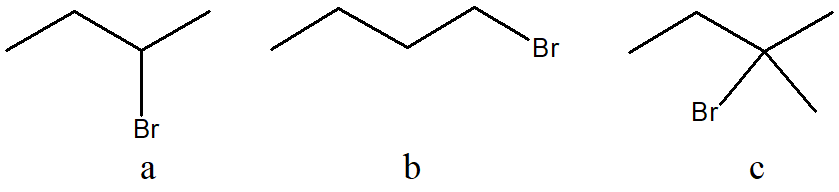
7) Ordina i seguenti composti per reattività crescente in una reazione a) E2 b) SN1
8) Mostrare il meccanismo di epimerizzazione e di arrangiamento enediolico catalizzato da base del D-glucosio
Cosa fare se si riscontrano difficoltà o se si hanno dubbi:
-rivedere gli argomenti problematici (NB: non si possono risolvere gli esercizi senza aver studiato la teoria, per cui sarà necessario studiare e approfondire l’argomento ed eventualmente-successivamente-esercitarsi ulterioremente utilizzando sia gli esercizi del libro sia quelli presenti su questo blog).
-contattare il docente: è possibile sia chiedere spiegazioni, sia fare ricevimento (anche in gruppo) o organizzare esercitazioni dedicate














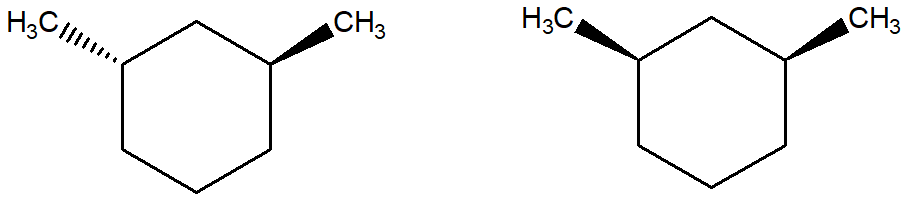

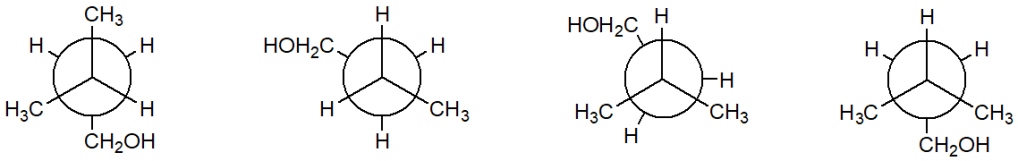



















You must be logged in to post a comment.