CONCETTI IMPORTANTI 12: ANALISI RETROSINTETICA

SINTESI
Quando si progetta una sintesi, il primo passaggio è confrontare il reagente con il prodotto. In particolare, bisogna:
- contare gli atomi di carbonio nello scheletro carbonioso della molecola target. Determinare come ottenere la catena carboniosa dai materiali dipartenza disponibili è la parte più impegnativa della sintesi. Se necessario aggiungere atomi di carbonio, bisogna considerare le reazioni che permettono di formare i legami carbonio-carbonio
- analizzare i gruppi funzionali. Quali sono e come possono essere modificati per facilitare la formazione della catena di atomi di carbonio? Come possono essere modificati aggiunti o eliminati per ottenere i gruppi funzionali del prodotto? la posizione dei gruppi funzionali è cambiata? La regiospecificità e la stereospecificità possono essere fattori da prendere in considerazione.
- Procedere a ritroso. Spesso è più facile individuare l’ultimo passaggio di una sintesi che tentare di partire dalla reazione iniziale (analisi retrosintetica). L’analisi retrosintetica è una strategia fondamentale in chimica organica utilizzata per progettare la sintesi di molecole complesse, partendo da precursori più semplici. Questo approccio si basa sull’idea di lavorare all’indietro, partendo dal prodotto finale desiderato e identificando le sequenze di reazioni necessarie per raggiungerlo. L’idea è di partire dalla struttura del prodotto finale e di procedere a ritroso, uno stadio alla volta, fino a che non si individua la sequenza che permette di preparare il prodotto desiderato dai reagenti disponibili. Se non si riesce a raggiungere il risultato al primo tentativo, è necessario ripetere l’analisi retrosintetica usando una diversa sequenza di reazioni
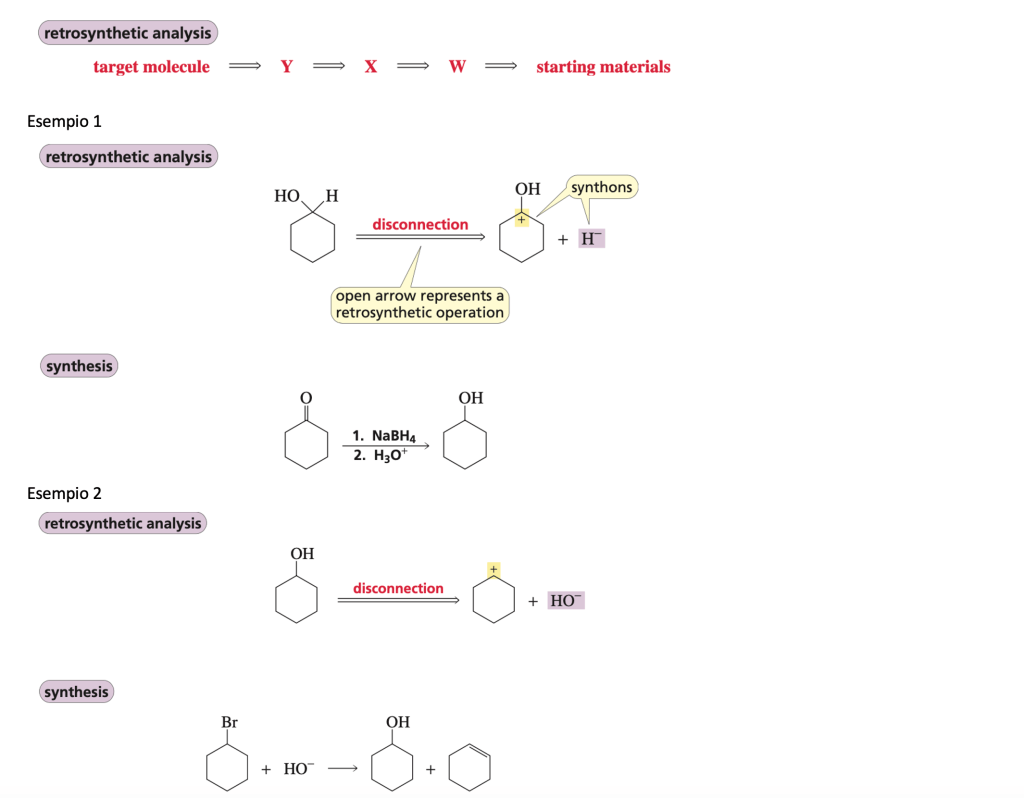
ANALISI RETROSINTETICA
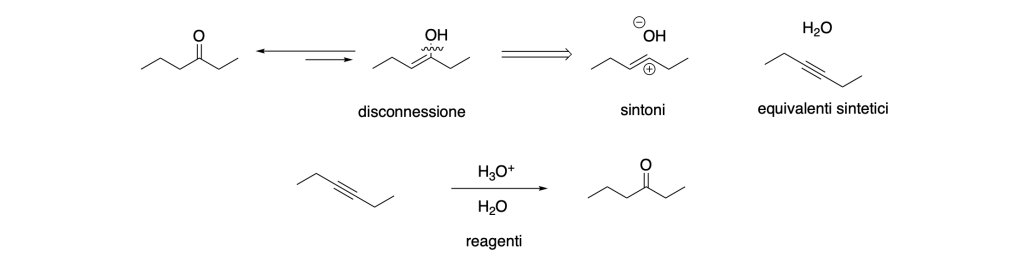
La freccia ⇒ indica la retrosintesi
A ⇒ B
la molecola B è la molecola più semplice che mediante una reazione porterà alla formazione della molecola A.
Nella progettazione della sintesi è fondamentale padroneggiare un gran numero di reazioni organiche: più reazioni si conoscono, più è probabile realizzare una sintesi con successo. Il principio guida nella pianificazione è semplificarla il più possibile. Un progetto di sintesi semplice ha una maggiore possibilità di avere esito positivo.
Disconnessione: La disconnessione implica la rottura di un legame all’interno della molecola target per generare due frammenti più semplici che potrebbero costituire i precursori della sintesi desiderata. Questo concetto aiuta a semplificare la complessità della sintesi, consentendo ai chimici di identificare i punti chiave di rottura per ottenere i precursori desiderati.
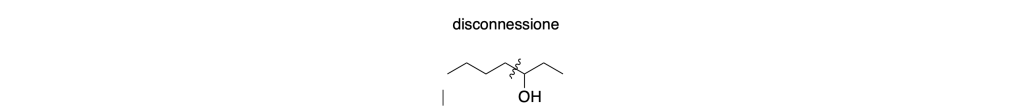
Sintoni: I sintoni sono frammenti ideali generati attraverso la disconnessione di un legame. Sono considerati ideali poiché rappresentano unità strutturali che facilitano la progettazione della sintesi. I sintoni possono essere utilizzati come guida per individuare i precursori necessari per la sintesi della molecola bersaglio.

Equivalenti Sintetici: Gli equivalenti sintetici sono specie chimiche effettive che svolgono la stessa funzione dei sintoni durante il processo di sintesi. Poiché i sintoni sono spesso specie ideali o transitorie e non possono essere impiegati direttamente, gli equivalenti sintetici vengono utilizzati al loro posto. Essi sono capaci di partecipare attivamente alle reazioni chimiche, generando gli intermedi di sintesi necessari per la formazione del prodotto finale.
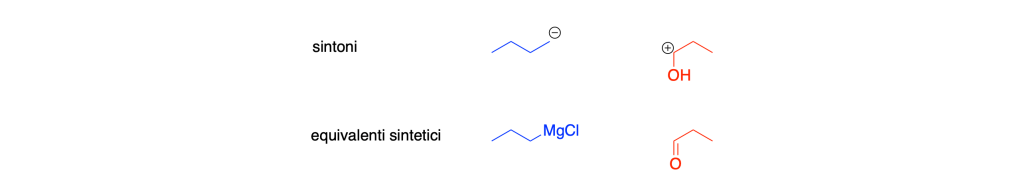
Reagenti: I reagenti sono i composti chimici effettivi che reagiscono con gli equivalenti sintetici per avviare le reazioni di sintesi. Essi forniscono gli atomi o i gruppi funzionali necessari per la formazione degli intermedi di sintesi o della molecola bersaglio stessa. I reagenti sono fondamentali per la trasformazione dei precursori in prodotti desiderati durante il processo di sintesi.
INTERCONVERSIONE DI GRUPPI FUNZIONALI
Quando si progetta una sintesi, il primo passaggio è comparare, tra il reagente e il prodotto, sia lo scheletro di atomi di carbonio sia la posizione dei gruppi funzionali. Se essi non variano, si deve semplicemente capire come convertire il gruppo funzionale del reagente in quello del prodotto.
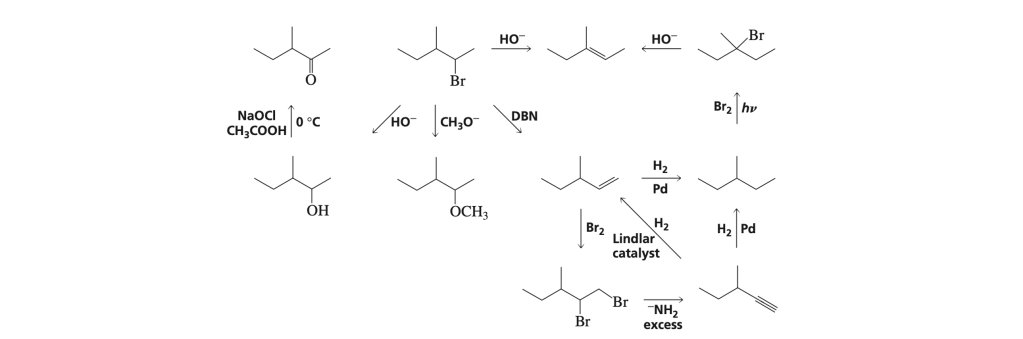
FUNZIONALIZZAZIONE DI UN CARBONIO
Può essere effettuata mediante una reazione radicalica

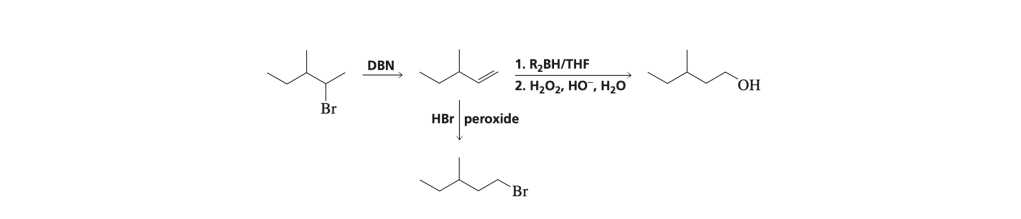
MODIFICA DELLA POSIZIONE DI UN GRUPPO FUNZIONALE
Se lo scheletro di atomi di carbonio non è modificato ma la posizione del gruppo funzionale è diversa, si devono prendere in considerazione le reazioni che modificano la posizione del gruppo funzionale.
MODIFICA DELLO SCHELETRO DI ATOMI DI CARBONIO
Se lo scheletro di atomi di carbonio è modificato, ma il numero di atomi di carbonio è lo stesso, si devono prendere in considerazione le reazioni che portano alla formazione di intermedi carbocationici.

AGGIUNTA DI UN CARBONIO ALLO SCHELETRO DELLA MOLECOLA
Le reazioni con cui è possibile introdurre un atomo di carbonio allo scheletro della molecola sono diverse. Il metodo che si sceglie dipende dal gruppo funzionale che si desidera avere nel prodotto.
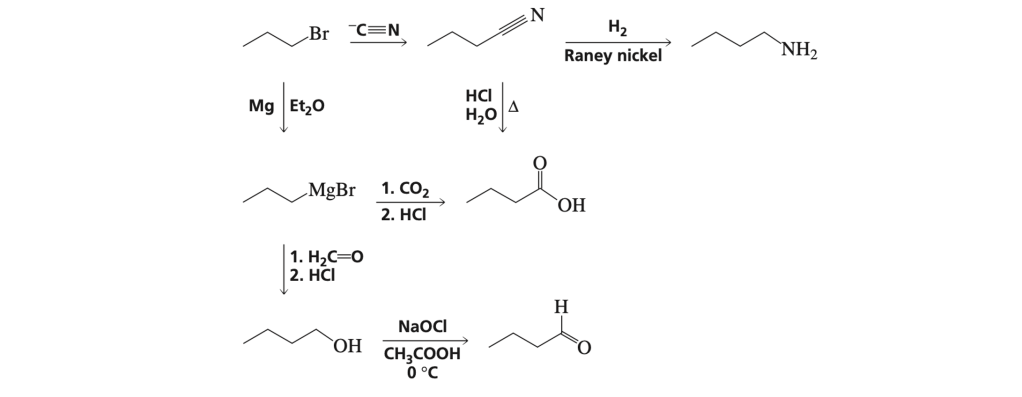
AGGIUNTA DI PIÙ DI UN CARBONIO ALLO SCHELETRO DELLA MOLECOLA
Le reazioni con cui è possibile introdurre Più un atomo di carbonio allo scheletro della molecola sono diverse. Ioni acetiluro, epossidi, reattivi di Grignard, addizione aldolica, reazione di Wittig e reazioni di accoppiamento sono alcuni esempi.
Per una visione d’insieme delle reazioni che possono essere utilizzate nel progettare una sintesi organica è possibile consultare il post “Mappe delle reazioni in Chimica Organica“
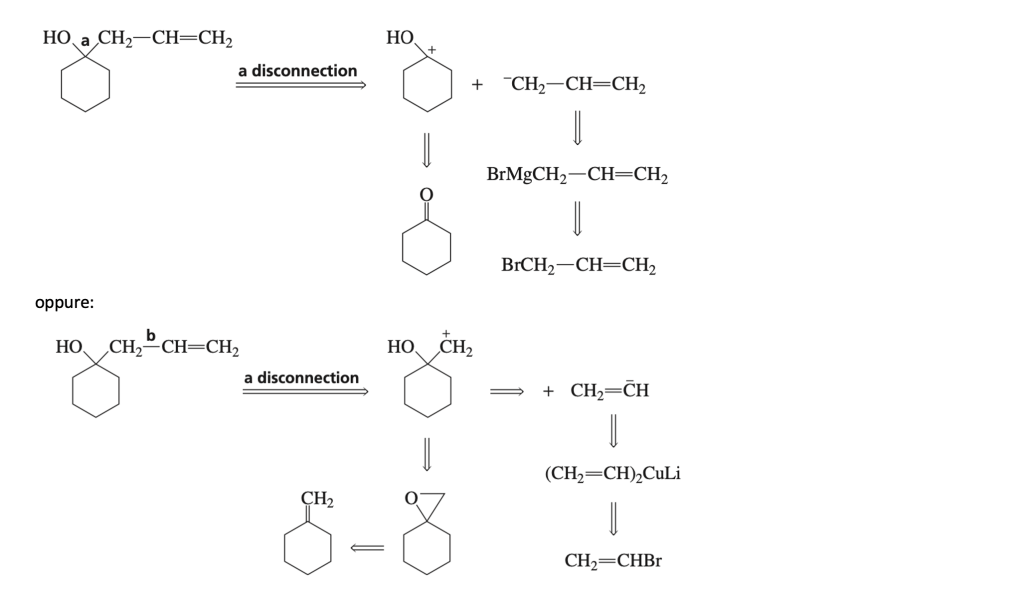
Esempio 3
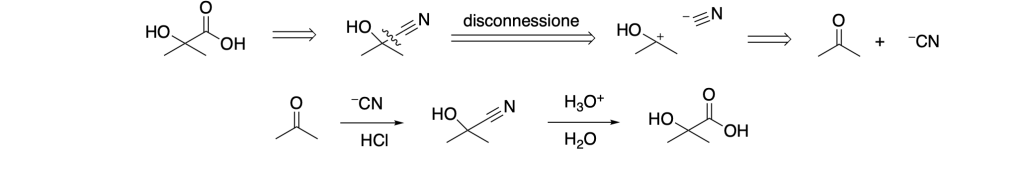
POSIZIONE RELATIVA DI DUE GRUPPI FUNZIONALI PER PROGETTARE UNA SINTESI
Se un composto contiene due gruppi funzionale, la loro posizione relativa può formìnire un buon suggerimento su come affrontare la sintesi.
- Formazione di un composto 1,2-diossigenato
- Formazione di un composto 1,3-diossigenato
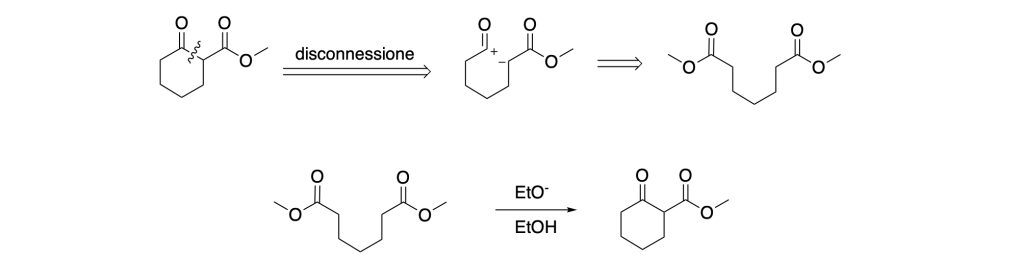
- Formazione di un composto 1,4-diossigenato
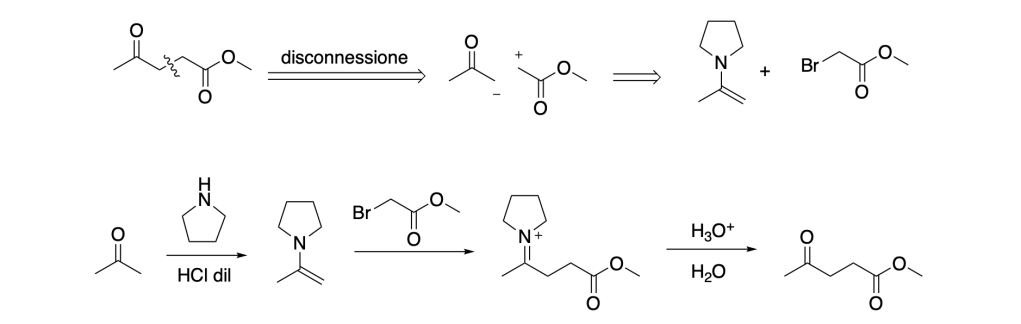
- Formazione di un composto 1,5-diossigenato

- Formazione di un composto 1,6-diossigenato
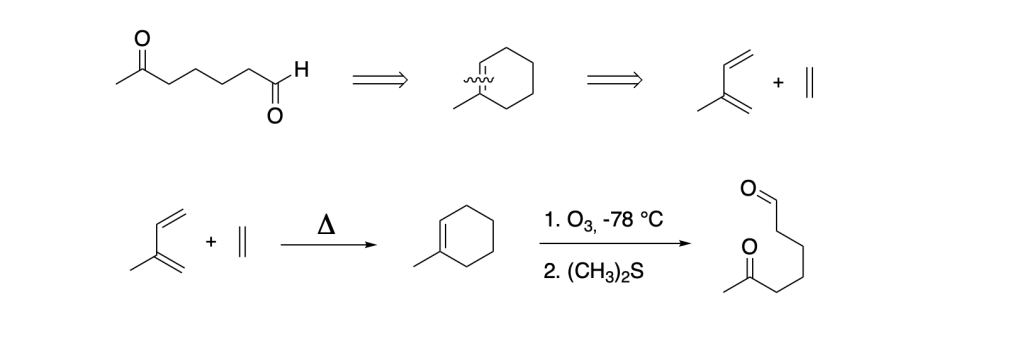
Esempio 1.
Sintetizzare il 3-esanone a partire dall’1-butino

Contando i carboni dei due composti, è evidente che bisogna aggiungere 2 carboni. In questo caso, dovendo partire dal butino, sfruttiamo l’acidità dell’idrogeno terminale per formare uno ione acetiluro da utilizzare come nucleofilo in una reazione SN2.

L’idratazione del 3-esino porta alla formazione di un enolo che tautomerizza immediatamente a chetone, quindi l’analisi retrosintetica è la seguente:

Per individuare i reagenti necessari, si parte dalle disconnessioni:
Per il primo passaggio dobbiamo disconnettere il legame C-C tra il C2 e il C3 del 3-esino:
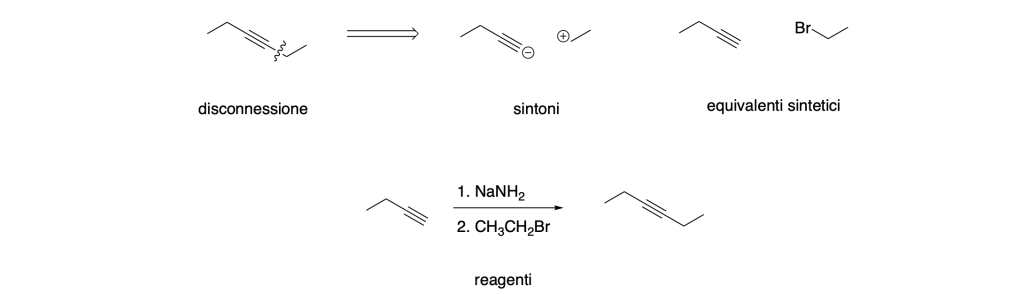
Pertanto, lo schema sintetico è:
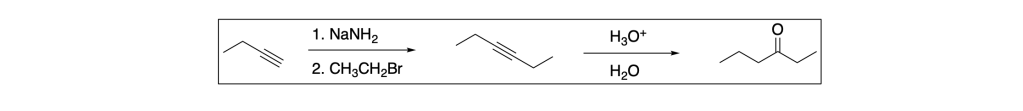
Esempio n. 2
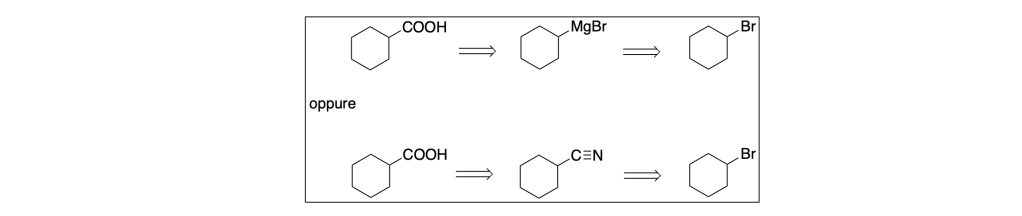
Sintetizzare l’acido cicloesancarbossilico a partire dal bromocicloesano:
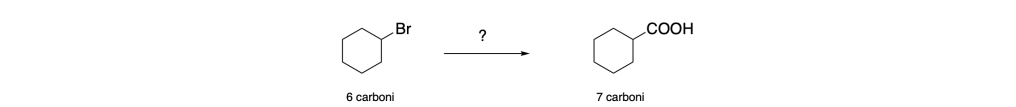
Partendo dalle disconnessioni possiamo avere due possibilità:
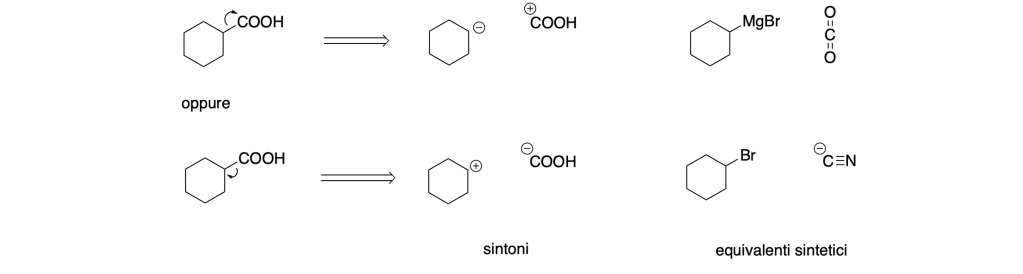
Le analisi retrosintetiche sono:
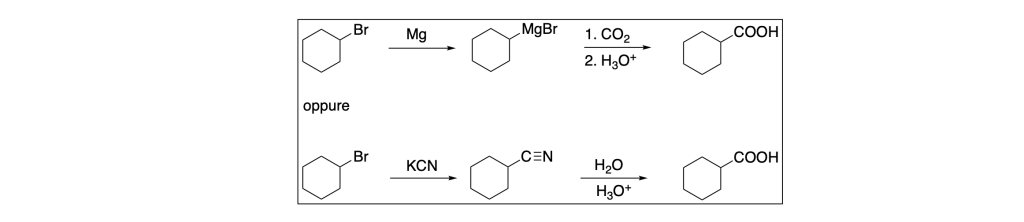
Gli schemi di sintesi sono:
Esempio n. 3
Sintetizzare l’1-metil-1-cicloesene a partire dal bromocicloesano
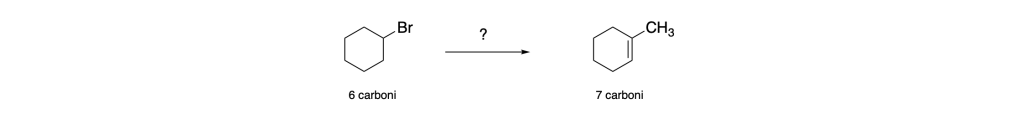
IN questo caso il prodotto da sintetizzare ha un carbonio in più e una insaturazione. Il doppio legame si può formare attraverso una reazione di disidratazione:
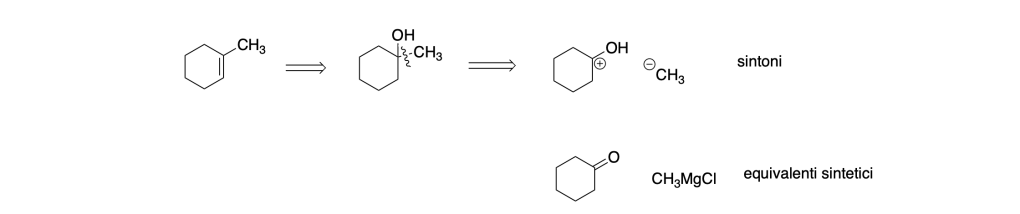
Il cicloesanone si può ottenere dall’ossidazione del cicloesanolo che si può ottenere dal bromocicloesano attraverso una reazione SN2

Quindi l’analisi retrosintetica è la seguente:

Lo schema di sintesi è dunque il seguente:

You must be logged in to post a comment.