VERSO LA PROVA DI RECUPERO – RIEPILOGO 2

TUTORIAL STEREOISOMERIA
ISOMERIA E STEREOISOMERIA:
- Isomeri di struttura (o isomeri costituzionali): composti che presentano la stessa formula molecolare ma diverso ordine di connessione fra gli atomi.
- Stereoisomeri: isomeri i cui atomi sono collegati nello stesso ordine, ma presentano diversa disposizione spaziale. Si dividono in:
- Isomeri conformazionali: diverse conformazioni dello stesso composto in equilibrio tra loro grazie alla veloce convertibilità (rotazione intorno ad un legame singolo). Non possono essere saparati l’uno dall’altro.
- Isomeri configurazionali: sono stereoisomeri che, pur mantenendo la medesima connettività (i collegamenti tra i singoli atomi rimangono i medesimi), possono essere trasformati l’uno nell’altro solo rompendo legami chimici. Sono composti diversi e possono essere separati l’uno dall’altro. Gli isomeri configurazionali si dividono in:
- Isomeri geometrici (isomeri cis-trans): composti che non presentano libera rotazione attorno al legame tra i due atomi di carbonio, ognuno dei quali è legato a due gruppi diversi
- Isomeri ottici: composti in cui sono presenti degli elementi stereogenici, cioè elementi a causa dei quali la molecola ammette due isomeri che sono uno la forma speculare non sovrapponibile dell’altro.
ISOMERI CONFORMAZIONALI:
- Un conformero sperimenta una tensione quando la sua struttura chimica subisce un qualche sforzo che innalza la sua energia interna rispetto a un conformero privo di tensione o con una minore tensione.
- La tensione torsionale è la resistenza opposta alla rotazione dei legami.
- La tensione angolare si manifesta quando gli angoli di legame deviano dal valore ideale
- La tensione sterica è il risultato della repulsione tra le nuvole elettroniche di atomi o gruppi
- Il conformero sfalsato è più stabile del conformero eclissato a causa dell’iperconiugazione

- Il conformero anti è più stabile del conformero gauche a causa della tensione sterica

- Il cicloesano interconverte rapidamente tra le due conformazioni a sedia ugualmente stabili. Questo processo è chiamato inversione di anello
- I legami che sono assiali in un conformero sono equatoriali nell’altro e viceversa

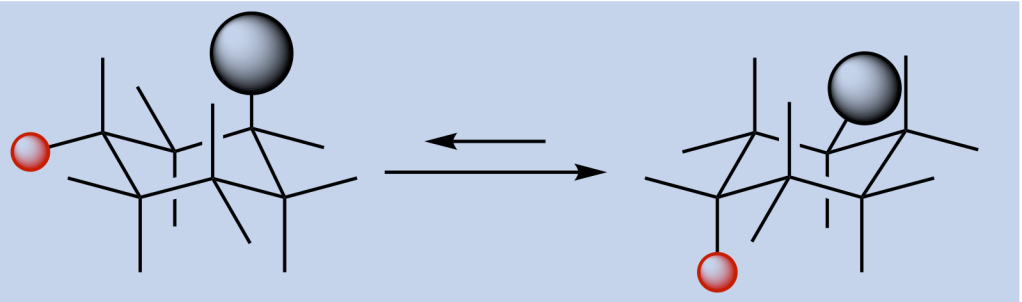
- Il conformero a sedia con un sostituente in posizione equatoriale ha meno tensione sterica ed è perciò più stabile del conformero con il sostituente assiale
- Un sostituente in posizione assiale ha interazioni 1,3-diassiali sfavorevoli
ISOMERI GEOMETRICI
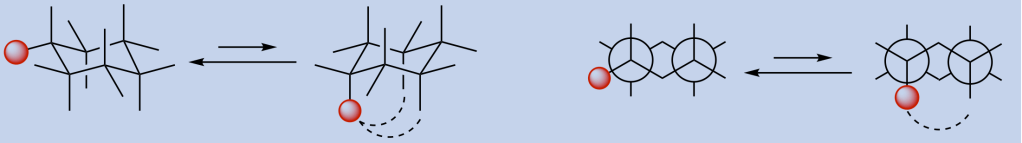
- Poiché la rotazione attorno ai legami di un composto ciclico è impedita, i composti ciclici disostituiti possono presentare gli isomeri cis-trans.
- L’isomero cis ha due sostituenti dallo stesso lato dell’anello; l’isomero trans ha i sostituenti su lati opposti.

- Se in un cicloesano disostituito un conformero a sedia ha entrambi i gruppi in posizione equatoriale e l’altro entrambi i gruppi in posizione assiale, il conformero più stabile è quello con entrambi i gruppi in posizione equatoriale
- Se in un cicloesano disostituito i due conformeri a sedia hanno entrambi un gruppo in posizione equatoriale e l’altro in posizione assiale, il conformero più stabile è quello con il gruppo più ingombrante in posizione equatoriale.
- Poiché la rotazione intorno ad un doppio legame è impedita, un alchene può presentare gli isomeri cis-trans.
- L’isomero cis ha gli idrogeni sullo stesso lato del doppio legame; l’isomero trans ha gli idrogeni su lati opposti del doppio legame.

- Le lettere Z ed E indicano la configurazione di un doppio legame
- L’isomero Z ha i sostituenti ad alta priorità (regole CIP) sullo stesso lato del doppio legame; l’isomero E ha i sostituenti ad alta priorità sui lati opposti del doppio legame.

Esercizio n. 1
Per ciascuno dei seguenti composti, relativamente al legame indicato, rappresentare le proiezioni di Newman dei confomeri a più alta e a più bassa energia:
- esano (C2-C3)
- 1-clorobutano (C1-C2)
- 2-metilbutano (C2-C3)
- 2,2-dimetilpentano (C2-C3)
- 2-cloro-2-metilpentano (C2-C3)
Esercizio n. 2
Per le seguenti coppie di composti, indicare se sono: stesso composto, isomeri di struttura o stereoisomeri

Esercizio n. 2
Disegnare un diagramma di energia qualitativo per il 2,3-dimetilpentano, relativo al legame C-3-C4 tra il gruppo metilenico (CH2) e quello metinico (CH). Le proiezioni di Newman sono riportate di seguito; etichettare con S le conformazioni sfalsate e con E quelle eclissate
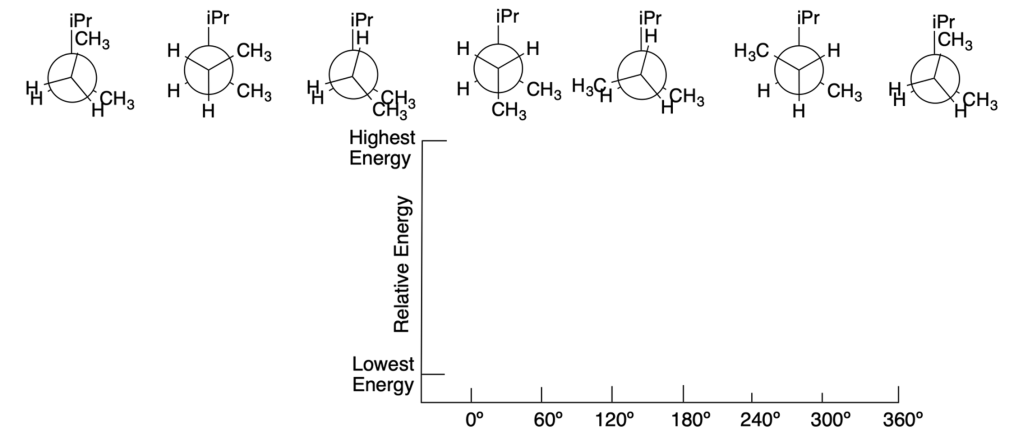
Esercizio n. 3
Rappresentare le due conformazioni a sedia dei seguenti cicloesani disostituiti indicando il conformero a più bassa energia:
- cis-2-bromo-1-metilcicloesano
- cis-3.isopropil-1-metilcicloesano
- cis-4-etilcicloesanolo
- trans-2-butil-2-isopropilcicloesano
- trans-3-t-butil-1-metilcicloesano
- trans-4-cloro-1-propilcicloesano
- cis-1-ciclopropil-3-isopropilcicloesano
Esercizio n. 4
Scrivere l’1,2-cicloesandiolo nella conformazione a sedia a più bassa energia e in proiezione di Newman (relativa ai legami C1-C2 e C5-C4).
Esercizio n. 5
Assegnare la configurazione E,Z ai seguenti composti:
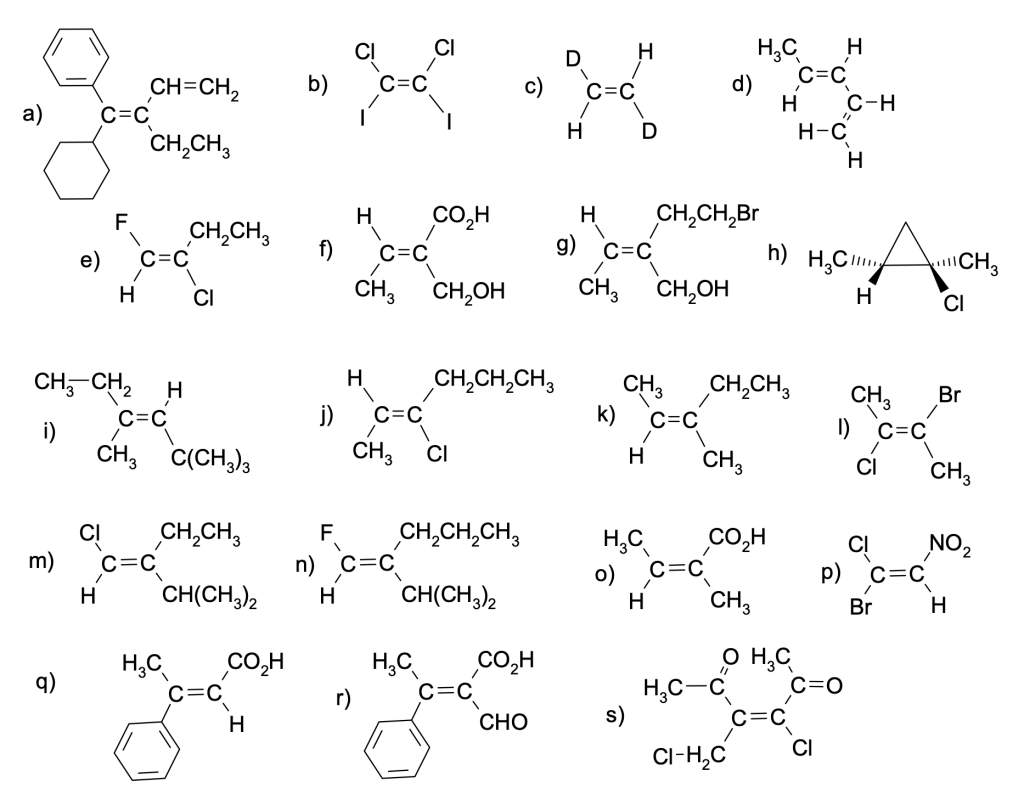
Esercizio n. 6
Scrivere gli isomeri geometrici del 2,4-esadiene e dare loro i nomi, secondo le notazioni E,Z e cis,trans
Esercizio n. 7
Scrivere le due conformazioni del butadiene: indicare i loro nomi e spiegare perché non si possono chiamare semplicemente cis e trans.
Esercizio n. 8
Individuare gli isomeri geometrici (se ce ne sono) dei seguenti composti e scriverne le formule
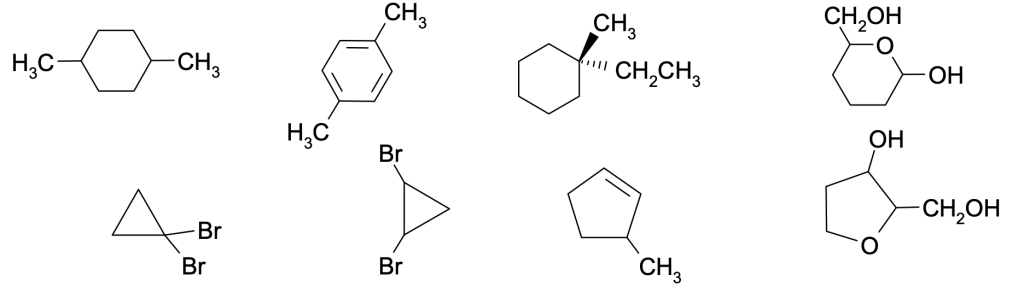
Esercizio n. 9
Scrivere le configurazioni cis e trans del biciclo[4.4.0]decano, servendosi delle formule sia proiettive che conformazionali (a sedia)
Esercizio n. 10
Indicare, per ciascuna delle seguenti molecole, la relazione esistente (stesso composto, isomeri di struttura, strutture di risonanza, stereoisomeri)

You must be logged in to post a comment.