Biomolecole

Nelle tracce di alcuni esercizi sono indicate le pagine del libro dove è possibile trovare supporto. NB: si fa riferimento sempre all’ultima edizione del Bruice. Chi ha altri testi o edizioni vecchie del Bruice può comunque risalire alle pagine utilizzando l’indice analitico.
1) Classifica i seguenti monosaccaridi (vedi esempio a) e dire se appartengono alla serie D o alla serie L. Attribuire la configurazione assoluta a ciascun carbonio chirale .

2) I monosaccaridi a 5 e 6 termini esistono in soluzione acquosa in maniera preponderante nelle loro forme emiacetaliche cicliche. Mostrare il processo di ciclizzazione per tutti gli zuccheri dell’esercizio 1 per cui questo è possibile. Indicare il carbonio anomerico e per ciascuno disegnare sia l’anomero alfa, sia l’anomero beta.
3) Scrivere:
a) D-mannosio (il mannosio è l’epimero in 2 del glucosio)
b) L-galattosio (il galattosio è l’epimero in 4 del glucosio)
c) D-allosio (l’allosio è l’epimero in 3 del glucosio)
d) L-idosio (l’idosio è un diastereoisomero del glucosio, che ne differisce per la configurazione al C-2, C-3 e C-4)
e) il D-fruttosio (il fruttosio è un chetoso che presenta, ai carboni chirali che restano tali, le stesse configurazioni assolute del glucosio)
4) Mostrare cosa accade se mettiamo il D-mannosio (epimero in 2 del glucosio) e il D-fruttosio in ambiente basico
5) Mostrare i prodotti di riduzione con sodio boro idruro e di ossidazione col reattivo di Tollens dei monosaccaridi dell’esercizio 3.
6) Mostrare il meccanismo e i prodotti della sintesi di Kiliani-Fisher effettuata su D-treosio e su D-eritrosio. è possibile sintetizzare il D-glucosio a partire da uno dei due? Come procedereste?
7) Mostrare il meccanismo di formazione di un legame (1-4′ glicosidico) tra due unità di glucosio (facendo riferimento al meccanismo per la formazione dei glicosidi). Quale sarà il prodotto principale e perchè?
8) Dire se il disaccaride formato in 7 è uno zucchero riducente.
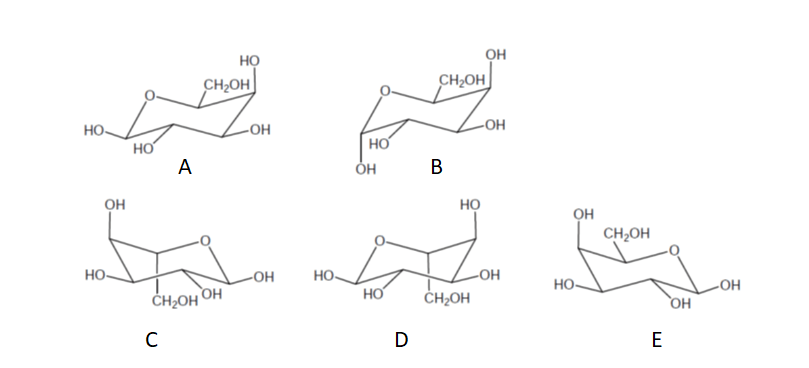
9) Quale delle seguenti strutture è quella del beta-L-galattopiranosio?
10) Dopo aver solubilizzato in acqua l’alfa e il beta D-galattopiranosio, si osserva per le due soluzioni una rotazione specifica pari a +150,7° e +52,8°, rispettivamente. Quando si effettua di nuovo la misura dopo un certo tempo, si osserva per entrambe le soluzioni una rotazione specifica pari a +80,2°. Come possiamo spiegare questa osservazione?
11) Scrivere i seguenti amminoacidi sia in proiezione di Fischer sia utilizzando le strutture a segmenti:
a) L-alanina (R=-CH3)
b) L-glutammina (R= -CH2CH2C=ONH2)
c) Acido L-aspartico (R=-CH2COOH)
d) L-cisteina (R=-CH2SH)
12) Quella riportata di seguito è la curva di titolazione dell’amminoacido alanina (R=-CH3).

a) Disegnare una curva di titolazione per l’amminoacido glicina (R=-H).
b) Di seguito è riportata la curva di titolazione per l’acido glutammico (R=-CH2COOH). Scrivere la struttura dell’amminoacido a 1) pH<2, 2) pH=3, 3) pH=7, 4) pH>10. NB: pka3 fa riferimento al pKa del gruppo ionizzabile in catena laterale; prima di affrontare questi esercizi è bene rivedere quanto studiato all’inizio del corso su acidi e basi. Consigliato anche vedere l’esercizio 51 a pagina 1026.

c) Di seguito è riportata la curva di titolazione per l’amminoacido arginina, insieme alla struttura dell’amminoacido a pH<2. Scrivere la forma zwitterionica e dire a quale valore di pH è presente. Quale sarà la struttura a pH>13?

13) Mostrare la sintesi del dipeptide alanilglicina (Ala-Gly; R =-CH3 per alanina, H per glicina).
14) Mostrare la sintesi del tripeptide glicilglicilalanina (Gly-Gly-Ala).
15) Mostrare la sintesi del tripeptide alanilglicilalanina (Ala-Gly-Ala).
16) La struttura mostrata di seguito è quella della base azotata adenina:

a) Analizzare le coppie solitarie di ciascun atomo di azoto e dire quali orbitali occupano. Per gli atomi che fanno parte del sistema ciclico, dire se le coppie solitarie contribuiscono o meno al sistema aromatico (NB: analizzarle sempre singolarmente).
b) Conoscendo la struttura di base di un nucleotide, scrivere la struttura dell’adenosina-5′-monofosfato e della 2′-deossiadenosina-5′-monofosfato (NB: in questo caso è presente deossiribosio, invece del ribosio–> “2′-deossi”).
17) Mostrare perchè è fondamentale, ai fini della stabilità del DNA, che questo contenga deossiribosio, anzichè ribosio (vedere pag. 1163, par. 26.4)
18) Quella di seguito mostrata è la struttura dell’adenosina. Facendo riferimento a questa, scrivere la struttura dell’ATP (=adenosina-5′-trifosfato) e spiegare perchè i legami fosfoanidridici sono chiamati legami ad alta energia (vedere pagg 1102-1103 del Bruice)

19) Scrivere la struttura di un trigliceride semplice in cui il glicerolo (1,2,3-propantriolo) è esterificato con un acido grasso a 18 atomi di carbonio.
20) L’acido oleico, un acido grasso omega-9 (che presenta cioè un doppio legame sul carbonio 9, contando dall’estremità metilica) a 18 atomi di carbonio ha un punto di fusionedi 13°C, mentre l’acido stearico, l’acido grasso saturo a 18 atomi di C, ha un punto di fusione di 69°C. Spiegare questa differenza.
Qui potete trovare alcuni esercizi svolti (si consiglia di prendere visione di questo file solo dopo aver provato a risolvere gli esercizi in maniera autonoma)

















































You must be logged in to post a comment.