Calendario appuntamenti della prossima settimana

| Giorno | Ora | Evento | Aula | Note |
|---|---|---|---|---|
| 03/02 | 15:30 | PROVA SCRITTA | A1 | |
| 04/02 | 9:30 | ESAME ORALE | L |
Università degli Studi della Campania "Luigi Vanvitelli"

| Giorno | Ora | Evento | Aula | Note |
|---|---|---|---|---|
| 03/02 | 15:30 | PROVA SCRITTA | A1 | |
| 04/02 | 9:30 | ESAME ORALE | L |

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomenti…e a breve altre liste di domande saranno pubblicate. In ogni caso, potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti. In fondo alla lista, troverete anche una classifica del livello di difficoltà delle domande.
Grado di difficoltà delle domande:
Alto (richiedono più passaggi e/o notevole padronanza della disciplina): 17
Medio (domande che vanno al di là della mera esposizione/applicazione di concetti teorici): 5, 8, 24, 30
Basso (domande che riguardano l’esposizione di concetti teorici, la dimostrazione di semplici meccanismi di reazione, l’applicazione diretta di concetti teorici di base): tutte le domande non incluse nelle due liste precedenti.

Sono state pubblicate le soluzioni di alcuni esercizi degli ultimi set.
Sono stati, inoltre, pubblicati gli esercizi della IV prova.
Infine, sul blog sono già disponibili numerosi set per il training sia in vista della prova scritta, sia si quella orale

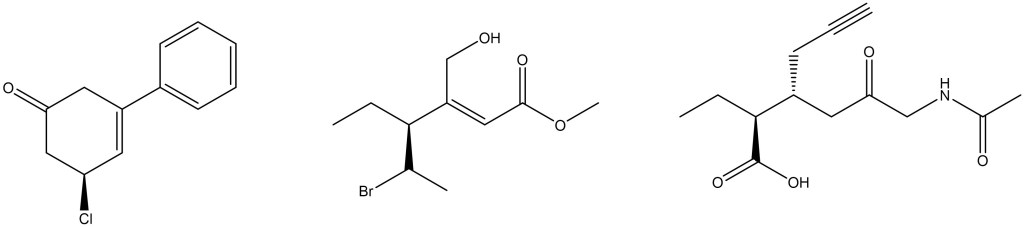
1. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti
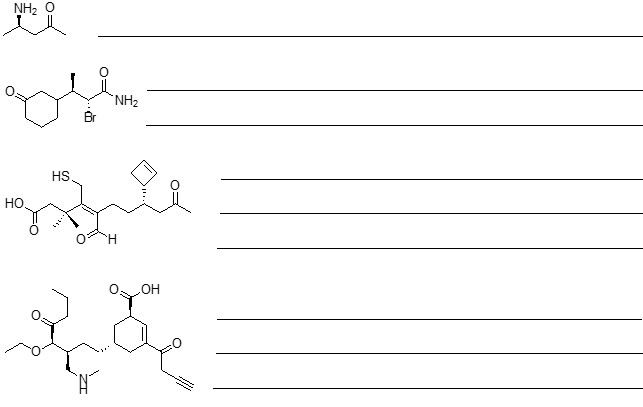
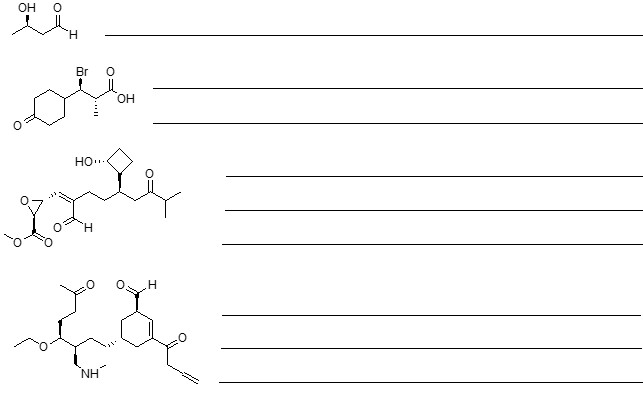
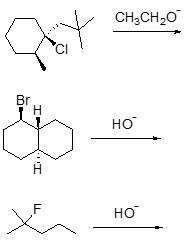
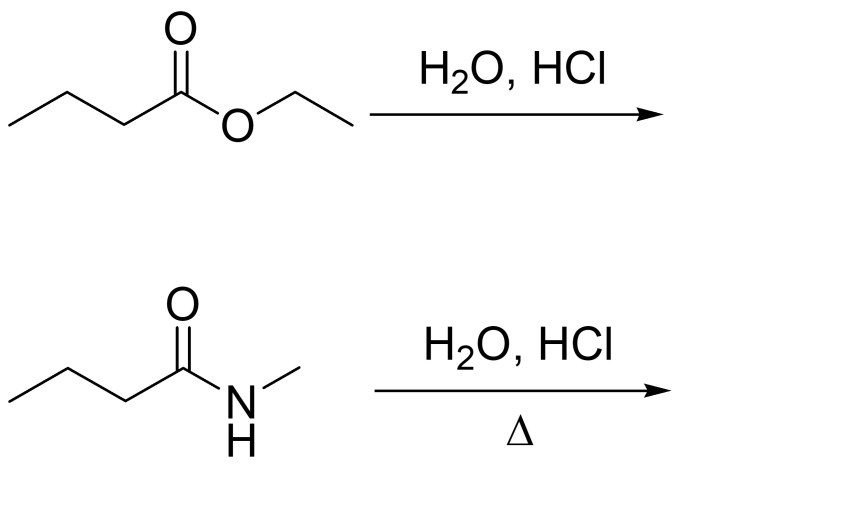
2. Scrivere i prodotti principali di eliminazione delle seguenti reazioni, indicando, per ciascuna reazione, se procede con meccanismo E1 o E2

3. Scrivere i prodotti principali delle seguenti reazioni, indicando la stereochimica quando necessario:
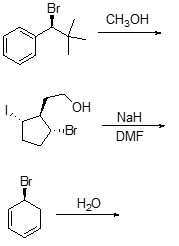
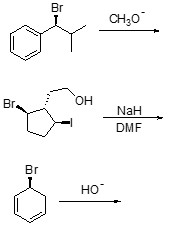
4. A. Chi reagirà più velocemente in una reazione E2 tra (1R,3R)-1-bromo-3-isopropilcicloesano e (1R,3S)-1-bromo-3-isopropilcicloesano? Spiegare sinteticamente perché.
B. Chi reagirà più velocemente in una reazione E2 tra (1S,3S)-1-bromo-3-isopropilcicloesano e (1S,3R)-1-bromo-3-isopropilcicloesano? Spiegare sinteticamente perché.
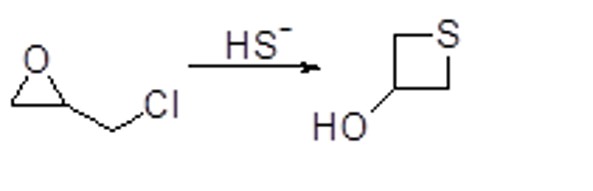
5. I reattivi di Grignard sono tra i nucleofili che possono aprire gli epossidi. Mostrare il meccanismo e i prodotti della seguente sequenza di reazioni (indicando la stereochimica dei prodotti):
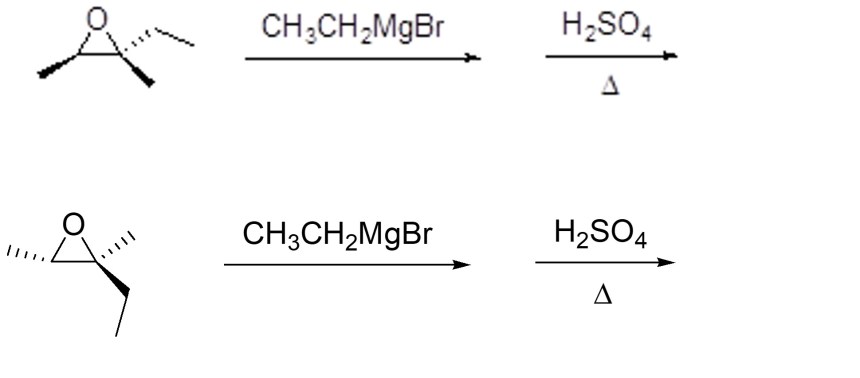
6. A. La disidratazione acido-catalizzata del (1R,2R)-2-metil-1-ciclopentanolo porta alla sintesi di tre alcheni diversi. Mostrare il meccanismo di formazione dei tre prodotti.
B. La disidratazione acido-catalizzata del (1S,2S)-2-metil-1-ciclopentanolo porta alla sintesi di tre alcheni diversi. Mostrare il meccanismo di formazione dei tre prodotti.
7. Completare il seguente schema inserendo le condizioni di reazione o i prodotti mancanti. Evidenziare la stereochimica quando opportuno.
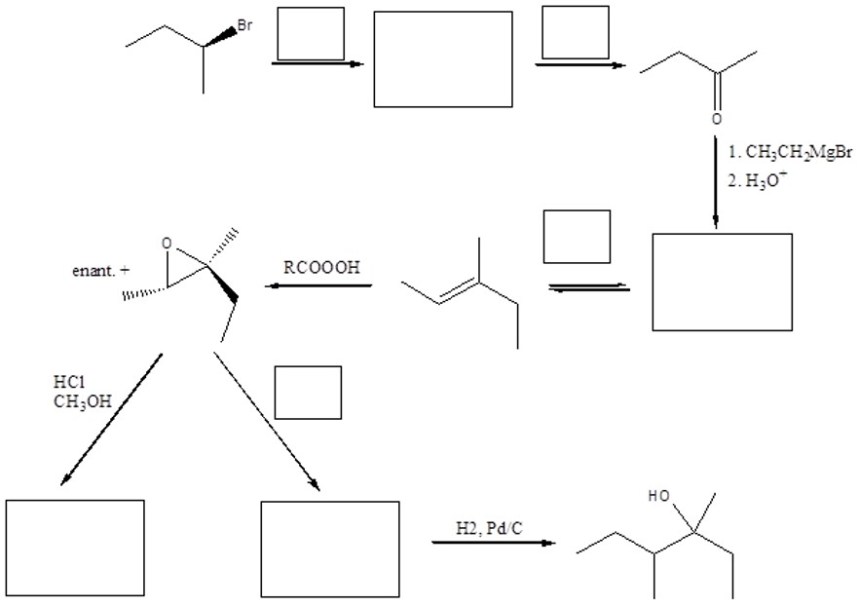
8. Mostrare il meccanismo e i prodotti della seguente reazione:
Opzionale 1: Mostrare il meccanismo per la seguente trasformazione
Opzionale 2: Assegnare il nome IUPAC comprensivo di stereochimica al seguente composto

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomenti…e a breve altre liste di domande saranno pubblicate. In ogni caso, potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti. In fondo alla lista, troverete anche una classifica del livello di difficoltà delle domande.
Grado di difficoltà delle domande:
Alto (richiedono più passaggi e/o notevole padronanza della disciplina): 9, 17
Medio (domande che vanno al di là della mera esposizione/applicazione di concetti teorici): 6, 8, 14, 20, 24, 25, 29, 30
Basso (domande che riguardano l’esposizione di concetti teorici, la dimostrazione di semplici meccanismi di reazione, l’applicazione diretta di concetti teorici di base): tutte le domande non incluse nelle due liste precedenti.

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomenti…e a breve altre liste di domande saranno pubblicate. In ogni caso, potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti. In fondo alla lista, troverete anche una scala del livello di difficoltà delle domande.
Grado di difficoltà delle domande:
Alto (richiedono più passaggi e/o notevole padronanza della disciplina): 4
Medio (domande che vanno al di là della mera esposizione/applicazione di concetti teorici): 6, 15, 16, 19, 22, 23, 24, 25
Basso (domande che riguardano l’esposizione di concetti teorici, la dimostrazione di semplici meccanismi di reazione, l’applicazione diretta di concetti teorici di base): tutte le domande non incluse nelle due liste precedenti.

| Giorno | Ora | Evento | Aula | Note |
|---|---|---|---|---|
| 21/01 | 9:30 | ESAME ORALE | D1 | |
| 28/01 | 9:30 | ESAME ORALE | L |
L’incontro pre-esame orale (inizialmente previsto per lunedì) è annullato, dato che nessuno ha espresso dubbi utilizzando l’apposito form.

Suggerimento: per poter usare questi set di esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 2 ore per ciascun set.
PRIMO SET
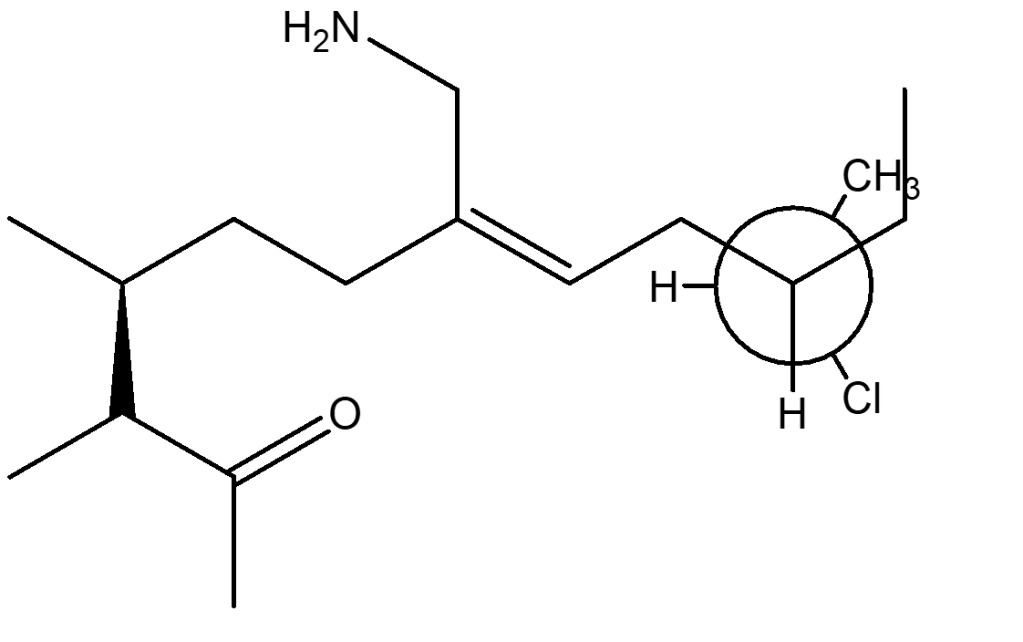
1. Attribuire il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:

2) Disporre i seguenti composti in ordine di solubilità crescente in acqua. Indicare l’ordine inserendo i numeri nei riquadri sotto le strutture: 1= il meno solubile, 4= il più solubile

3) Calcolare il numero massimo di stereoisomeri possibili per la seguente struttura. Scriverne uno a scelta e determinare la configurazione assoluta dei carboni chirali

4) In basso è riportata la struttura del dolcificante aspartame:

I) Oltre al fenile, sono presenti altri 4 gruppi funzionali: cerchiare ogni gruppo funzionale ed identificarlo come nell’esempio in alto
II) Individuare i carboni chirali ed assegnare a ciascuno di essi la configurazione assoluta.
III) Indicare l’ibridazione dei due atomi di azoto
IV) Dire quale dei due atomi di azoto è più basico e perché
5) Stabilire le configurazioni assolute dei carboni chirali presenti nelle seguenti molecole (NB: la notazione va riportata vicino ai carboni cui fa riferimento) e dire qual è la relazione stereochimica esistente tra i composti di ciascuna coppia (enantiomeri/diastereoisomeri/stesso composto/altro):
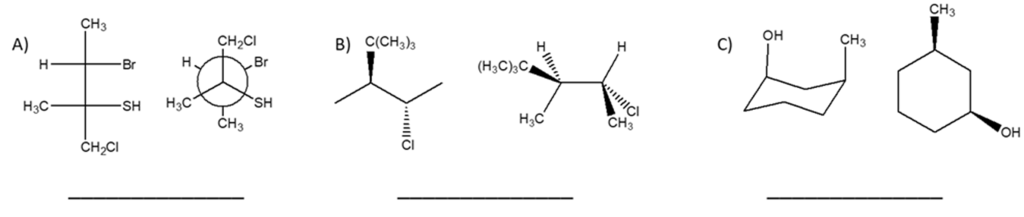
6) Dire se le strutture riportate a destra sono isomeri conformazionali, isomeri geometrici, isomeri ottici, isomeri costituzionali, o lo strutture identiche rispetto alla seguente struttura a segmenti:

7)Mostrare come il seguente anione è stabilizzato per risonanza

8) Mostrare le condizioni di reazione e il meccanismo della seguente trasformazione (ignorare la stereochimica).

9) Mostrare il meccanismo e i prodotti della seguente reazione:

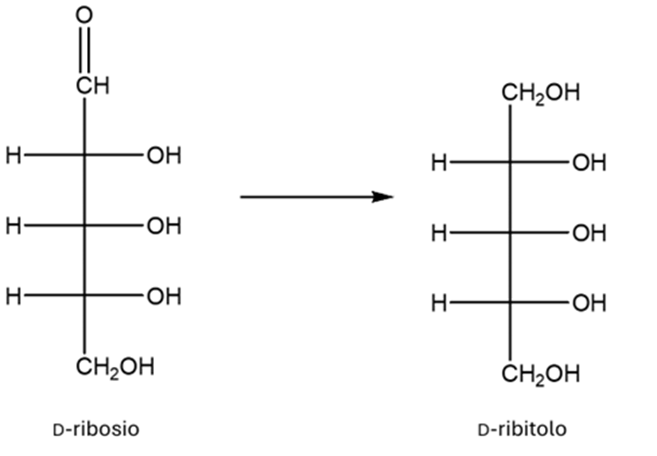
10)Indicare le condizioni di reazione per ottenere la seguente trasformazione e dire se i due composti raffigurati sono otticamente attivi
SECONDO SET
1. Attribuire il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:

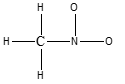
2) Completare la seguente struttura di Lewis e calcolare la carica formale per tutti gli atomi diversi all’idrogeno:
3) Quali sono la geometria, l’angolo di legame e l’ibridazione previste per il catione metile?
4) Dire qual è la relazione esistente tra i seguenti composti (enantiomeri/diastereoisomeri/ isomeri geometrici/isomeri conformazionali/ stesso composto/isomeri costituzionali/altro)

5) Disporre i seguenti composti in ordine di basicità decrescente e spiegare sinteticamente il perché:
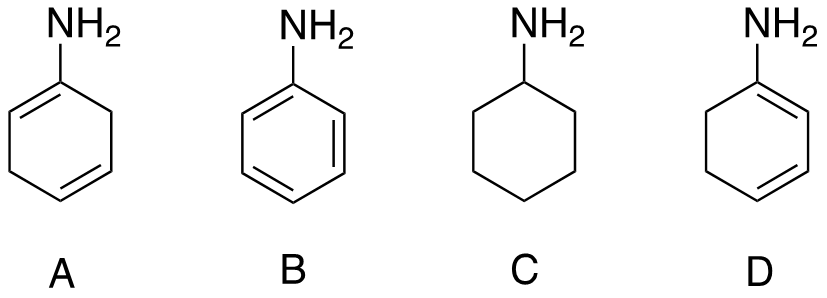
6) Scrivere i prodotti principali delle seguenti reazioni.


7) Mostrare le condizioni di reazione, il meccanismo e i prodotti della reazione del ciclopentanone con dimetilammina.
8) L’acido L-aspartico è un amminoacido con R= -CH2COOH.
I valori di pKa dei gruppi ionizzabili sono i seguenti:
pKa α-COOH = 2.09
pKa α-NH3+ = 9.82
pKa COOH in catena laterale = 3.86
a) Scrivere l’amminoacido in proiezione di Fischer al punto isoelettrico
b) Determinare la configurazione assoluta del carbonio chirale
c) Calcolare il punto isoelettrico
d) Scrivere la struttura dell’amminoacido a pH>10 e a pH
TERZO SET
1. Attribuire il nome sistematico IUPAC, comprensivo di stereochimica, alle seguenti molecole:

2. Stabilire le configurazioni assolute dei carboni chirali presenti nelle seguenti molecole (NB: la notazione va riportata vicino ai carboni cui fa riferimento) e dire qual è la relazione stereochimica esistente tra i composti di ciascuna coppia (isomeri conformazionali/enantiomeri/diastereoisomeri/stesso composto/altro):

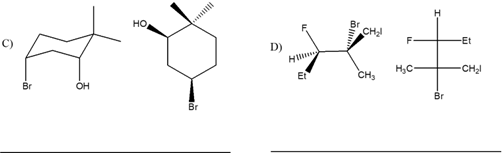
3. Prendendo in considerazione il legame C3-C4 del 2-metilpentano, scrivere la proiezione di Newman del conformero più stabile in assoluto e la struttura a cavalletto del conformero meno stabile in assoluto
4. Scrivere i prodotti principali delle seguenti reazioni. Indicare anche il meccanismo con cui avvengono. Indicare la stereochimica, quando opportuno.
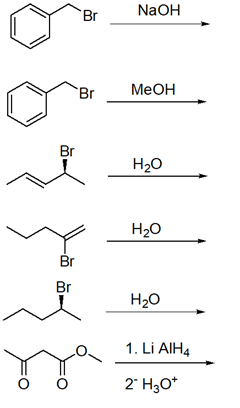
5. Ordina i seguenti composti per reattività crescente in una reazione E2

6. Mostra il meccanismo e i prodotti della seguente reazione:

7. Completare il seguente schema inserendo le condizioni di reazione o i prodotti mancanti nei riquadri. Indicare la stereochimica quando opportuno.

8. Scrivi il dipeptide Ala-Gly sapendo che le catene laterali dei due amminoacidi sono -CH3 e -H, rispettivamente

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomenti…e a breve altre liste di domande saranno pubblicate. In ogni caso, potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti. In fondo alla lista, troverete anche una scala del livello di difficoltà delle domande.
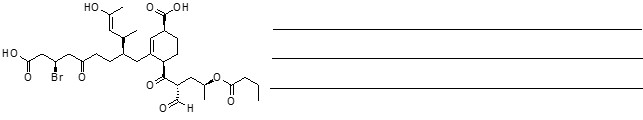
La molecola qui sotto riportata è la stricnina, un alcaloide tossico contenuto nei semi della noce vomica


Grado di difficoltà delle domande:
Alto (richiedono più passaggi e/o notevole padronanza della disciplina): –
Medio (domande che vanno al di là della mera esposizione/applicazione di concetti teorici): 3, 7, 16, 21
Basso (domande che riguardano l’esposizione di concetti teorici, la dimostrazione di semplici meccanismi di reazione, l’applicazione diretta di concetti teorici di base): tutte le domande non incluse nelle due liste precedenti.

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomenti…e a breve altre liste di domande saranno pubblicate. In ogni caso, potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti. In fondo alla lista, troverete anche una scala del livello di difficoltà delle domande.

Grado di difficoltà delle domande:
Alto (richiedono più passaggi e/o notevole padronanza della disciplina): 1
Medio (domande che vanno al di là della mera esposizione/applicazione di concetti teorici): 9, 11, 19
Basso (domande che riguardano l’esposizione di concetti teorici, la dimostrazione di semplici meccanismi di reazione, l’applicazione diretta di concetti teorici di base): tutte le domande non incluse nelle due liste precedenti.
You must be logged in to post a comment.