Concetti importanti 8: reazioni degli alcheni

- I nucleofili sono specie ricche di elettroni; gli elettrofili sono specie povere di elettroni.
- I nucleofili reagiscono con gli elettrofili
- Il meccanismo della reazione descrive stadio per stadio il processo attraverso il quale i reagenti vengono convertiti in prodotti
- Un diagramma di energia libera/coordinata di reazione mostra le variazioni di energia che avvengono nel corso della reazione.
- Quando dei reagenti si convertono in prodotti, la reazione passa attraverso uno stadio di transizione corrispondente al massimo di energia.
- La termodinamica descrive una reazione all’equilibrio
- Più stabile è la specie, minore è l’energia.
- La costante di equilibrio Keq indica le concentrazioni relative dei reagenti e dei prodotti all’equilibrio.
- Più stabile è il prodotto rispetto al reagente, maggiore è la sua concentrazione all’equilibrio e maggiore è la Keq
- Se i oprodotti sono più stabili dei reagenti, allora Keq >1, DG° è negativo e la reazione è esoergonica.
- Se i reagenti sono più stabili dei prodotti, allora Keq è <1, DG° è positivoe la reazione è endoergonica
- DG° e Keq sono correlati dall’equazione –RT ln Keq
- DG° è la variazione di energia libera di Gibbs, con DG° = DH° – TDS°
- DH° è la variazione di entalpia, cioè il calore emesso o assorbito derivante dalla formazione e dalla rottura dei legami
- Una reazione esotermica presenta un DH° negativo; una reazione endotermica presenta un DH° positivo
- DS°è la variazione di entropia, cioè la variazione del grado di libertà di movimento del sistema.
- La formazione di prodotti con legami più forti e maggiori libertà di movimento rende il DH° negativo.
- L’energia libera di attivazione DG‡, è la barriera di energia di una reazione. Essa è la differenza tra l’energia libera dei reagenti e quella dello stato di transizione.
- Minore è il DG‡ più veloce è la reazione
- La velocità di una reazione dipende dalla concentrazione dei reagenti, dalla temperatura e dalla costante cinetica.
- La costante cinetica indica quanto facilmente i reagenti raggiungono lo stato di transizione
- Un intermedio è il prodotto di uno stadio della reazione e il reagente dello stadio successivo
- Gli stati di transizione hanno legami parzialmente formati; gli intermedi hanno legami completamente formati
- Lo stadio cineticamente determinante è quello con lo stato di transizione al punto massimo del diagramma di energia libera/coordibìnata di reazione.
REAZIONI DEGLI ALCHENI
- Gli alcheni danno reazioni di addizione elettrofila; le reazioni di addizione elettrofila iniziano sempre con l’addizione di un elettrofilo al carbonio sp2 legato al maggior numero di idrogeni e terminano con l’addizione di un nucleofilo all’altro carbonio sp2.
- Nelle reazioni di addizione elettrofila, il primo stadio si viene a formare un intermedio, generalmente un carbocatione.
- I carbocationi terziari sono più stabili dei carbocationi secondari, che sono più stabili dei carbocationi primari. L’iperconiugazione giustifica questo andamento.
- Un carbocatione darà una trasposizione se diventa più stabile come risultato dela trasposizione stessa.
- Una reazione di ossidazione diminuisce il numero di legami C-H e aumenta il n. di legami C-O, C-N, C-X.
- In una reazione concertata tutti i processi di formazione e rottura dei legami avvengono nello stesso stadio.
- Una reazione regioselettiva seleziona un particolare isomero di struttura (Markovnivov)
- Una reazione stereoselettiva seleziona un particolare stereoisomero
- Una reazione è stereospecifica se un reagente può presentare più stereoisomeri e ciascun stereoisomero forma un diverso stereoisomero o tipi di stereoisomeri
- Quando un reagente privo di centri asimmetrici forma un prodotto con un centro asimmetrico, il prodotto è sempre in miscela racemica
- Quando un reagente che ha un centro asimmetrico forma un prodotto con un secondo centro asimmetrico, si ottengono diastereoisomeri in quantità diverse.
- Nell’addizione sin i sostituenti si legano dalla stessa parte del doppio legame; nell’addizione anti si legano da parti opposte


Esempio di esercizio su una reazione regioselettiva, stereoselettiva e stereospecifica
Partendo dall’opportuno alchene, illustrare il meccanismo di reazione della sintesi del seguente composto. Indicare eventuali altri prodotti fornendo per tutti il nome IUPAC completo di stereochimica.

Si tratta di una reazione di un alchene (3-metil-2-pentene) con bromo in metanolo. Poichè questa è una reazione stereospecifica, è ESSENZIALE capire da quale isomero (E o Z) dell’alchene bisogna partire per ottenere il prodotto desiderato. Dal momento che questa reazione è anche stereoselettiva, determiniamo le configurazioni assolute dei carboni chirali, sapendo che in questo caso otterremo anche l’enantiomero.

Per capire da quale alchene dobbiamo partire, trasformiamo questa proiezione di Fisher in una rappresentazione a cavalletto, sapendo che i sostituenti sulla linea verticale si trovano lontani dall’osservatore, mentre quelli sulla linea orizzontale sono rivolti verso l’osservatore:
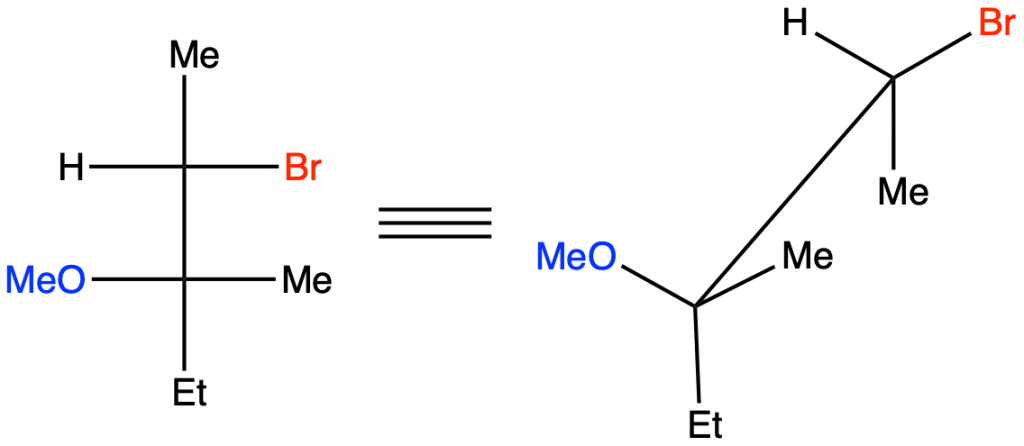
L’addizione di bromo in metanolo procede con stereochimica anti; questo significa che Br e OMe devono trovarsi da parte opposta. Ruotiamo dunque la rappresentazione a cavalletto lungo il legame C2-C3 in modo da evidenziare quanto appena detto:

L’alchene di partenza è dunque l’ (Z)-3-metil-2-pentene
MECCANISMO:
Il bromo, avvicinandosi agli elettroni pi-greco del doppio legame, si polarizza. L’attacco nucleofilo da parte dell’alchene porta alla formazione del catione bromonio e dell’anione bromuro.

Poichè la reazione viene condotta in metanolo, sarà l’alcol ad attaccare lo ione bromonio in anti rispetto al bromo; poichè la reazione è regioselettiva, il metanolo attaccherà il carbonio più sostituito (cfr. stato di transizione).
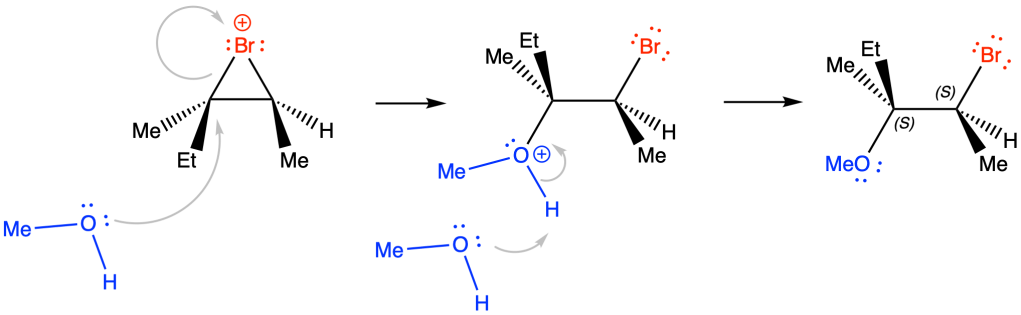
il carbonio che viene attaccato dal metanolo (conf. R) subisce inversione di configurazione con formazione del prodotto desiderato, il (2S,3S)-2-bromo-3-metil-3-metossipentano. L’attacco del bromo all’alchene dal basso, porterà alla formazione dell’enantiomero (2R,3R)-2-bromo-3-metil-3-metossipentano.
You must be logged in to post a comment.