IBRIDAZIONE – ORBITALI MOLECOLARI

Esercizio n. 1
Per ciascuna delle molecole sottostanti:
a) prevedete approssimativamente la geometria di oguno degli atomi indicati dalla freccia. Specificare il tipo dio ibridazione che giustifica tale geometria;
b) descrivete gli orbitali utilizzati per formare ciascun legame agli atomi indicati dalle frecce (s, p, ibridi sp, sp2, sp3);
c) disegnate e mostrate la sovrapposizione degli orbitali coinvolti nei legami indicati al punto b);
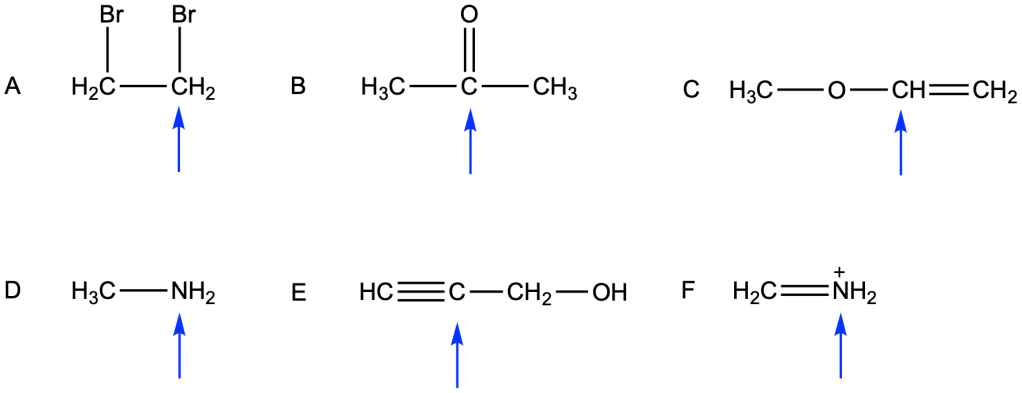
Esercizio n. 2
Certi composti, come quello rappresentato in basso, sono dotati di una potente attività biologica contro tipi di cellule caratteristici del cancro alla prostata. In questa struttura, individuate in esempio di ciascuno dei seguenti tipi di atomi o legami:
a) un legame covalente singolo fortemente polarizzato;
b) un doppio legame covalente fortemente polarizzato;
c) un legame covalente quasi polare;
d) un atomo di carbonio ibridato sp;
e) un atomo di carbonio ibridato sp2;
f) un atomo di carbonio ibridato sp3;
g) un legame tra atomi con ibridazione diversa;
h) il legame più lungo della molecola;
i) in legame più corto nella molecola (esclusi i legami agli atomi di idrogeno).

Esercizio n. 3
Nella seguente figura, alcuni dei legami sono indicati da freccia e da una lettera.
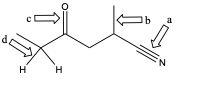
1) Etichettare i legami a-d come singoli, doppi o tripli;
2) indicare il tipo di orbitale/i molecolare/i;
3) dire quali orbitali atomici sono coinvolti nella formazione del legame.
4) Considerando tutti i legami singoli della molecola (ed escludendo i legami C-H) qual è il legame più corto?
Esercizio n. 4
Completare la seguente struttura di Lewis e calcolare la carica formale per tutti gli atomi diversi dall’idrogeno:

You must be logged in to post a comment.