Weekend Organic Chemistry Challenge

Regolamento:
- Vincerà la sfida chi risponderà per primo CORRETTAMENTE al seguente quesito
- La risposta dovrà essere inserita come commento al post (non saranno prese in considerazione risposte inviate via email). NB: è necessario utilizzare nome e cognome per essere identificati.
- Ognuno può rispondere solo una volta (anche in presenza di più di un commento pubblicato dalla stessa persona, soltanto il primo sarà preso in considerazione).
- Il tempo massimo a disposizione sarà di 24h dalla pubblicazione del post.
- Il vincitore (2 punti) sarà annunciato lunedì a lezione.
Anche questa settimana siamo alle prese con due isomeri geometrici (parleremo a breve di questo tipo di isomeria). Si tratta di composti diversi, in quanto, intorno al doppio legame non è possibile libera rotazione. Pur avendo entrambi due gruppi carbossilici e, la maggior parte delle caratteristiche strutturali in comune, essi sono caratterizzati da valori di pKa1 diversi (i valori sono riportati in figura). Fornire una spiegazione della diversa forza acida osservata per i due composti.
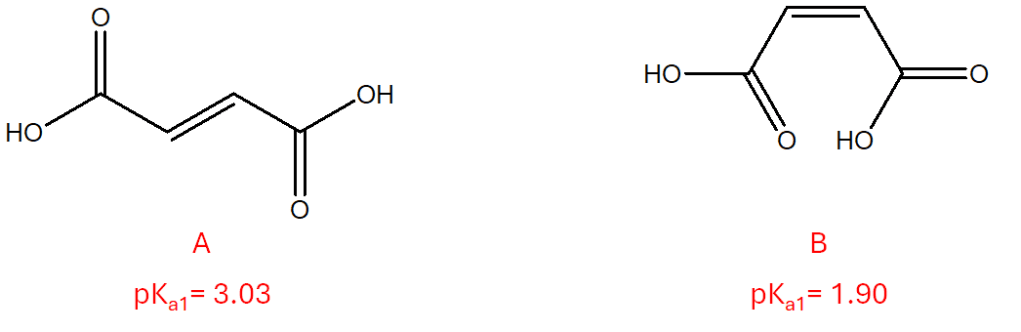
La differenza di acidità può essere spiegata dai fattori strutturali, ma anche elettronici, che influenzano ciascuna delle 2 molecole. Nell’isomero A i due gruppi carbossilici sono più distanti, quindi si riducono le interazioni nella molecola e l’assenza di una stabilizzazione interna porta ad un valore più elevato di pKa, che quindi si traduce in acidità minore. Nell’isomero B i gruppi carbossilici sono più vicini, consentendo quindi effetti di risonanza (delocalizzazione elettronica), che vanno a stabilizzare la base coniugata, rendendola un acido più forte. La maggiore stabilizzazione abbassa il pKa, che si traduce in acidità maggiore. Quindi, l’isomero B ha un valore di pKa inferiore rispetto all’isomero A.
LikeLike
il composto a destra è più acido perché i gruppi carbossilici dallo stesso lato (quindi in posizione cis) essendo più vicini stabilizzano la carica negativa della base coniugata per via delle più favorevoli interazioni e delle repulsioni steriche
LikeLike
il composto B è più acido perchè è più facile dissociare un protone in quanto c’è meno forza repulsiva tra i due gruppi OH quindi la base coniugata è più stabile. Il composto A ha una base coniugata meno stabile prchè i gruppi carbossilici sono più vicini e quindi c’è una maggiore repulsione elettronica
LikeLike
La diversa forza acida osservata nei due composti dipende dalla minor distanza dei due OH nel secondo composto, che essendo entrambi più vicini al carbonio che lega l’idrogeno, tendono ad attrarre di più elettroni di legame e dunque ad aumentare la forza acida del composto
LikeLike
Anita Piscitelli
A36004586
La differenza di acidità tra i due isomeri è dovuta alla diversa disposizione dei gruppi carbossilici. Nel secondo composto abbiamo una struttura ciclica che favorisce la stabilizzazione della carica negativa per delocalizzazione, quindi la base coniugata è più stabile e di conseguenza l’acido più forte. Nel primo composto questa stabilizzazione è meno efficace, dunque avrà acidità minore .
LikeLike
L’isomero di struttura B, avendo pKa più basso sarà più acido rispetto A. Ciò potrebbe essere dato dalla struttura dell’isomero B, che a causa della forza elettronegativa che l’ossigeno legato con un doppio legame esercita (quello più a sinistra, tra i due gruppi -OH), seppur non forma un legame diretto con l’OH (stavolta quello più a destra) può spostare, per effetto induttivo elettron attrattore, le cariche che si distribuiscono più equamente e quindi stabilizzano la base.
A36004735
LikeLike
I composti mostrati sono l’acido maleico e l’acido fumarico. L’acido maleico ha un pKa maggiore rispetto all’altro acido, il che indica che è meno acido.
L’acido fumarico ha una struttura ciclica e rigida che consente la delocalizzazione della carica negativa attraverso la risonanza dopo la deprotonazione,stabilizzando la base coniugata. Nell’acido maleico la mancanza di una struttura ciclica non permette una stabilizzazione altrettanto efficace.
Nell’acido maleico, i due gruppi -COOH sono vicini e possono formare un legame idrogeno intra molecolare. Questo legame riduce la tendenza alla deprotonazione perché stabilizza la molecola neutra, riducendo la disponibilità del protone. Nell’acido fumarico, i gruppi -COOH sono posizionati lontani uno dall’altro, quindi non c’è legame idrogeno intra molecolare il che facilita la deprotonazione e aumenta l’acidità
A36004294
LikeLike
Il composto B è più acido rispetto al composto A. Questo è osservabile dai valori della pKa. In entrambe le strutture abbiamo sia l’effetto induttivo elettron-attrattore sia il fenomeno della risonanza. Tuttavia, il composto B risulta essere più acido perché, essendoci una struttura ciclica, i due gruppi carbossilici sono posti più vicini e quindi influenzano maggiormente l’effetto elettron- attrattore che si propaga attraverso i legami.
A36004733
LikeLike
Nelle catene lineari, la carica negativa può essere delocalizzata più efficacemente lungo la catena, aumentando la stabilità della specie ionica. In una struttura più chiusa o ciclica, questa delocalizzazione viene limitata, rendendo la specie ionica (base) meno stabile e quindi aumentando il pKa (acido più forte).
LikeLike
Il composto B è più acido rispetto al composto A. Questo è osservabile dai valori della pKa. In entrambe le strutture abbiamo sia l’effetto induttivo elettron-attrattore sia il fenomeno della risonanza. Tuttavia, il composto B risulta essere più acido perché, essendoci una struttura ciclica, i due gruppi carbossilici sono posti più vicini e quindi influenzano maggiormente l’effetto elettron- attrattore che si propaga attraverso i legami.
A36004733
LikeLike
A causa della conformazione geometrica del secondo composto, l’ossigeno risulta essere molto più vicino al gruppo OH (che durante la reazione sarà quello che andrà a donare il protone H+). In questo modo grazie all’effetto elettron-attrattore prodotto dall’ossigeno (che nel secondo caso è più forte a causa della vicinanza) gli elettroni saranno meglio distribuiti e la base coniugata risulterà più stabile nel secondo caso piuttosto che nel primo, di conseguenza si avrà una maggiore acidità.
A36004706
LikeLike
Il composto B è più acido rispetto al composto A. Questo è osservabile dai valori della pKa. In entrambe le strutture abbiamo sia l’effetto induttivo elettron-attrattore sia il fenomeno della risonanza. Tuttavia, il composto B risulta essere più acido perché, essendoci una struttura ciclica, i due gruppi carbossilici sono posti più vicini e quindi influenzano maggiormente l’effetto elettron- attrattore che si propaga attraverso i legami.
A36004733
LikeLike
Innanzitutto notiamo che il composto B ha un valore minore di pKa, di conseguenza esso sarà più acido rispetto al composto A. Questa diversa acidità è dovuta all’effetto induttivo elettron-attrattore, il quale diminuisce man mano che la distanza tra il sostituente e l’atomo che perde l’idrogeno aumenta. In particolare, osservando le strutture, notiamo che nel composto A i gruppi -COOH sono più lontani tra loro, di conseguenza l’effetto induttivo elettron-attrattore sarà minore ed il composto sarà meno acido; invece nel composto B i gruppi -COOH sono più vicini tra loro, per cui il composto avrà una maggiore acidità.
LikeLike
Il composto B è più acido rispetto al composto A. Questo è osservabile dai valori della pKa. In entrambe le strutture abbiamo sia l’effetto induttivo elettron-attrattore sia il fenomeno della risonanza. Tuttavia, il composto B risulta essere più acido perché, essendoci una struttura ciclica, i due gruppi carbossilici sono posti più vicini e quindi influenzano maggiormente l’effetto elettron- attrattore che si propaga attraverso i legami.
A36004733
LikeLike
Il composto B risulta essere più acido poiché la sua struttura permette maggiormente di risentire dell’effetto induttivo elettron-attrattore poiché i due gruppi carbossilici risultano essere più vicini tra loro. Inoltre anche la risonanza gioca un ruolo importante che è anch’essa più accentuata nel composto B grazie alla sua struttura diversa da quella A che invece è lineare.
LikeLike
Innanzitutto notiamo che il composto B ha un valore minore di pKa, di conseguenza esso sarà più acido rispetto al composto A. Questa diversa acidità è dovuta all’effetto induttivo elettron-attrattore, il quale diminuisce man mano che la distanza tra il sostituente e l’atomo che perde l’idrogeno aumenta. In particolare, osservando le strutture, notiamo che nel composto A i gruppi -COOH sono più lontani tra loro, di conseguenza l’effetto induttivo elettron-attrattore sarà minore ed il composto sarà meno acido; invece nel composto B i gruppi -COOH sono più vicini tra loro, per cui il composto avrà una maggiore acidità.
LikeLike
L’isomero di struttura B è più acido rispetto all’isomero di struttura A poiché presenta un valore di pka minore. Ciò può essere anche spiegato dalla diversa disposizione dei gruppi carbossilici: poiché nell’isomero B c’è minor vicinanza dei gruppi carbossilici, che invece nell’isomero A è maggiore. Così che l’ossigeno legato con doppio legame, del gruppo carbossilico, mediante l’effetto induttivo elettron-attrattore attiri maggiormente le cariche a sé, stabilizzando la base coniugata; poiché più è stabile la base coniugata e più è forte l’acido.
LikeLike
A causa della conformazione geometrica del secondo composto, l’ossigeno risulta essere molto più vicino al gruppo OH (che durante la reazione sarà quello che andrà a donare il protone H+). In questo modo grazie all’effetto induttivo elettron-attrattore prodotto dall’ossigeno (che nel secondo caso è più forte a causa della vicinanza) gli elettroni saranno meglio distribuiti e la base coniugata risulterà più stabile nel secondo caso piuttosto che nel primo, di conseguenza si avrà una maggiore acidità. A36004706
LikeLike
I composti mostrati sono l’acido maleico (A) e l’acido fumarico (B).
L’acido maleico ha un valore di pKa maggiore rispetto all’acido fumarico, il che indica che è meno acido. Questo può essere spiegato considerando:
1. Struttura e Stabilità della Base
Coniugata: L’acido fumarico (B) ha una struttura ciclica e rigida che consente la delocalizzazione della carica negativa
attraverso la risonanza dopo la deprotonazione, stabilizzando la ba coniugata. Nell’acido maleico (A), li mancanza di una struttura ciclica non permette una stabilizzazione altrettanto efficace.
2 interazione tra i gruppi carbossilici: Nell’acido maleico i due gruppi
-COOH sono vicini e possono formare un legame idrogeno intramolecolare.
Questo legame intramolecolare riduce la tendenza alla deprotonazione perché stabilizza la molecola neutra, riducendo la disponibilità del protone.
Nell’acido fumarico, i gruppi -COOH sono posizionati lontani l’uno dall’altro, quindi non c’è legame idrogeno intramolecolare, il che facilita la deprotonazione e aumenta l’acidità.
LikeLike
A36004294
LikeLike
Le due strutture hanno molte caratteristiche in comune, tra cui la presenza di 2 gruppi carbossilici che aumentano l’acidità del composto per l’effetto induttivo elettron attrattore, e poi presentano entrambe un doppio legame nella stessa posizione. A differenziare il composto però, e quindi rendere il B più acido è la geometria della molecola, poiché i gruppi carbossilici saranno posizionati più vicini e quindi aumenterà la delocalizzazione elettronica per via della “parziale forma ciclica”
A36004406
LikeLike
DANIELA CAPEZZUTO
I due isomeri avranno diversa forza acida, poiché nell’isomero B il gruppo OH è più vicino al doppio legame e di conseguenza avrà un pKa minore, mentre il composto A avrà pKa maggiore perché il gruppo OH si trova più distante dal doppio legame andando a rendere meno efficace la stabilizzazione della base coniugata.
LikeLike
L’isomero B è più acido perché i due gruppi carbossilici sono più vicini tra di loro, questo significa che gli elettroni sono ancora più delocalizzati nella molecola rendendo la base coniugata ancora più stabile dell’isomero A. Inoltre credo sia possibile anche un legame idrogeno tra l’ossigeno e l’idrogeno dei due gruppi carbossilici riducendo l’energia complessiva della molecola (andando a ridurre ancor di più la densità elettronica).
LikeLike
Osservando la base coniugata del composto B(in cui viene allontanato l’idrogeno più acido,ovvero quello legato all’ossigeno di destra) ci si rende conto che la maggiore vicinanza tra l’ossigeno carico negativamente e l’ossigeno elettronegativo del doppio legame dell’altro acido carbossilico(sommato alla vicinanza con il proprio) faccia sì che il composto B sia il più acido,poiché grazie a questo effetto induttivo elettron attrattore tutta la densità appartenente all’ossigeno carico negativamente diminuisce,rendendo la base coniugata più debole,e di conseguenza più stabile.
LikeLike
francescapia liguori+
i due isomeri geometrici che hanno stessa struttura possono avere pka diverso per vari fattori. i sostituenti come il gruppo carbonile elettron-attrattore può stabilizzare la carica negativa dell’ossigeno, abbassando cosi il pka e aumentando l’acidità. in oltre anche l’orientamento delle molecole può influenzare la forza acida di una sostanza. quindi possiamo dedurre che B avendo i gruppi carbossilici in cis vanno a stabilizzare la carica negativa della base coniugata
LikeLike
francescapia liguori+
i due isomeri geometrici che hanno stessa struttura possono avere pka diverso per vari fattori. i sostituenti come il gruppo carbonile elettron-attrattore può stabilizzare la carica negativa dell’ossigeno, abbassando cosi il pka e aumentando l’acidità. in oltre anche l’orientamento delle molecole può influenzare la forza acida di una sostanza. quindi possiamo dedurre che B avendo i gruppi carbossilici in cis vanno a stabilizzare la carica negativa della base coniugata
LikeLike
la geometria molecolare può influenzare, a causa della loro struttura, la distribuzione dell’elettronegatività, l’interazione con l’ambiente circostante e la stabilità della base coniugata. La principale ragione può essere l’effetto elettronico: la posizione dei gruppi elettron-donatore o elettrone-attratore può variare in base ai due isomeri.
LikeLike
Sebbene i due isomeri abbiano gli stessi gruppi carbossilici, nell’isomero B essi sono più vicini poiché si tratta di una struttura ciclica e quindi, per risonanza, la base coniugata viene stabilizzata ed è più debole, di conseguenza l’isomero B presenterà un Pka inferiore e acidità maggiore.
Katia Munno
A36004778
LikeLike
L’isomero Cis sarà più acido poiché, dopo la deprotonazione, la carica negativa sull’ossigena viene delocalizzata sia sul gruppo carbonile (come avviene anche con l’altro isomero) sia dal legame a idrogeno che si forma con il gruppo OH dell’altro gruppo carbossilico (quasi come se si formasse un ciclo a 6 termini stabilizzato anche dalla risonanza dei doppi legami).
LikeLike
Il compartimento b è più acido data la geometria della molecola della base coniugata . È come se ci fossero in ( A) due “ dipoli “ opposti che si annullano a vicenda . Ció non si verifica nella struttura della base coniugata del composto B, in cui i due dipoli si sommano senza annullarsi .
In pratica la maggiore acidità di B risiede nel suo momento dipolare diverso da 0.
LikeLike
Il compartimento b è più acido data la geometria della molecola della base coniugata . È come se ci fossero in ( A) due “ dipoli “ opposti che si annullano a vicenda . Ció non si verifica nella struttura della base coniugata del composto B, in cui i due dipoli si sommano senza annullarsi .
In pratica la maggiore acidità di B risiede nel suo momento dipolare diverso da 0.
LikeLike
Nel composto A, i due gruppi carbossilici sono lontani tra loro. Proprio per questo motivo non c’è possibilità di stabilizzare. Il secondo composto B é più acido perché i gruppi carbossilici sono vicini tra loro e possono interagire. Quindi una miglior stabilizzazione della carica negativa facilita la deprotonazione, rendendo il composto più acido
LikeLike
Nel composto A, i due gruppi carbossilici sono lontani tra di loro. Proprio per questo motivo non c’è possibilità di stabilizzare. il secondo composto è più acido perché i gruppi carbossilici sono vicini tra loro e possono interagire. Quindi una miglior stabilizzazione della carica negativa facilita la deprotonazione, rendendo il composto più acido
LikeLike
La differenza nei valori di pKa per i due composti mostrati può essere spiegata in termini di stabilizzazione della forma deprotonata e degli effetti elettronici che influenzano la forza acida. Il composto A ha un pKa1 di 3.03, l’assenza di una delocalizzazione di carica limita la stabilizzazione dell’anione che si forma dopo la deprotonazione. Il composto B, invece, ha un valore di pKa1 più basso, di 1.90, questo sta ad indicare che il composto è più acido rispetto al composto A. La maggiore acidità può essere anche attribuita alla coniugazione con il doppio legame C=C. Quando avviene la deprotonazione, la carica negativa risultante può essere delocalizzata attraverso il sistema π del doppio legame, stabilizzando l’anione e rendendo il processo di deprotonazione più favorevole. Quindi, la maggiore acidità del composto B rispetto al composto A è dovuta alla coniugazione con il doppio legame, che stabilizza la forma deprotonata e rende più facile la deprotonazione; essendo la base più stabile e quindi più debole, l’acido risulterà essere più forte.
LikeLike
La differenza principale che spiega la variazione nei valori di pKa, e quindi nella forza acida, di questi due acidi è legata:
Quindi, la diversa forza acida tra l’isomero A e B può essere spiegata dalle interazioni intramolecolari e l’effetto di risonanza che contribuiscono a stabilizzare la forma deprotonata dell’isomero B più efficacemente rispetto a quella dell’isomero A, portando a un valore di pKa1 inferiore per l’isomero B.
LikeLike
Il compartimento b è più acido data la geometria della molecola della base coniugata . È come se ci fossero in ( A) due “ dipoli “ opposti che si annullano a vicenda . Ció non si verifica nella struttura della base coniugata del composto B, in cui i due dipoli si sommano senza annullarsi .
In pratica la maggiore acidità di B risiede nel suo momento dipolare diverso da 0.
LikeLike
L’isomero Cis sarà più acido poiché, dopo la deprotonazione, la carica negativa sull’ossigena viene delocalizzata sia sul gruppo carbonile (come avviene anche con l’altro isomero) sia dal legame a idrogeno che si forma con il gruppo OH dell’altro gruppo carbossilico (quasi come se si formasse un ciclo a 6 termini stabilizzato anche dalla risonanza dei doppi legami).
LikeLike
Il compartimento b è più acido data la geometria della molecola della base coniugata . È come se ci fossero in ( A) due “ dipoli “ opposti che si annullano a vicenda . Ció non si verifica nella struttura della base coniugata del composto B, in cui i due dipoli si sommano senza annullarsi .
In pratica la maggiore acidità di B risiede nel suo momento dipolare diverso da 0.
LikeLike
A causa della conformazione geometrica del secondo composto, l’ossigeno risulta essere molto più vicino al gruppo OH (che durante la reazione sarà quello che andrà a donare il protone H+). In questo modo grazie all’effetto elettron-attrattore prodotto dall’ossigeno (che nel secondo caso è più forte a causa della vicinanza) gli elettroni saranno meglio distribuiti e la base coniugata risulterà più stabile nel secondo caso piuttosto che nel primo, di conseguenza si avrà una maggiore acidità. A36004706
LikeLike
Il compartimento b è più acido data la geometria della molecola della base coniugata . È come se ci fossero in ( A) due “ dipoli “ opposti che si annullano a vicenda . Ció non si verifica nella struttura della base coniugata del composto B, in cui i due dipoli si sommano senza annullarsi .
In pratica la maggiore acidità di B risiede nel suo momento dipolare diverso da 0.
Inviato da Outlook per iOShttps://aka.ms/o0ukef
LikeLike
Il compartimento b è più acido data la geometria della molecola della base coniugata . È come se ci fossero in ( A) due “ dipoli “ opposti che si annullano a vicenda . Ció non si verifica nella struttura della base coniugata del composto B, in cui i due dipoli si sommano senza annullarsi .
In pratica la maggiore acidità di B risiede nel suo momento dipolare diverso da 0.
Immacolata Petrillo
A36004426
LikeLike
Osservando i due isomeri, è possibile andare a decretare il più forte in termini di acidità.
Innanzitutto, l’isomero B presenterà un PK minore rispetto a quello di A. Questo è riconducibile al fatto che nell’isomero B i due gruppi carbossilici saranno più vicini tra di loro permettendo maggiori interazioni. Ciò comporterà una maggiore stabilità della forma deprotonata.
Nell’isomero A i due gruppi carbossilici sono più distanti, il che riduce l’effetto dell’interazione intramolecolari.
In entrambi gli isomeri è presente la risonanza, anche se l’isomero B, a causa della sua forma ciclica, permetterà una maggiore delocalizzazione elettronica. Questo porterà ad una forma deprotonata più stabile, che dunque sarà la base coniugata dell’acido più forte.
LikeLike
Osservando i due isomeri, è possibile andare a decretare il più forte in termini di acidità.
Innanzitutto, l’isomero B presenterà un PK minore rispetto a quello di A. Questo è riconducibile al fatto che nell’isomero B i due gruppi carbossilici saranno più vicini tra di loro permettendo maggiori interazioni. Ciò comporterà una maggiore stabilità della forma deprotonata.
Nell’isomero A i due gruppi carbossilici sono più distanti, il che riduce l’effetto dell’interazione intramolecolari.
In entrambi gli isomeri è presente la risonanza, anche se l’isomero B, a causa della sua forma ciclica, permetterà una maggiore delocalizzazione elettronica. Questo porterà ad una forma deprotonata più stabile, che dunque sarà la base coniugata dell’acido più forte.
LikeLike
Osservando i due isomeri, è possibile andare a decretare il più forte in termini di acidità.
Innanzitutto, l’isomero B presenterà un PK minore rispetto a quello di A. Questo è riconducibile al fatto che nell’isomero B i due gruppi carbossilici saranno più vicini tra di loro permettendo maggiori interazioni. Ciò comporterà una maggiore stabilità della forma deprotonata.
Nell’isomero A i due gruppi carbossilici sono più distanti, il che riduce l’effetto dell’interazione intramolecolari.
In entrambi gli isomeri è presente la risonanza, anche se l’isomero B, a causa della sua forma ciclica, permetterà una maggiore delocalizzazione elettronica. Questo porterà ad una forma deprotonata più stabile, che dunque sarà la base coniugata dell’acido più forte.
LikeLike
Osservando i due isomeri, è possibile andare a decretare il più forte in termini di acidità.
Innanzitutto, l’isomero B presenterà un PK minore rispetto a quello di A. Questo è riconducibile al fatto che nell’isomero B i due gruppi carbossilici saranno più vicini tra di loro permettendo maggiori interazioni. Ciò comporterà una maggiore stabilità della forma deprotonata.
Nell’isomero A i due gruppi carbossilici sono più distanti, il che riduce l’effetto dell’interazione intramolecolari.
In entrambi gli isomeri è presente la risonanza, anche se l’isomero B, a causa della sua forma ciclica, permetterà una maggiore delocalizzazione elettronica. Questo porterà ad una forma deprotonata più stabile, che dunque sarà la base coniugata dell’acido più forte.
LikeLike
La differente forza acida tra i due isomeri è dovuta alla disposizione dei due gruppi carbossilici i quali si presentano posti in posizioni diverse tra i due composti. L’isomero B presenta forza più acida rispetto all’isomero A poiché i gruppi carbossilici sono più vicini tra loro e favoriscono così un maggior effetto induttivo elettron-attrattore facendo diminuire così il valore di pka e aumentando di conseguenza l’acidità . Cosa che invece nel composto A non avviene , dato che i due gruppi carbossilici sono posti a maggiore distanza tra loro , presentando un pka maggiore avranno bassa acidità.
LikeLike
Il secondo composto è quello che sarà più acido, dal momento in cui il suo valore di pka1 più basso ci va ad indicare che l’acido si dissocia più facilmente rilasciando protoni in soluzione, inoltre la disposizione dei gruppi carbossilici hanno una posizione strategica, essendo che sono molto più vicini tra loro l’effetto induttivo elettron-attrattore riesce a influenzare l’intera struttura rendendola così più acida
LikeLike
A36004049
LikeLike
Nel secondo composto, la presenza di una struttura ciclica permette una maggiore stabilizzazione della carica negativa grazie alla delocalizzazione, rendendo la base coniugata più stabile e, di conseguenza, l’acido più forte. Nel primo composto, invece, la stabilizzazione risulta meno efficace, comportando una minore acidità.
A36004712
LikeLike
Nel secondo composto, la presenza di una struttura ciclica permette una maggiore stabilizzazione della carica negativa grazie alla delocalizzazione, rendendo la base coniugata più stabile e, di conseguenza, l’acido più forte. Nel primo composto, invece, la stabilizzazione risulta meno efficace, comportando una minore acidità.
A36004712
LikeLike
Il composto B ha un valore di pKa minore del valore di pKa del composto A e ciò significa che ha un’acidità maggiore. Le basi coniugate di entrambi i composti sono stabilizzate dalle strutture di risonanza e dall’effetto induttivo elettron-attrattore degli atomi di ossigeno, con la differenza che nel composto B l’ossigeno che viene deprotonato è più vicino agli atomi di ossigeno che attuano l’effetto induttivo elettron-attrattore. Tali atomi, grazie alla loro elettronegativi, attirano maggiormente gli elettroni di legame e diminuiscono la densità elettronica dell’ossigeno con carica negativa (dopo essere stato deprotonato l’ossigeno assume carica negativa) rendendo la base coniugata ottenuta più stabile e più debole. Ne consegue che l’acido coniugato, il composto B, è più forte.
Michela Petruccelli, A36004785
LikeLike
I due composti hanno diversa forza acida, in particolare il composto B, avendo un pKa inferiore, è più acido del composto A. I gruppi carbossilici nel composto B sono disposti ad una minore distanza. Questo aumenta l’effetto induttivo elettron-attrattore dell’atomo di ossigeno del gruppo carbossilico rendendo la base coniugata più stabile e quindi l’acido più forte.
A36004814
LikeLike
Nel caso dell’isomero A, i due gruppi carbossilici sono abbastanza distanti. Ciò comporta che si stabiliscano gravitazioni, e in realtà, non c’è molta stabilizzazione interna. Di conseguenza, quando perde un protone, la molecola non riesce a stabilizzarsi bene. Il pKa aumenta e l’acido diventa più debole. Tuttavia, nell’isomero B, i gruppi carbossilici sono molto più vicini. La carica negativa si delocalizza e, cosa importante, aiuta a distribuirsi su 2 gruppi. Di conseguenza, la molecola è più stabile dopo aver perso il protone, il pKa scende e l’acido è più forte. Ecco perché l’isomero B è più acido dell’isomero A.
A36004797
LikeLike