Weekend Organic Chemistry Challenge

Regolamento:
- Vincerà la sfida chi risponderà per primo CORRETTAMENTE al seguente quesito
- La risposta dovrà essere inserita come commento al post (non saranno prese in considerazione risposte inviate via email). NB: è necessario utilizzare nome e cognome per essere identificati.
- Ognuno può rispondere solo una volta (anche in presenza di più di un commento pubblicato dalla stessa persona, soltanto il primo sarà preso in considerazione).
- Il tempo massimo a disposizione sarà di 24h dalla pubblicazione del post.
- Il vincitore (2 punti) sarà annunciato lunedì a lezione.
Anche questa settimana siamo alle prese con due isomeri geometrici (parleremo a breve di questo tipo di isomeria). Si tratta di composti diversi, in quanto, intorno al doppio legame non è possibile libera rotazione. Pur avendo entrambi due gruppi carbossilici e, la maggior parte delle caratteristiche strutturali in comune, essi sono caratterizzati da valori di pKa1 diversi (i valori sono riportati in figura). Fornire una spiegazione della diversa forza acida osservata per i due composti.
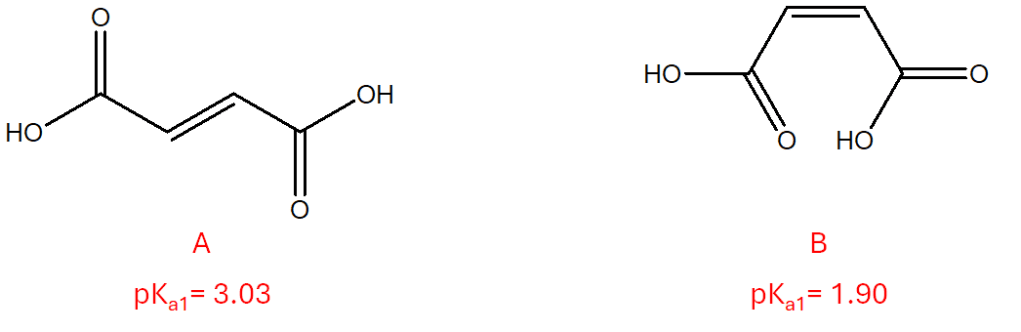
Nell’isomero A, i due gruppi carbossilici sono così distanti l’uno dall’altro che la molecola non può avvalersi della stabilizzazione interna. Pertanto, quando perde un protone, non può delocalizzare la carica negativa e quindi non è altrettanto stabile. Il pKa è quindi più alto, il che significa un acido più debole. Tuttavia, nell’isomero B, i gruppi carbossilici sono molto più vicini e la carica negativa può essere delocalizzata tra i due, il che garantisce una maggiore stabilità dopo la perdita di un protone. Ciò determina un pKa più basso e un acido molto più forte rispetto all’isomero A.
A36004760
LikeLike
Nell’isomero A, i due gruppi carbossilici sono così distanti l’uno dall’altro che la molecola non può avvalersi della stabilizzazione interna. Pertanto, quando perde un protone, non può delocalizzare la carica negativa e quindi non è altrettanto stabile. Il pKa è quindi più alto, il che significa un acido più debole. Tuttavia, nell’isomero B, i gruppi carbossilici sono molto più vicini e la carica negativa può essere delocalizzata tra i due, il che garantisce una maggiore stabilità dopo la perdita di un protone. Ciò determina un pKa più basso e un acido molto più forte rispetto all’isomero A.
A36004760
LikeLike
Nell’isomero A, i due gruppi carbossilici sono così distanti l’uno dall’altro che la molecola non può avvalersi della stabilizzazione interna. Pertanto, quando perde un protone, non può delocalizzare la carica negativa e quindi non è altrettanto stabile. Il pKa è quindi più alto, il che significa un acido più debole. Tuttavia, nell’isomero B, i gruppi carbossilici sono molto più vicini e la carica negativa può essere delocalizzata tra i due, il che garantisce una maggiore stabilità dopo la perdita di un protone. Ciò determina un pKa più basso e un acido molto più forte rispetto all’isomero A.
Giuliano Sarnataro
A36004760
giuliano.sarnataro@studenti.unicampania.it
LikeLike
Domani scopriremo SE qualcuno ha vinto, e nel caso chi è la persona in questione.
Però precisiamo subito alcune cose. Cominciamo dagli orrori:
pKa è il logaritmo negativo della costante di dissociazione acida. PKa NON SIGNIFICA NULLA! Mentre PKA è l’acronimo di un aeroporto in Alaska.
Seguono delle importanti precisazioni:
1) L’effetto induttivo elettron-attrattore è dovuto all’attrazione degli elettroni da parte di un atomo elettronegativo attraverso legami sigma (nelle due molecole, tutti gli atomi relativamente elettronegativi sono alla stessa distanza in A e B, in termini di legami, dal sito che porterà la carica negativa, per cui non può essere questo un fattore determinante). La vicinanza spaziale, non mediata da legami, non è rilevante in tal senso.
2) La risonanza implica un riarrangiamento degli elettroni, ma anche in questo caso, avviene tra atomi che sono legati tra loro.
3) dei due composti in questione A è l’acido fumarico e B è l’acido maleico (qualcuno li ha confusi, ma in ogni caso, questa informazione non è rilevante e non vi era stata richiesta).
4) Quando parlate di interazioni, a che interazioni vi riferite? Dovreste essere più precisi ed identificare sempre il tipo di interazione.
Infine, alcune precisazioni tecniche:
1) Nella risposta alla challenge, sarebbe meglio (anche per essere più veloci), non ripetere cose ovvie già definite nella traccia, se non sono essenziali a far capire il ragionamento.
2) A proposito di ragionamento: lo scopo della challenge non è tanto quello di raccogliere punti per le prove intercorso, ma piuttosto quello di aprire la mente e provare, non solo ad applicare ciò che stiamo imparando durante il corso (o ciò che dovreste già sapere), ma soprattutto a mettere in atto le vostre capacità logiche e di ragionamento. Per cui, se da un lato anche il fatto di cercare di documentarsi sui libri, online o chiedendo a colleghi più esperti non sia affatto negativo, vi invito per le prossime challenge a fare leva solo sulle vostre capacità. Stesso discorso per l’utilizzo dell’AI (ChatGPT e simili): non solo risposte prodotte da questi strumenti sono facilmente identificabili (NB: spesso sono anche errate), ma vanificano lo scopo stesso della challenge.
LikeLike