Weekend Organic Chemistry Challenge

Regolamento:
- Vincerà la sfida chi risponderà per primo CORRETTAMENTE al seguente quesito
- La risposta dovrà essere inserita come commento al post (non saranno prese in considerazione risposte inviate via email)
- Ognuno può rispondere solo una volta (anche in presenza di più di un commento pubblicato dalla stessa persona, soltanto il primo sarà preso in considerazione).
- Il tempo massimo a disposizione sarà di 24h dalla pubblicazione del post.
- Il vincitore (2 punti) sarà annunciato lunedì a lezione.
I seguenti composti sono caratterizzati dalla stessa formula molecolare, ma da strutture diverse (vedremo a breve che parliamo, in questo caso, di isomeri): nella prima, i due atomi di idrogeno legati ai carboni si trovano dallo stesso lato rispetto al doppio legame, nella seconda si trovano da lati opposti.

Si tratta di composti diversi, in quanto, intorno al doppio legame non è possibile libera rotazione.
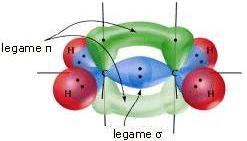
Però, l’assorbimento di luce può portare all’interconversione dei due isomeri. Sapendo che l’assorbimento di luce di una determinata lunghezza d’onda da parte del doppio legame porta all’eccitazione di un elettrone dall’orbitale molecolare π (pi-greco) all’orbitale π*, spiegare perchè questo assorbimento può portare all’interconversione dei due isomeri.
L’elettrone è temporaneamente eccitato quindi il legame pi greco diventa instabile nell’istante in cui l’elettrone deve passare verso il legame pi greco*. In quel momento quindi il legame può ruotare e il cloro assume la seconda posizione del secondo isomero.
A36004735
LikeLike
A seguito dell’assorbimento di luce, l’elettrone acquisisce energia e può passare temporaneamente nell’orbitale di antilegame pigreco* per iperconiugazione, ossia la temporanea sovrapposizione tra un orbitale di legame e uno di antilegame, che si verifica quando questi sono paralleli tra loro.
LikeLike
Quando l’energia della luce colpisce una molecola gli elettroni di legame (come in questo caso pi greco) sono temporaneamente spostati all’orbitale di antilegame che è a maggiore energia (dato che sono gli unici orbitali disponibili a maggiore energia) però questo rende la molecola instabile perché l’antilegame è di tipo distruttivo e questa instabilità porta alla rottura temporea dei legami di tipo pi greco permettendo questa molecola di ruotare.
LikeLike
Nel doppio legame una coppia di elettroni forma un legame sigma attraverso la sovrapposizione assiale degli orbitali, l’altra coppia di elettroni forma invece un legame pi greco attraverso la sovrapposizione laterale degli orbitali. In particolare il legame sigma è simmetrico rispetto al proprio asse, dunque è libero di ruotare attorno ad esso senza alterare il legame; invece il legame pi greco, a causa della sovrapposizione laterale, non è in grado di ruotare perché altrimenti spezzerebbe il legame.
Con l’assorbimento di luce il doppio legame si indebolisce al punto tale da permettere la rotazione, senza però spezzarsi. Grazie a questo abbiamo l’interconversione dei due isomeri
LikeLike
Anita Piscitelli
L’assorbimento della luce indebolisce il doppio legame, perché l’elettrone passa dall’orbitale pi greco ( orbitale di legame) all’’orbitale pi greco * ( orbitale di anti-legame), quindi il doppio legame tra i due atomi di carbonio viene indebolito e questo permette la rotazione intorno al doppio legame.
LikeLike
Normalmente sappiamo che il doppio legame è molto rigido e non permette libera rotazione degli atomi attorno all’asse ;quindi,dal momento in cui esso assorbe luce e un elettrone viene eccitato passando dal legame pigreco al pigreco star,il legame pigreco perde temporaneamente la sua rigidità (c’è perdita di densità elettronica,la quale serviva a mantenere ben saldi i due atomi di carbonio)per permettere la libera rotazione degli atomi attorno all’asse e per far sì che gli isomeri si interconvertano.
LikeLike
francescapia liguori
Quando i composti C = C assorbono la luce, gli elettroni negli orbitali π vengono eccitati verso gli orbitali π*. Questo processo consente di facilitare il passaggio degli isomeri geometrici l’uno dall’altro. Negli isomeri cis, tutti i gruppi ingombranti si trovano nello stesso lato del doppio legame, mentre nei trans, i gruppi si trovano dall’altra parte del doppio legame, creando una “barriera” energetica. Dopo che il fotone è stato assorbito, si crea uno stato eccitato, che consente una “flessibilità” geometrica. Così attraversando l’energia, gli isomeri possono “salire” attraverso questa barriera.
LikeLike
francescapia liguori
Quando i composti C = C assorbono la luce, gli elettroni negli orbitali π vengono eccitati verso gli orbitali π*. Questo processo consente di facilitare il passaggio degli isomeri geometrici l’uno dall’altro. Negli isomeri cis, tutti i gruppi ingombranti si trovano nello stesso lato del doppio legame, mentre nei trans, i gruppi si trovano dall’altra parte del doppio legame, creando una “barriera” energetica. Dopo che il fotone è stato assorbito, si crea uno stato eccitato, che consente una “flessibilità” geometrica. Così attraversando l’energia, gli isomeri possono “salire” attraverso questa barriera.
LikeLike
L’interconversione dei due isomeri è stata causata dalla rottura del doppio legame, in particolare del legame pi-greco. Il legame pi-greco, infatti, si è rotto a causa dell’eccitazione del suo elettrone.
LikeLike
L’interconversione dei due isomeri è possibile perché ad una certa lunghezza d’onda viene eccitato un elettrone dall’orbitale pi greco a quello dell’orbitale pi greco *, questo provoca una diminuzione della rigidità del doppio legame portando quindi alla rotazione intorno al legame stesso, convertendo quindi, l’isomero di destra in quello di sinistra e viceversa
LikeLike
L’interconversione tra gli isomeri avviene perchè l’energia sotto forma di luce rompe il legame pi greco permettendo una rotazione intorno al legame sigma,il quale è più stabile.
A36004712
LikeLike
Quando i composti C = C assorbono la luce, gli elettroni negli orbitali π vengono eccitati verso gli orbitali π*. Questo processo consente di facilitare il passaggio degli isomeri geometrici l’uno dall’altro. Negli isomeri cis, tutti i gruppi ingombranti si trovano nello stesso lato del doppio legame, mentre nei trans, i gruppi si trovano dall’altra parte del doppio legame, creando una “barriera” energetica. Dopo che il fotone è stato assorbito, si crea uno stato eccitato, che consente una “flessibilità” geometrica. Così attraversando l’energia, gli isomeri possono “salire” attraverso questa barriera.
LikeLike
Gaia Palladino
La luce fornisce l’energia per allontanare gli orbitali p che partecipano alla formazione del legame pigreco(il legame quindi si spezza ),perciò la molecola é libera di ruotare intorno al legame sigma (più forte) e di riformare un nuovo legame pigreco.La molecola si riassesta quindi nella sua forma più stabile.
LikeLike
Questo assorbimento può portare all’interconversione dei due isomeri perché questa transizione cambia temporaneamente la distribuzione elettronica nella molecola. In condizioni di eccitazione, il doppio legame può diventare più debole e la molecola può acquisire più energia di rotazione intorno ai legami singoli adiacenti. Se l’energia assorbita è sufficiente per superare la barriera di energia per la rotazione attorno ai legami singoli, il doppio legame può assistere a un riarrangiamento temporaneo in cui la molecola assume una configurazione transitoria che potrebbe permettere dunque la trasformazione da un isomero all’altro. Una volta che la molecola si è riorganizzata, può restituire energia e stabilizzarsi nella nuova conformazione, portando alla formazione dell’isomero alternativo.
LikeLike
Quando il doppio legame assorbe un fotone con la giusta lunghezza d’onda, un elettrone del legame pi greco viene eccitato dall’ orbitale pi greco all’ orbitale pi greco * Quando l’elettone si trova nell’ orbitale di anti legame pi greco la stabilità del legame diminuisce e questo riduce l’energia del legame pi greco provocando una parziale rottura del legame. Questo significa che il doppio legame perde temporaneamente la sua rigidità permettendo una rotazione attorno all’asse del legame C=C. In questo stato eccitato c’è una maggiore libertà di rotazione intorno al doppio legame. Durante questa fase la configurazione geometrica dei gruppi attorno al doppio legame può cambiare permettendo così il passaggio dall’isomero cis all’’isomero trans.
A36004294
LikeLike
.
LikeLiked by 1 person
quando la luce colpisce la molecola, passa l’energia ( sotto forma di calore) necessaria alla rottura del legame π ( essendo il più debole dei due). In questo modo si passa da una molecola con un doppio legame C-C a una molecola con un singolo legame C-C, così facendo i vari sostituenti posso ruotare liberamente intorno al legame singolo C-C.
LikeLike
In entrambe le strutture abbiamo la presenza di un doppio legame tra due atomi di carbonio. Questo doppio legame si è formato nel momento in cui un orbitale s si è combinato con due orbitali p formando 3 orbitali sp2 degeneri e un orbitale non ibrido. I 3 orbitali degeneri vengono utilizzati dal carbonio per formare il legame sigma e sigma star. L’orbitale p non ibrido di un atomo di C ha, invece, effettuato una sovrapposizione laterale insieme all’altro orbitale p non ibrido dell’altro atomo di carbonio andando a creare, in questo modo, il legame pigreco e il legame pigreco star. Il legame pigreco star è meno stabile rispetto al pigreco in quanto è caratterizzato da energia maggiore. Questo è il motivo per cui l’orbitale di antilegame non è occupato da elettroni.Se però viene fornita energia alla nostra struttura, ad esempio attraverso l’assorbimento di luce di una determinata lunghezza d’onda da parte del doppio legame, si verifica l’eccitazione di un elettrone dall’orbitale molecolare pi greco all’orbitale pi greco star. La presenza di un e- nell’orbitale di antilegame rende il doppio legame, e in particolar modo il legame pigreco, meno stabile. È come se il legame pigreco fosse stato indebolito, quasi rotto, dalla presenza di un e- eccitato nell’ orbitale molecolare pigreco star. Questa situazione porta all’interconversione.
LikeLike
l’elettrone è in uno Stato eccitato perché la luce comporta calore e quindi una certa quantità di energia, questo porta l’elettrone a passare in un orbitale superiore quindi permette l’antiversione dei due isomeri
LikeLike
In entrambe le strutture abbiamo la presenza di un doppio legame tra due atomi di carbonio. Questo doppio legame si è formato nel momento in cui un orbitale s si è combinato con due orbitali p formando 3 orbitali sp2 degeneri e un orbitale non ibrido. I 3 orbitali degeneri vengono utilizzati dal carbonio per formare il legame sigma e sigma star. L’orbitale p non ibrido di un atomo di C ha, invece, effettuato una sovrapposizione laterale insieme all’altro orbitale p non ibrido dell’altro atomo di carbonio andando a creare, in questo modo, il legame pigreco e il legame pigreco star. Il legame pigreco star è meno stabile rispetto al pigreco in quanto è caratterizzato da energia maggiore. Questo è il motivo per cui l’orbitale di antilegame non è occupato da elettroni.
Se però viene fornita energia alla nostra struttura, ad esempio attraverso l’assorbimento di luce di una determinata lunghezza d’onda da parte del doppio legame, si verifica l’eccitazione di un elettrone dall’orbitale molecolare pi greco all’orbitale pi greco star. La presenza di un e- nell’orbitale di antilegame rende il doppio legame, e in particolar modo il legame pigreco, meno stabile. È come se il legame pigreco fosse stato indebolito, quasi rotto, dalla presenza di un e- eccitato nell’ orbitale molecolare pigreco star. Questa situazione porta all’interconversione.
LikeLike
Fornendo abbastanza energia l’elettrone si eccita e avremo la rottura di un legame e la formazione di un nuovo legame. Il legame π si spezza in quanto gli orbitali che lo formano si disaccoppiano e avviene la rotazione della molecola intorno al legame σ, la quale ricerca una forma più stabile
LikeLike
L’elettrone eccitato può passare dall’orbitale Pi greco all’orbitale Pi greco star, quest’ultimo altamente instabile poiché ha energia maggiore, i legami singolo permettono rotazione e si passerà da un isomero Cis ad un isomero trans (più stabile grazie alle minori repulsioni steriche poiché i gruppi a maggiore priorità si troveranno più distanti tra loro).
LikeLike
Il concetto chiave di base da cui partire per risolvere la challenge è questo: “Si tratta di composti diversi, in quanto, intorno al doppio legame non è possibile libera rotazione.” La rotazione attorno al doppio legame si verifica solo in caso di rottura del legame pigreco. E quindi soltanto quando gli orbitali p non sono più paralleli. Fornendo energia sotto forma di luce o calore, in questo caso luce, gli elettroni di legame pigreco vengono eccitati e si spostano al legame pigreco star, che essendo però distruttivo, rende la molecola instabile. È proprio l’instabilità a portare alla rottura del legame pigreco che porterà quindi alla rotazione della molecola.
A36004339
LikeLike
L’assorbimento di una radiazione con una determinata lunghezza d’onda e quindi con una determinata energia puó comportare una transizione elettronica da un orbitale π di legame ad uno π * (pi greco star ) di antilegame.
Questo può comportare la temporanea rottura del legame π con possibile rotazione intorno al legame semplice alfa con conseguente intercorversione dei due isomeri geometrici .
Il doppio legame dopo la rotazione si riforma per emissione di energia dato che l’elettrone ritorna nell’orbitale π a più bassa energia .
LikeLike
Sappiamo che la rotazione del doppio legame si verifica in caso di rottura del legame “pi greco”. In tal caso, fornendo luce, gli elettroni di legame verranno eccitati e di conseguenza si sposteranno al legame “pi greco*” o di antilegame, rendendo in tal modo la molecola instabile e dunque ciò causerà interconversione da cis a trans della molecola.
LikeLike