Training VIII

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomenti, ma potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti. In fondo alla lista, troverete anche un’indicazione del livello di difficoltà delle domande.
- Descrivi il concetto di ibridazione sp³ nel carbonio e come influisce sulla geometria molecolare del metano.
- Spiega la differenza tra legami σ e π in termini di sovrapposizione degli orbitali.
- Spiega la differenza tra un carbocatione e un carbanione in termini di stabilità e struttura.
- A quale valore di pH la concentrazione di un composto con pKa= 6.5 sarà 100 volte maggiore in forma acida piuttosto che in forma basica?
- Quali sono le interazioni non covalenti che possono instaurarsi tra le molecole? In che modo ne influenzano le proprietà fisiche?
- Chi avrà punto di ebollizione maggiore tra il pentano, il 2-metilbutano e il 2,2-dimetilpropano? Spiegare perchè
- Perchè gli alcoli con peso molecolare più basso sono più solubili in acqua di quelli con peso molecolare maggiore?
- Illustra i diversi tipi di isomeria, fornendo degli esempi.
- Prendiamo in considerazione una struttura costituita da due cicloesani condensati (=decalina). Perchè i cicloesani con giunzione trans (=trans-decalina) sono più stabili di quelli con giunzione cis? Utilizzare le proiezioni di Newman per dimostrare quanto affermato. Inoltre, spiegare perchè nel caso della trans-decalina non è possibile l’inversione d’anello.
- Disegna il diagramma di energia potenziale relativo alla rotazione di 360° del legame C2-C3 del meso-2,3-diclorobutano (cioè di quello stereoisomero del 2,3-diclorobutano che è un composto meso) iniziando dal conformero meno stabile. Discutere di tutti i fattori che stabilizzano/destabilizzano le varie conformazioni.
Poi, fare lo stesso con uno dei diastereoisomerei del meso-2,3-diclorobutano. - Definisci un’unità stereogenica.
- A partire da un alchene, è possibile sintetizzare un alcol con diversi metodi. Illustra quelli studiati, confrontando tra loro i meccanismi e i prodotti di reazione.
- Tra i metodi sopra discussi, quale sceglieresti per sintetizzare il 3,3-dimetil-2-pentanolo a partire dal 3,3-dimetil-1-pentene?
- Alcheni e cicloalcani condividono la stessa formula generale. Immaginiamo di avere un composto di formula molecolare C6H12. Pur conoscendo la formula molecolare, non conosciamo la struttura. Potremmo sfruttare la reazione con Br2 in acqua per capire se siamo di fronte ad un alchene o ad un cicloalcano? Come?
- Spiega cosa si intende per reazione stereoselettiva e per reazione stereospecifica con esempi.
- Spiega la differenza tra una reazione di sostituzione nucleofila bimolecolare e una monomolecolare. Discuti le evidenze sperimentali a favore dell’uno e dell’altro meccanismo.
- Parla delle reazioni di sostituzione nucleofila degli eteri.
- Perchè il prodotto principale della reazione di disidratazone dell’1-butanolo è il 2-butene?
- In che modo è possibile sintetizzare un diolo cis a partire da un alchene? E un diolo trans? E un epossido? Come sintetizzeresti un epossido a partire da un’aloidrina?
- Confronta tra loro il meccanismo di apertura di un epossido in ambiente acido e in ambiente basico.
- Discuti le proprietà fisiche dei derivati degli acidi carbossilici.
- Quando un acido carbossilico viene dissolto in acqua marcata con l’isotopo dell’ossigeno 18O e viene aggiunto un catalizzatore acido, nel prodotto entrambi gli ossigeni risultano marcati (il che significa che entrambi gli 16O sono stati sostituiti da 18O). Proponi un meccanismo per spiegare l’osservazione sperimentale.
- Mostra il meccanismo di idrolisi acido-catalizzata del pentanoato di terz-butile.
- Il carbonio alfa di aldeidi e chetoni può essere alogenato in condizioni acide o basiche. Mostrare e confrontare tra loro i due meccanismi.
- Spiega il concetto di aromaticità e applicalo al caso del furano.
- Prendiamo in considerazione gli amminoacidi che non hanno gruppi ionizzabili in catena laterale: per questi amminoacidi, pur essendo i valori di pI molto vicini tra loro, come spieghiamo il fatto che il valore non è esattamente lo stesso per tutti?
- Se facciamo reagire l’acido 2-[(2S)-ciscloes-2-enil]acetico con bromo in diclorometano, otterremo un unico prodotto di formula molecolare C8H11BrO2 + HBr. Individuare la struttura del prodotto e proporre un meccanismo per la reazione. Infine, definire la stereochimica del prodotto ottenuto e determinare la configurazione dei carboni chirali.
- Come sintetizzeresti il 3-metilcicloes-2-en-1-one mediante condensazione aldolica? E il 2-ossocicloesancarbossilato di metile mediante condensazione di Claisen?
- Sintetizzare il 4-etil-4-eptanolo, utilizzando propanale come unica fonte di atomi di carbonio. Poi, a partire dal 4-etil-4-eptanolo, proponi una strategia per ottenere il 4-etil-3-eptanone.
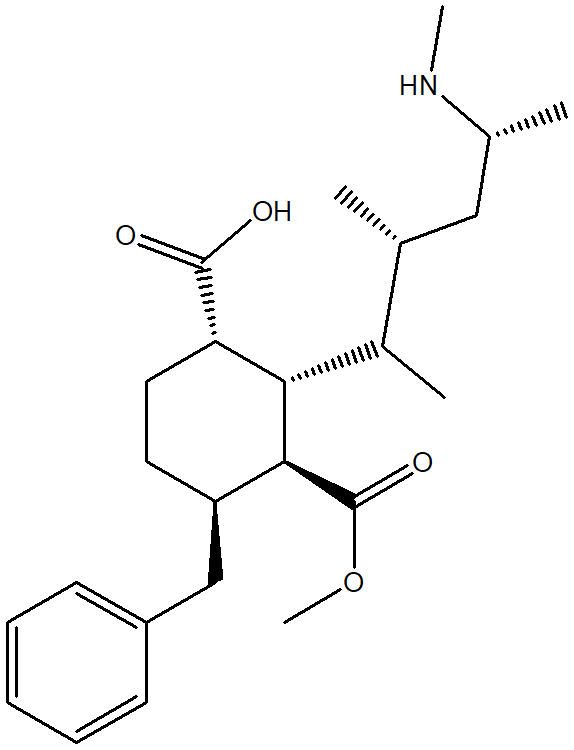
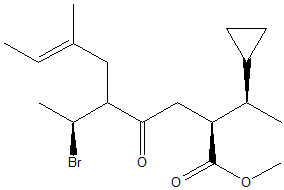
- Assegnare il nome IUPAC, comprensivo di stereochimica, al seguente composto:

Grado di difficoltà delle domande:
Alto (richiedono più passaggi e/o notevole padronanza della disciplina): 27, 29
Medio (domande che vanno al di là della mera esposizione/applicazione di concetti teorici): 14, 22, 26, 28
Basso (domande che riguardano l’esposizione di concetti teorici, la dimostrazione di semplici meccanismi di reazione, l’applicazione diretta di concetti teorici di base): tutte le domande non incluse nelle due liste precedenti.












You must be logged in to post a comment.