ChemisTree (5)

Scaldamani e termodinamica

Università degli Studi della Campania "Luigi Vanvitelli"

Scaldamani e termodinamica


1. Quale solvente favorirà una reazione che procede con meccanismo SN1 e quale una reazione che procede con meccanismo SN2?

2. Determinare se la reazione di sostituzione procede con meccanismo SN1 o SN2 e cerchiare il solvente in cui far avvenire la reazione al fine di velocizzarla. Giustificare la scelta.
In basso sono riportate anche le strutture dei solventi per i quali non conoscete ancora le abbreviazioni o il nome IUPAC (tutti e quattro i solventi in questione sono solventi polari aprotici).
Solventi:

3. Quale delle seguenti reazioni procede più velocemente?
4. Scegli il solvente (tra i due indicati sotto la reazione) da usare per ciascuna delle seguenti reazioni:

5. Quali condizioni di reazione (incluso il solvente) sceglieresti per ottenere:
a) 1-pentene a partire da un alogenuro alchilico a scelta?
b) 1-metil-1-cicloesene a partire da uno degli stereoisomeri del 1-bromo-1-metilcicloesano (indicare anche da quale stereoisomero in particolare)?

Si comunica che la quarta e ultima prova intercorso è posticipata a lunedì 22/12 alle 9:30

Raccomandazioni prima di affrontare questi esercizi:
1) studiare le reazioni in oggetto. Prendere, inoltre, visione del materiale didattico pubblicato.
2) Alla fine del post troverete un link in cui sono riportati alcuni degli esercizi svolti/guidati che possono essere una guida per affrontare anche gli altri esercizi
1) Come è possibile sintetizzare i seguenti alogenuri alchilici a partre da un alcol
2) Scrivere il prodotto o i prodotti principale della disidratazione con acido solforico ad alta temperatura per ciascuno dei seguenti alcoli
3) Scrivere il prodotto o i prodotti delle seguenti reazioni :

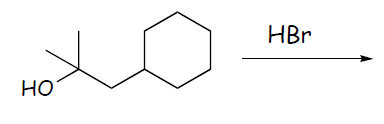
4) Completare le seguenti reazioni

5) Proporre un meccanismo per le seguenti trasformazioni:

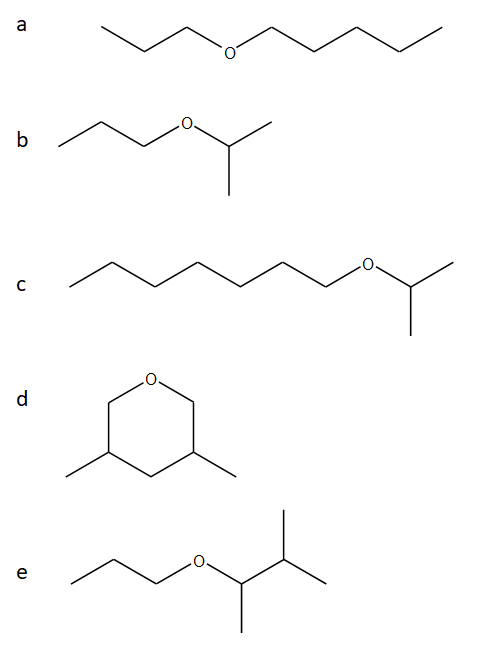
6) Proporre una strategia di sintesi dei seguenti eteri mediante sintesi di Williamson. Per ciascun etere, dire se sono possibili metodi di sintesi alternativi.
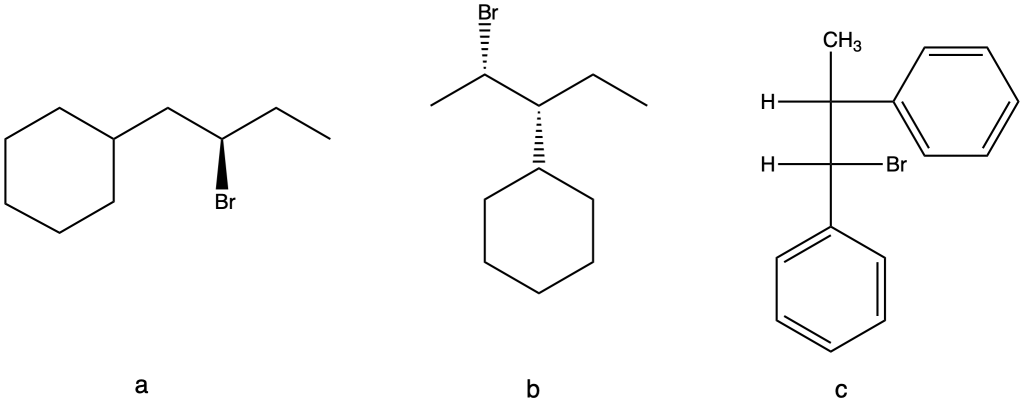
7) Per ciascuno dei seguenti alogenuri alchilici scrivere il principale prodotto di eliminazione specificandone la stereochimica.
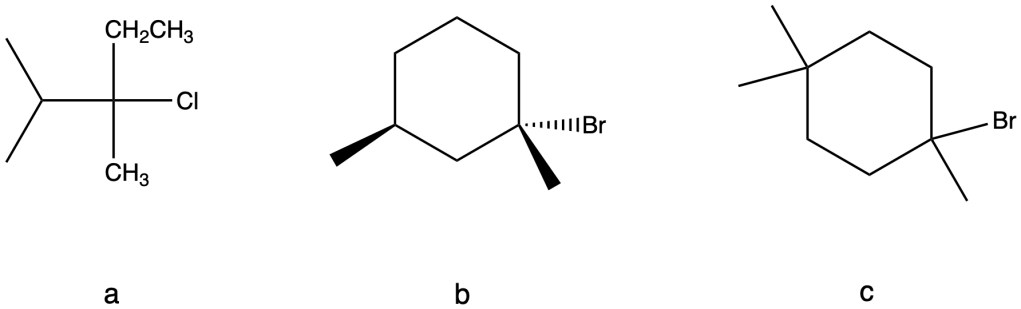
8) Per ciascuno dei seguenti alogenuri alchilici terziari, scrivere il prodotto della reazione di solvolisi con metanolo.
9) Quale sarà il prodotto principale di eliminazione che si otterrà a partire da ciascuno dei seguenti reagenti per trattamento con una base forte e con una base debole?

10) Scrivi la formula di struttura del prodotto organico principale per ognuna delle reazioni e specifica il meccanismo più probabile per la sua formazione

–> ESERCIZI GUIDATI (segui il link)

Le reazioni che avvengono a carico di questi composti, non sono altro che reazioni di sostituzione ed eliminazione, che qui andremo a schematizzare. Per ora abbiamo approfondito solo quelle che avvengono a carico degli alcoli. Gli altri meccanismi saranno approfonditi giovedì a lezione.
ALCOLI
Gli alcoli possono essere convertiti in alogenuri alchilici (i quali possono poi essere convertiti in una grande varietà di composti, in virtù della loro reattività) o alcheni.
La prima trasformazione avviene mediante reazioni di sostituzione, la seconda mediante una reazione di eliminazione (dato che viene eliminata una molecola di acqua, si parla di disidratazione).
Le reazioni da conoscere sono le seguenti:

In blu sono riportate le reazioni di sostituzione, in nero quelle di disidratazione.
HX= HBr, HI, o HCl/ZnCl2
Il meccanismo con cui le reazioni avvengono, dipende dalla natura dell’alcol (primario, secondario o terziario):

Per quanto riguarda gli aspetti stereochimici, valgono le stesse considerazioni fatte per le reazioni che avvengono a carico degli alogenuri alchilici.
ETERI
Gli eteri danno reazioni di sostituzione nucleofila con HBr e HI (la reazione è lenta, per cui la miscela di reazione deve essere riscaldata). Il meccanismo sarà SN1, se, dopo la protonazione del gruppo OR, allontanandosi questo dà luogo ad un carbocatione stabile. Se questo non accade, il meccanismo sarà di tipo SN2.
EPOSSIDI
Gli epossidi possono reagire con un gran numero di nucleofili e il meccanismo di apertura dell’epossido dipende dalle condizioni in cui avviene la reazione:

La reazione di apertura dell’epossido avviene con attacco da retro, determinando la stereochimica del prodotto: l’ossidrile (che deriverà dall’ossigeno dell’epossido) e il nucleofilo (che ha dato l’attacco) si troveranno in anti tra loro.
Tantissimi nucleofili possono reagire con gli epossidi, tra questi, ad esempio, gli ioni acetiluro (portando ad un allungamento della catena carboniosa), ione idrossido (che porta alla sintesi di dioli trans), idruri (sintesi di alcoli senza trasposizione).
Per i dettagli teorico-pratici dei singoli meccanismi, si rimanda al testo

Concetti importanti su questi meccanismi, con approfondimenti sugli orbitali coinvolti:

Decorazioni natalizie, terpeni e carbocationi


Di seguito sono riportati i risultati della terza prova intercorso.
La casella relativa alla media delle prime due prove è quella che contiene la matricola. La media determina l’ammissione alla prova successiva. Le altre caselle fanno riferimento a ciascuna prova sostenuta.
In particolare, si prega di prendere visione dei risultati della III prova.
Gli studenti identificati con il colore verde (casella della media) sono ammessi a sostenere la quarta prova intercorso.

NB: I BONUS ottenuti dalla vittoria della Weekend Organic Chemistry Challenge (e delle sfide a sorpresa) sono già stati aggiunti nel conteggio del punteggio finale.
Gli studenti identificati dai colori giallo e arancione, di seguito riportati, sono ammessi con riserva alla quarta prova intercorso. Si ricorda che l’ammissione all’esame orale richiede un punteggio medio minino di 15 punti.
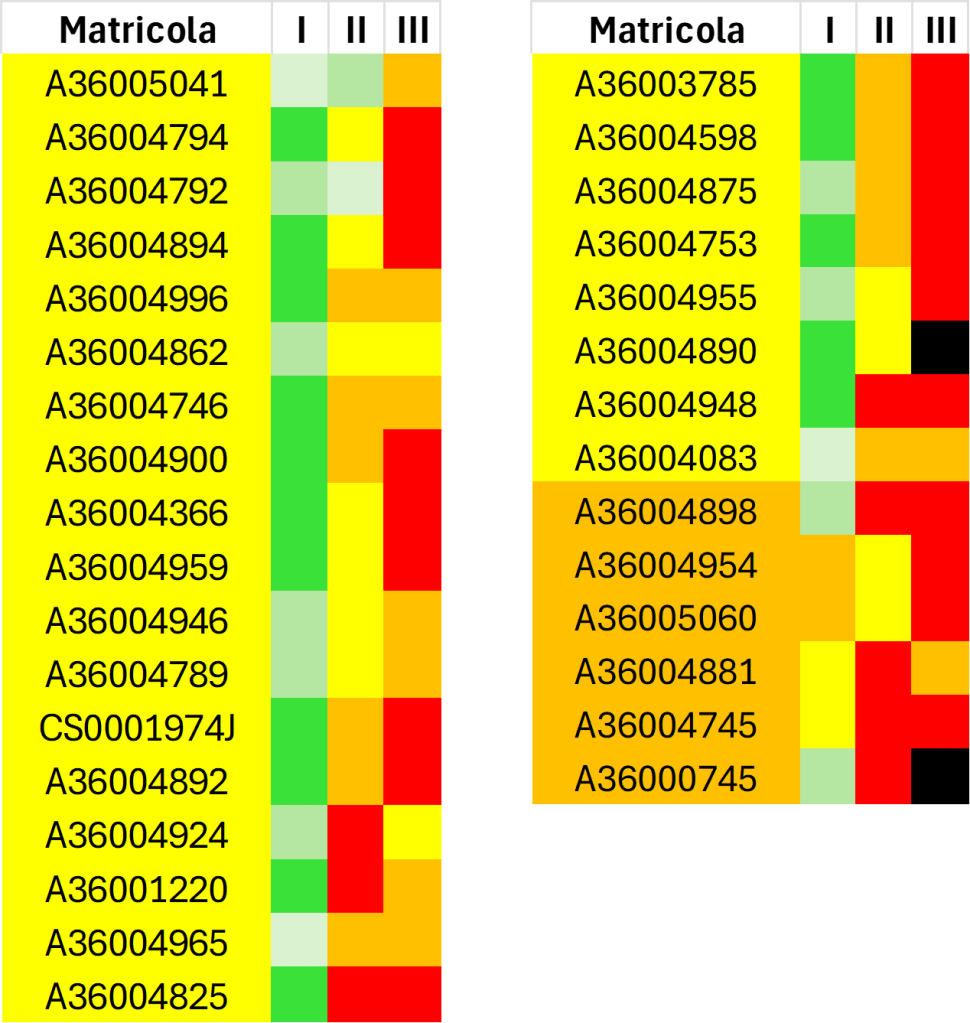
Di seguito sono riportati gli studenti NON AMMESSI a sostenere la Quarta Prova Intercorso
Si ricorda che il nero indica una insufficienza gravissima (voto minore/uguale a 6…e si ricorda che i voti sono espressi in trentesimi).

IMPORTANTI CONSIDERAZIONI:
Nonostante la semplicità degli esercizi della prova, la maggior parte di voi ha dimostrato una preparazione molto scarsa. Solo 29 persone hanno raggiunto la sufficienza. In alcuni casi, sono stati commessi errori che denotano la totale assenza di studio. Come detto oggi a lezione, fare alcuni errori significa non aver neppure guardato le figure del libro.
A questo punto vi invito ad una riflessione e ad un’attenta analisi del vostro approccio allo studio della Chimica Organica. Ovviamente, dobbiamo considerare una serie di aspetti:
1) Alcuni di voi, venuto meno l’obbligo di frequenza, hanno ben deciso di non seguire il corso o di farlo saltuariamente. Credo che, date le difficoltà che incontrate con questa disciplina, sia impensabile studiare senza il supporto delle lezioni. Essere comunque ammessi a sostenere le prove per poi fallire, non serve a nulla. Qualcuno di voi probabilmente starà preparando gli esami che farà a dicembre, rischiando di non superare nè l’esame in questione, nè le prove intercorso.
2) Altri, pur seguendo il corso, sono seduti in aula in maniera totalmente passiva. In questo caso, il corso serve a ben poco. La lezione vi deve servire per capire gli argomenti e per cominciare lo studio, che poi ovviamente deve continuare a casa. Chiariamo anche che studiare non significa capire come fare gli esercizi…Ieri a lezione abbiamo chiarito il significato del verbo studiare (se qualcuno era distratto/assente può controllarne il significato in maniera autonoma).
3) Qualcuno, pur seguendo il corso e impegnandosi, ha comunque delle difficoltà oggettive che possono essere legate o a lacune pre-esistenti mai colmate, o ad un metodo di studio non adeguato, oppure alla difficoltà di stare al passo, necessitando di più tempo per fissare gli argomenti (o ancora ad altre motivazioni che includono eventuali problemi personali).
Gli studenti che fanno parte del terzo gruppo sono invitati a contattare la docente per farsi supportare e capire come è meglio procedere.
Gli studenti del primo e secondo gruppo, sono invitati a rivedere il proprio approccio.
Vi invito anche a notare lo specifico andamento a partire dalla prima fino all’ultima prova e a riflettera in maniera onesta su quanto e come avete studiate durante il corso.
Sottolineo che quando a lezione vi si chiede se è tutto chiaro o se ci sono dubbi sugli argomenti trattati anche nelle lezioni precedenti, non si tratta di una domanda retorica: se qualcosa non è chiaro dovreste farlo presente, in modo che si possa provare a chiarire i vostri dubbi. Se il dubbio riguarda solo poche persone, c’è inoltre sempre il ricevimento. Ovviamente questo implica il fatto che abbiate studiato, perchè solo in quel caso abbiamo modo di dialogare e di capire perchè una determinata cosa non è chiara.
Infine, come sottolineato oggi a lezione, le conoscenze teoriche servono a poco se non siamo in grado di applicarle. Gli esercizi di chimica organica non richiedono semplicemente memoria, ma soprattutto capacità di ragionamento. Per molti non esiste “un metodo meccanico” per svolgerli: è necessario comprendere a fondo i principi, saperli collegare e usarli in modo flessibile a seconda del problema. Vi assicuro che sviluppare questa capacità di ragionamento vi sarà utile in moltissimi ambiti, non solo nella chimica organica.
Detto questo, in fondo a questo post (dopo le indicazioni su come prendere visione della prova), troverete gli esercizi della prova. Invito tutti coloro per i quali la prova non è andata bene a svolgerli (anche con l’ausilio del libro e degli appunti, ove necessario). Sarebbe una buona idea farli prima di venire a ricevimento per vedere la prova.
Modalità in cui sarà possibile prendere visione della prova:
Tutti gli studenti potranno prendere visione della prova a ricevimento. Coloro hanno totalizzato un punteggio inferiore a diciotto alla terza prova (ovvero quelli in cui la casella della seconda prova è in giallo/arancione/rosso/nero) potranno prendere visione della prova ESCLUSIVAMENTE a ricevimento singolo (non di gruppo). Il ricevimento dovrà essere prenotato con l’apposito link.
Nel caso in cui gli appuntamenti di ricevimento previsti non dovessero bastare, si provvederà ad aggiungerne altri.
TERZA PROVA INTERCORSO
PROVA A
1. Esistono due isomeri geometrici del 3-esene. Per reazione con Br2 in CH2Cl2, uno dei due darà due prodotti, l’altro solo uno.
A) Spiegare perché. (2pt)
B) Mostrare il meccanismo della reazione che porta alla sintesi di un unico prodotto, seguendo anche la stereochimica della reazione. (3pt)
2. Spiegare perché l’aggiunta di HBr al 2-metil-1-propene dà luogo ad una reazione totalmente regioselettiva (2pt)
3. L’aggiunta di HBr al 2-metil-1-propene procede attraverso la formazione di un intermedio carbocationico.
a) Completare il meccanismo riportato in basso, disegnando le frecce ricurve e gli stati di transizione.
b) Per ogni stadio, identificare la specie nucleofila con N ed elettrofila con E.
c) Scrivere ogni lettera riportata sul diagramma della coordinata di reazione nel quadrato tratteggiato corrispondente nel meccanismo di reazione.
d) Individuare ΔG0 della reazione e l’energia di attivazione dello stadio cineticamente determinante, scrivendone i simboli accanto alla freccia corrispondente sul diagramma.
e) Il secondo stadio della reazione è esoergonico o endoergonico?_______________________________
f) Cosa possiamo dire circa la Keq della reazione?____________________________________________ (3pt)

4. A partire da quale alchene e in che condizioni è possibile sintetizzare (2S,3R)-2-bromo-3-metil-3-esanolo? Mostrare l’analisi retrosintetica e indicare il nome IUPAC dell’alchene (3pt)
5. Mostrare le condizioni di reazione e il meccanismo della seguente trasformazione (ignorare la stereochimica). (4pt)
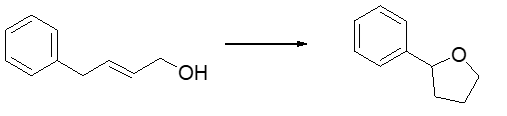
6. Spiegare e dimostrare perché il para-nitrofenolo (b) è più acido del fenolo (a). (2 pt)

7. Cerchiare il carbocatione più stabile tra i seguenti (1pt)

8 Mettere i seguenti composti in ordine di calore di idrogenazione crescente (2 pt)
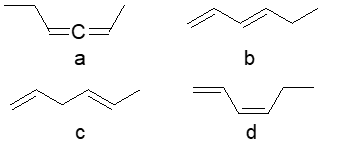
9. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti (4 pt)
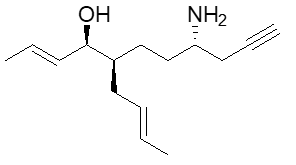

10. Scrivere i prodotti principali delle seguenti reazioni. Indicare la stereochimica, quando opportuno. (4pt)

PROVA B
1. Esistono due isomeri geometrici del 3-esene. Per reazione con Cl2 in CH2Cl2, uno dei due darà due prodotti, l’altro solo uno.
A) Spiegare perché. (2pt)
B) Mostrare il meccanismo della reazione che porta alla sintesi di due prodotti, seguendo anche la stereochimica della reazione. (3pt)
2. Spiegare perché l’aggiunta di HBr al 2-metil-1-propene dà luogo ad una reazione totalmente regioselettiva (2pt)
3. L’aggiunta di HBr al 2-metil-1-propene procede attraverso la formazione di un intermedio carbocationico.
a) Completare il meccanismo riportato in basso, disegnando le frecce ricurve e gli stati di transizione.
b) Per ogni stadio, identificare la specie nucleofila con N ed elettrofila con E.
c) Scrivere ogni lettera riportata sul diagramma della coordinata di reazione nel quadrato tratteggiato corrispondente nel meccanismo di reazione.
d) Individuare ΔG0 della reazione e l’energia di attivazione dello stadio veloce, scrivendone i simboli accanto alla freccia corrispondente sul diagramma.
e) Il primo stadio della reazione è esoergonico o endoergonico?_______________________________
f) Cosa possiamo dire circa la Keq della reazione? (3pt)

4.A partire da quale alchene e in che condizioni è possibile sintetizzare (2S,3S)-2-bromo-3-metil-3-esanolo? Mostrare l’analisi retrosintetica e indicare il nome IUPAC dell’alchene (3pt)
5. Mostrare le condizioni di reazione e il meccanismo della seguente trasformazione (ignorare la stereochimica). (4pt)

6. Spiegare e dimostrare perché il para-metossifenolo (b) è meno acido del fenolo (a). (2 pt)

7. Cerchiare il carbocatione più stabile tra i seguenti (1pt)

8. Mettere i seguenti composti in ordine di calore di idrogenazione decrescente (2 pt)
9. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti (4 pt)
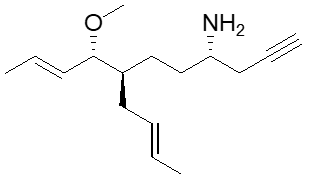

9. Scrivere i prodotti principali delle seguenti reazioni. Indicare la stereochimica, quando opportuno. (4pt)
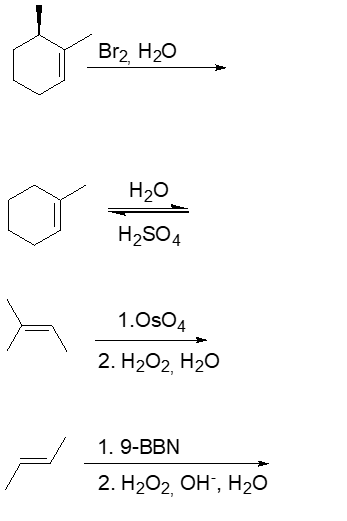
PROVA C
1. Esistono due isomeri geometrici del 2-butene. Per reazione con Br2 in CH2Cl2, uno dei due darà due prodotti, l’altro solo uno.
A) Spiegare perché.
B) Mostrare il meccanismo della reazione che porta alla sintesi due prodotti, seguendo anche la stereochimica della reazione. (3pt)
2. Spiegare perché l’aggiunta di HCl al 2-metil-1-propene dà luogo ad una reazione totalmente regioselettiva (2pt)
3. L’aggiunta di HCl al 2-metil-1-propene procede attraverso la formazione di un intermedio carbocationico.
a) Completare il meccanismo riportato in basso, disegnando le frecce ricurve e gli stati di transizione.
b) Per ogni stadio, identificare la specie nucleofila con N ed elettrofila con E.
c) Scrivere ogni lettera riportata sul diagramma della coordinata di reazione nel quadrato tratteggiato corrispondente nel meccanismo di reazione.
d) Individuare ΔG0 della reazione e l’energia di attivazione dello stadio cineticamente determinante, scrivendone i simboli accanto alla freccia corrispondente sul diagramma.
e) Il secondo stadio della reazione è esoergonico o endoergonico?_______________________________
f) Cosa possiamo dire circa la Keq della reazione?____________________________________________ (3pt)

4. A partire da quale alchene e in che condizioni è possibile sintetizzare (2R,3S)-2-bromo-3-metil-3-esanolo? Mostrare l’analisi retrosintetica e indicare il nome IUPAC dell’alchene (3pt)
5. Mostrare le condizioni di reazione e il meccanismo della seguente trasformazione (ignorare la stereochimica). (4pt)

6. Spiegare e dimostrare perché il fenolo (a) è più acido del cicloesanolo (b). (2 pt)

7. Cerchiare il carbocatione più stabile tra i seguenti (1pt)
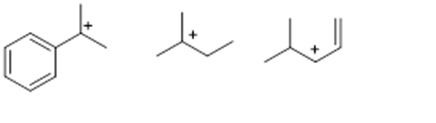
8. Mettere i seguenti composti in ordine di calore di idrogenazione crescente (2 pt)

9. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti (4 pt)


10. Scrivere i prodotti principali delle seguenti reazioni. Indicare la stereochimica, quando opportuno. (4pt)

PROVA D
1. Esistono due isomeri geometrici del 2-butene. Per reazione con Cl2 in CH2Cl2, uno dei due darà due prodotti, l’altro solo uno.
A) Spiegare perché. (2pt)
B) Mostrare il meccanismo della reazione che porta alla sintesi di un unico prodotto, seguendo anche la stereochimica della reazione. (3pt)
2. Spiegare perché l’aggiunta di HCl al 2-metil-1-propene dà luogo ad una reazione totalmente regioselettiva (2pt)
3. L’aggiunta di HCl al 2-metil-1-propene procede attraverso la formazione di un intermedio carbocationico.
a) Completare il meccanismo riportato in basso, disegnando le frecce ricurve e gli stati di transizione.
b) Per ogni stadio, identificare la specie nucleofila con N ed elettrofila con E.
c) Scrivere ogni lettera riportata sul diagramma della coordinata di reazione nel quadrato tratteggiato corrispondente nel meccanismo di reazione.
d) Individuare ΔG0 della reazione e l’energia di attivazione dello stadio veloce, scrivendone i simboli accanto alla freccia corrispondente sul diagramma.
e) Il primo stadio della reazione è esoergonico o endoergonico?_______________________________
f) Cosa possiamo dire circa la Keq della reazione?____________________________________________ (3pt)

4. A partire da quale alchene e in che condizioni è possibile sintetizzare (2R,3R)-2-bromo-3-metil-3-esanolo? Mostrare l’analisi retrosintetica e indicare il nome IUPAC dell’alchene (3pt)
5. Mostrare le condizioni di reazione e il meccanismo della seguente trasformazione (ignorare la stereochimica). (4pt)

6. Spiegare e dimostrare perché l’anilina (a) è meno basica della cicloesanammina (b). (2pt)

7. Cerchiare il carbocatione più stabile tra i seguenti (1pt)

8. Mettere i seguenti composti in ordine di calore di idrogenazione decrescente (2 pt)

9. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti (4 pt)

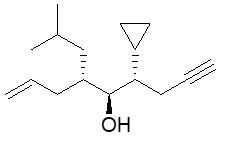
10. Scrivere i prodotti principali delle seguenti reazioni. Indicare la stereochimica, quando opportuno. (4pt)
OPZIONALE
Mostrare come è possibile ottenere un composto di formula molecolare C5H9BrO attraverso la reazione del pent-4-en-1-olo con bromo (4 pt)

Stelle di Natale e indicatori acido-base


Raccomandazioni prima di affrontare questi esercizi:
1) studiare le reazioni degli alogenuri alchilici, inclusa la problematica relativa alla competizione tra i meccanismi di reazione. Prendere, inoltre, visione del materiale didattico pubblicato.
2) Non farsi spaventare dal numero di esercizi e affrontarli in maniera razionale cercando di applicare quanto studiato.
3) Alla fine del post troverete un link in cui sono riportati alcuni degli esercizi svolti/guidati che possono essere una guida per affrontare anche gli altri esercizi

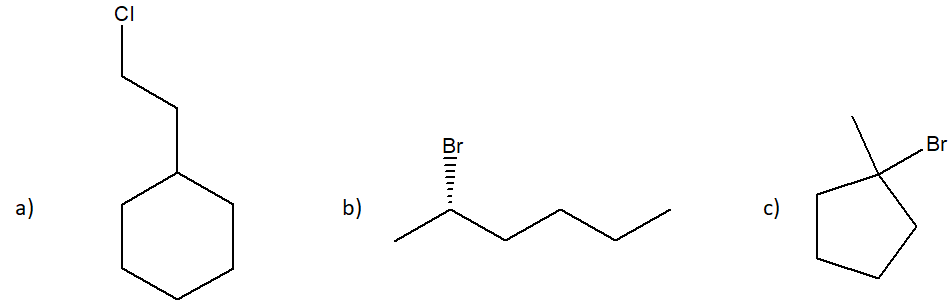
2) Individuare quali alogenuri alchilici dell’esercizio 1 non vanno incontro a sostituzione con meccanismo SN2 e spiegare perchè. Per questi, mostrare il meccanismo SN1, indicando anche le condizioni di reazione.
3) Quali delle seguenti affermazioni sono vere per sostituzioni nucleofile che avvengono con meccanismo SN2 e quali sono vere per sostituzioni nucleofile che avvengono con meccanismo SN1?
a) gli alogenuri terziari reagiscono più velocemente dei secondari;
b) se si usa un substrato otticamente attivo, la configurazione del prodotto è opposta a quella del prodotto di partenza;
c) la velocità della reazione dipende solo dalla concentrazione del substrato;
d) la reazione avviene in un solo stadio;
e) i carbocationi sono intermedi della reazione;
f) la velocità della reazione dipende dalla natura del gruppo uscente;
g) il 2,2-dimetil-1-cloropropano è poco reattivo.
4) Quali delle seguenti affermazioni sono tipiche di un meccanismo SN2:
a) La reazione procede con inversione di configurazione
b) L’ordine di reattività dell’alogenuro alchilico è il seguente: metile (più veloce) > 1° >2° > 3°
c) Possono avvenire riarrangiamenti
d) La velocità di reazione dipende dalla concentrazione del nucleofilo e dell’alogenuro alchilico
e) La reazione è, generalmente, più veloce in solventi polari aprotici
f) la velocità dipende dalla concentrazione del nucleofilo
g) la reazione avviene in uno stadio
h) Si forma un intermedio carbocationico
l) Si ottiene un prodotto in cui l’ibridazione del C che ha reagito è diversa da quella che aveva nel prodotto di partenza.
5) Spiegare come i seguenti cambiamenti influenzino la velocità di reazione del 2-bromo-2-metilpentano con metanolo
a) l’alogenuro alchilico è cambiato con 2-cloro-2-metilpentano
b) l’alogenuro alchilico è cambiato con 2-cloro-3-metilpentano.
6) Con riferimento agli alogenuri alchilici dell’esercizio 5, cosa cambierebbe se usassimo lo ione metossido invece del metanolo? E lo ione terz-butossido invece del metossido?
7) Ordina i seguenti composti per reattività crescente in una reazione SN1 :
a) 2-bromobutano
b) 1-bromobutano
c) 2-bromo-2-metilbutano
8) Mettere i seguenti composti in ordine di reattività crescente in una reazione SN1 e motivare la scelta
a) (CH3)3CI, (CH3)3CCl, (CH3)3CF, (CH3)3CBr
b) 2-bromo-2-metilbutano, 3-bromo-3-metil-1-butene, 2-bromobutano
c) 4-bromocicloesene, 5-bromo-1,3-cicloesadiene, 3-bromocicloesene
9) Mettere i seguenti composti in ordine di reattività crescente in una reazione E2 e motivare la scelta
a) 4-bromocicloes-1-ene, 5-bromo-1,3-cicloesadiene, 3-bromocicloes-1-ene
10) Mostrare il meccanismo e scrivere il prodotto principale che si ottiene quando ognuno dei composti dell’esercizio 1 subisce una reazione di eliminazione E2
11) Proporre una strategia di sintesi dei seguenti composti a partire dall’opportuno alogenuro alchilico:
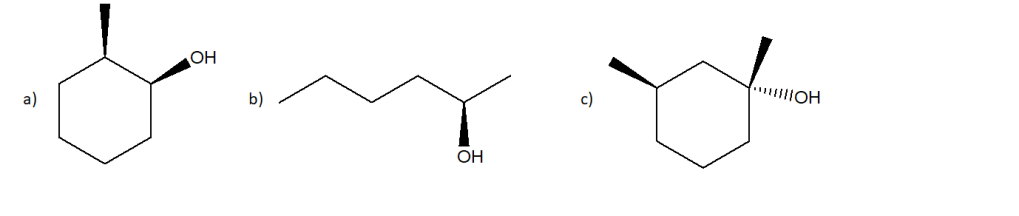
a) (1R, 3S)-3-metilcicloesan-1-olo
b) 1-metil-1-cicloesene
c) pentilidenciclopentano
12) Dire quale composto delle seguenti coppie reagisce più velocemente in una reazione di eliminazione E2 e spiegare perchè:
a) (1R,3S)-1-bromo-3-isopropilcicloesano o (1R,3R)-1-bromo-3-isopropilcicloesano
b) cis-1-bromo-4-isopropilcicloesano o trans-1-bromo-4-isopropilcicloesano
c) (1R,3S,4S)-1-bromo-4-isobutil-3-metilcicloesano o (1R,3S,4R)-1-bromo-4-isobutil-3-metilcicloesano
d) (1R,3S,4S)-1-bromo-4-isobutil-3-metilcicloesano o (1R,3R,4S)-1-bromo-4-isobutil-3-metilcicloesano
13) Scrivere i prodotti delle seguenti reazioni. Mostrare il meccanismo di reazione. Indicare la stereochimica quando opportuno.
a) (2R)-2-bromo-3-metilbutano + idrossido di sodio
b) (2R)-2-bromo-3-metilbutano + idrossido di sodio a caldo (100°C)
c) (2R)-2-bromo-3-metilbutano + DBN
d) (2R)-2-bromo-3-metilbutano + acetato di sodio
e) 1-bromocicloesano + idrossido di sodio
f) 1-bromocicloesano + t-butossido di potassio
g) 1-bromo-3-metilbutano + t-butossido di potassio
h) 1-bromo-3-metilbutano + idrossido di potassio
i) 1-cloro-1-metilciclopentano + metossido di sodio
l) 1-cloro-1-metilciclopentano + acqua
14) Rappresenta i prodotti delle seguenti reazioni E2, tenendo presente la stereochimica (NB: seguire la stereochimica nel corso della reazione)
a) (2S,3S)-2-bromo-3-metilesano + OH– a caldo
b) (2S,3R)-2-bromo-3-metilesano + OH– a caldo
c) (2R,3R)-2-bromo-3-metilesano + OH– a caldo
d) (2R,3S)-2-bromo-3-metilesano + OH– a caldo
e) (2S,3S)-2-fluoro-3-metilesano + OH– a caldo
15) Partendo dall’opportuno alogenuro alchilico e scegliendo le giuste condizioni di reazione, illustrare il meccanismo di reazione della sintesi dei seguenti composti. Indicare eventuali altri prodotti fornendo per tutti il nome IUPAC completo di stereochimica.
a) 1-metil-1-cicloesene
b) (3R)-3-metil-1-1cicloesene
c) 2-metil-1-pentene
d) 2-metil-2-pentene
e) (2Z)-3-metil-2-pentene
f) (2E)-3-metil-2-pentene
16) Qual è il meccanismo di reazione (SN1, SN2, E1, E2) più probabile nelle seguenti condizioni di reazione? Argomentare la scelta fatta
a) 2-bromopropano + KI in acetone;
b) 2-bromopropano + acetato di sodio in acqua;
c) 2-bromo-2-metilpropano + etanolo;
d) 2-bromo-2-metilpropano+ etanolo, a caldo.
17) Scrivere i prodotti principali delle seguenti reazioni. Mostrare il meccanismo di reazione. Indicare la stereochimica quando opportuno. Inoltre, disegnare per ciascuna reazione il diagramma di energia libera/coordinata di reazione (corredato delle strutture degli stati di transizione e degli eventuali intermedi di reazione).
a) (2S)-2-bromo-3-metilpentano + t-butossido di potassio
b) 1-bromo-1-metilcicloesano + acqua
c) 1-bromo-1-metilcicloesano + DBN
d) (2S,3R)-2-bromo-3-metilpentano + idrossido di sodio
e) (2R)-2-fluorobutano + metossido di potassio
f) (clorometil)cicloesano + t-butossido di potassio
g) (1S,2R)-1-cloro-3-metilcicloesano + etossido di potassio
h) (1R,2R)-1-cloro-3-metilcicloesano + etossido di potassio
i) 3-bromo-1-cicloesene + acqua
l) 3-bromo-1-cicloesene + metossido di sodio
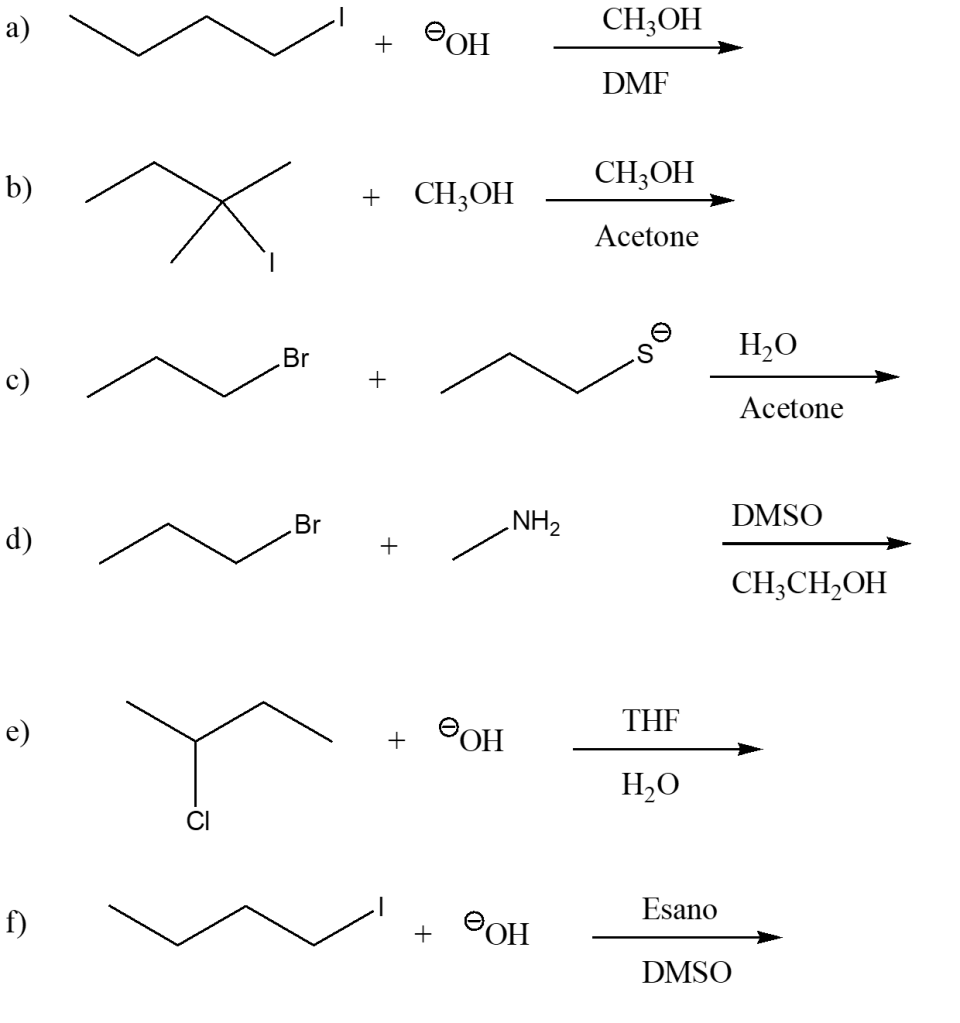
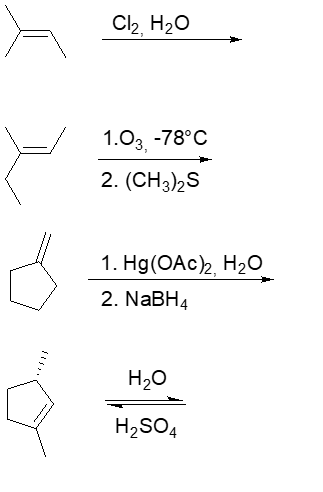
18) Scrivere i prodotti principali delle seguenti reazioni (indicare anche la stereochimica dei prodotti):
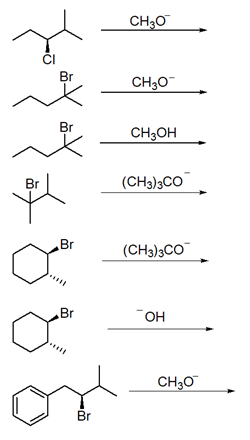
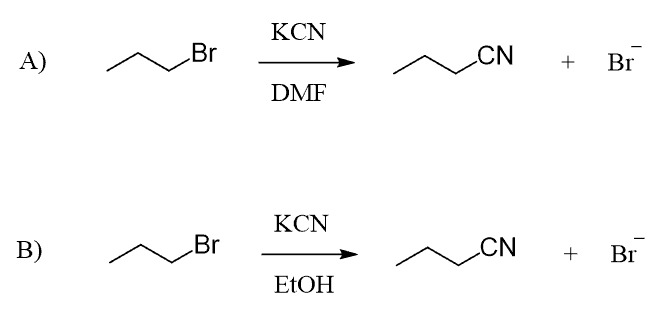
19) Scrivere i prodotti principali delle seguenti reazioni, motivando la risposta

–> ESERCIZI GUIDATI (segui il link)
You must be logged in to post a comment.