Esercitiamoci per la prova scritta VII

Suggerimento: per poter usare questi set di esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 2 ore per ciascun set.
PRIMO SET
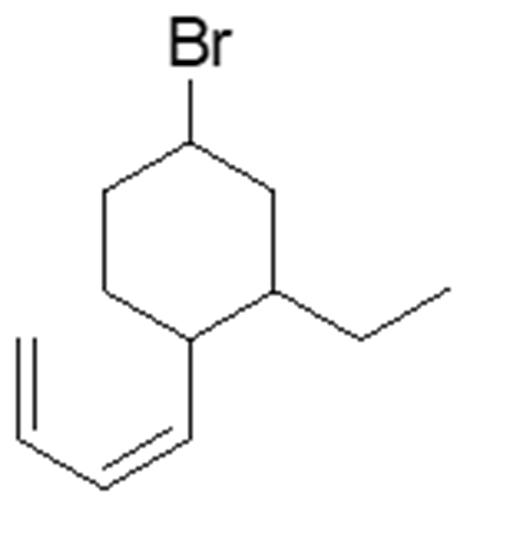
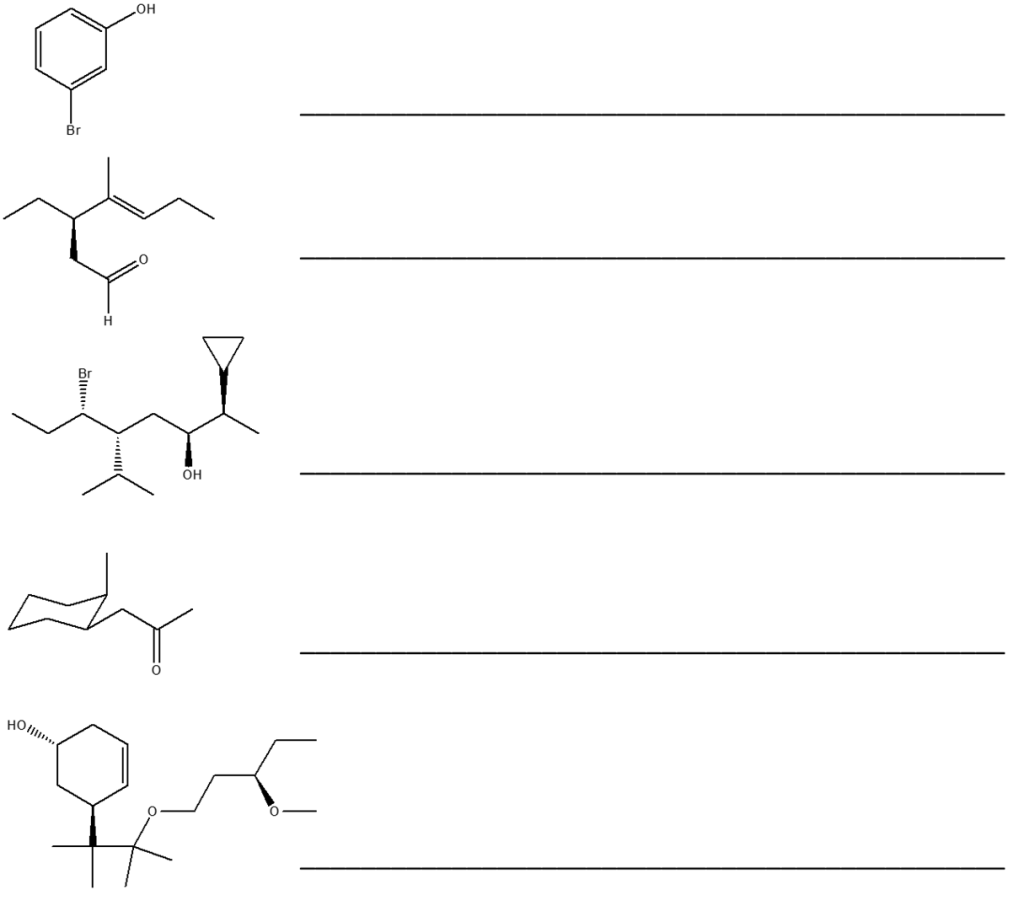
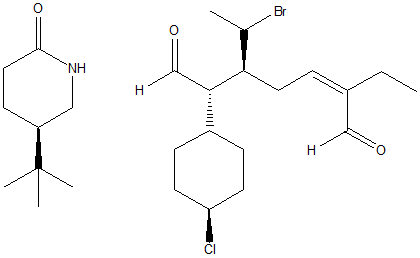
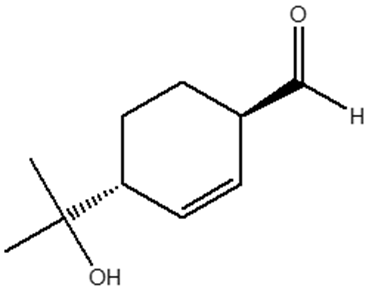
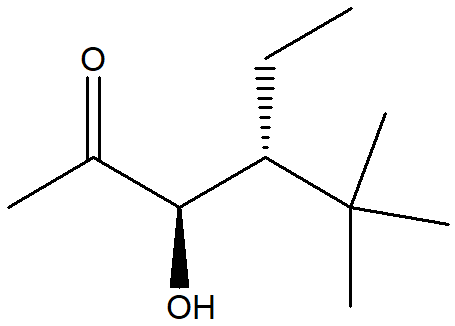
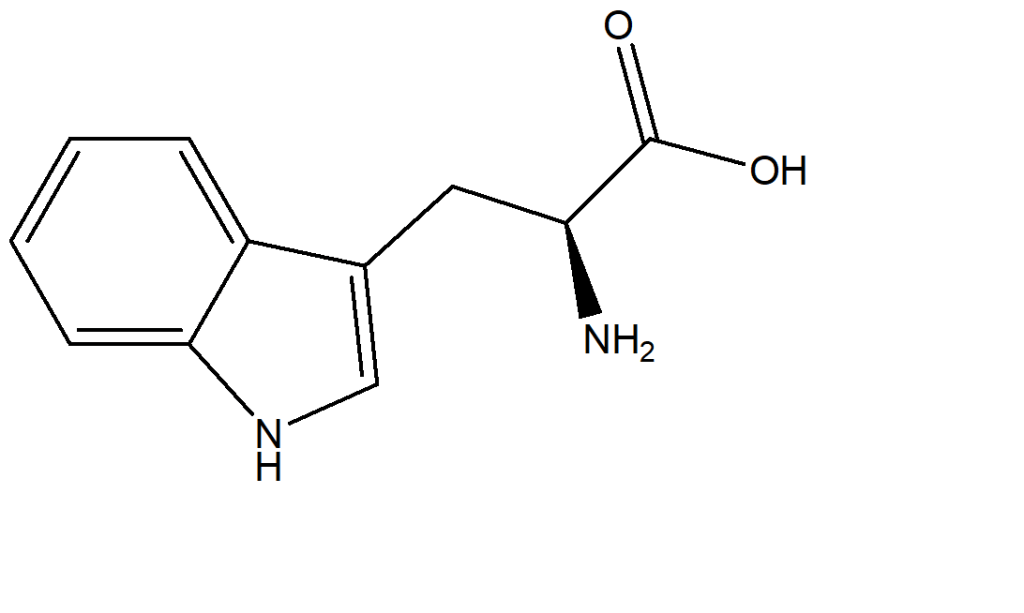
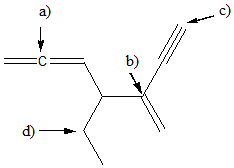
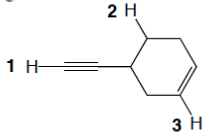
1. Attribuire il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:

2) Disporre i seguenti composti in ordine di solubilità crescente in acqua. Indicare l’ordine inserendo i numeri nei riquadri sotto le strutture: 1= il meno solubile, 4= il più solubile

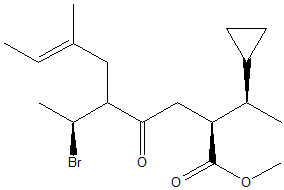
3) Calcolare il numero massimo di stereoisomeri possibili per la seguente struttura. Scriverne uno a scelta e determinare la configurazione assoluta dei carboni chirali

4) In basso è riportata la struttura del dolcificante aspartame:

I) Oltre al fenile, sono presenti altri 4 gruppi funzionali: cerchiare ogni gruppo funzionale ed identificarlo come nell’esempio in alto
II) Individuare i carboni chirali ed assegnare a ciascuno di essi la configurazione assoluta.
III) Indicare l’ibridazione dei due atomi di azoto
IV) Dire quale dei due atomi di azoto è più basico e perché
5) Stabilire le configurazioni assolute dei carboni chirali presenti nelle seguenti molecole (NB: la notazione va riportata vicino ai carboni cui fa riferimento) e dire qual è la relazione stereochimica esistente tra i composti di ciascuna coppia (enantiomeri/diastereoisomeri/stesso composto/altro):
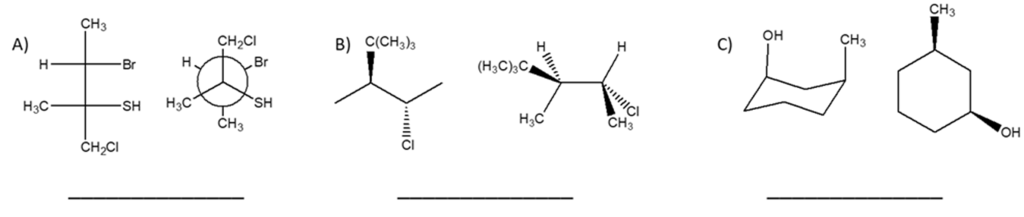
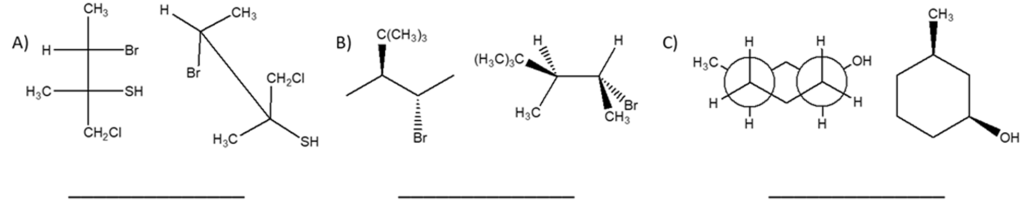
6) Dire se le strutture riportate a destra sono isomeri conformazionali, isomeri geometrici, isomeri ottici, isomeri costituzionali, o lo strutture identiche rispetto alla seguente struttura a segmenti:

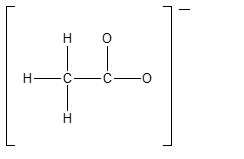
7)Mostrare come il seguente anione è stabilizzato per risonanza

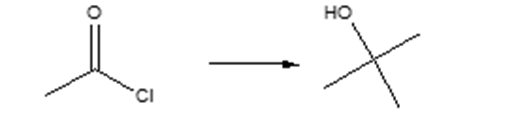
8) Mostrare le condizioni di reazione e il meccanismo della seguente trasformazione (ignorare la stereochimica).

9) Mostrare il meccanismo e i prodotti della seguente reazione:

10)Indicare le condizioni di reazione per ottenere la seguente trasformazione e dire se i due composti raffigurati sono otticamente attivi
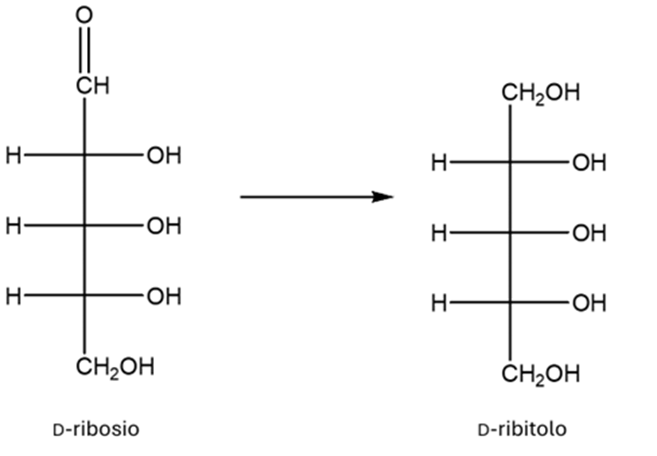
SECONDO SET
1. Attribuire il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:

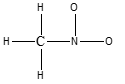
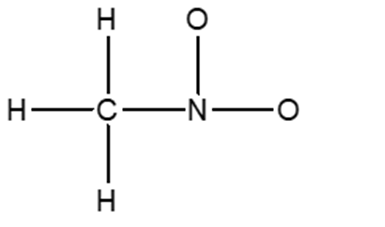
2) Completare la seguente struttura di Lewis e calcolare la carica formale per tutti gli atomi diversi all’idrogeno:
3) Quali sono la geometria, l’angolo di legame e l’ibridazione previste per il catione metile?
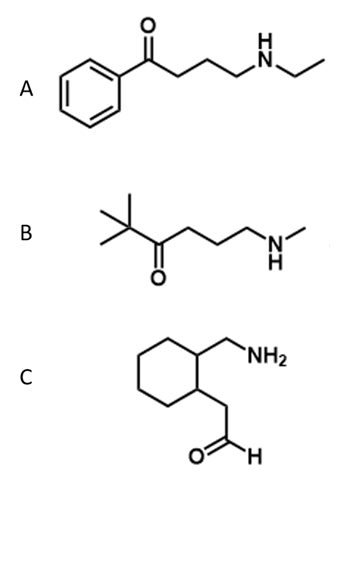
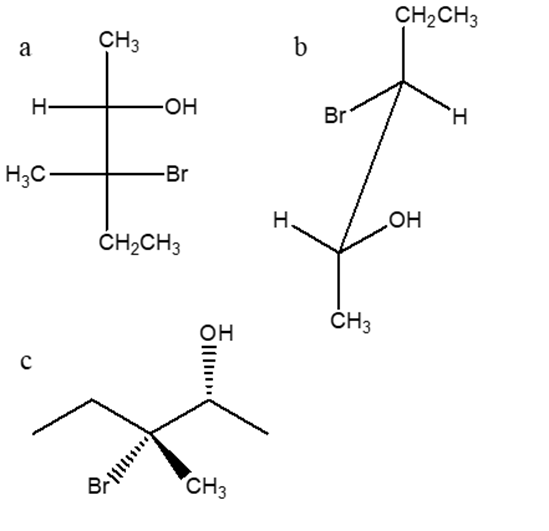
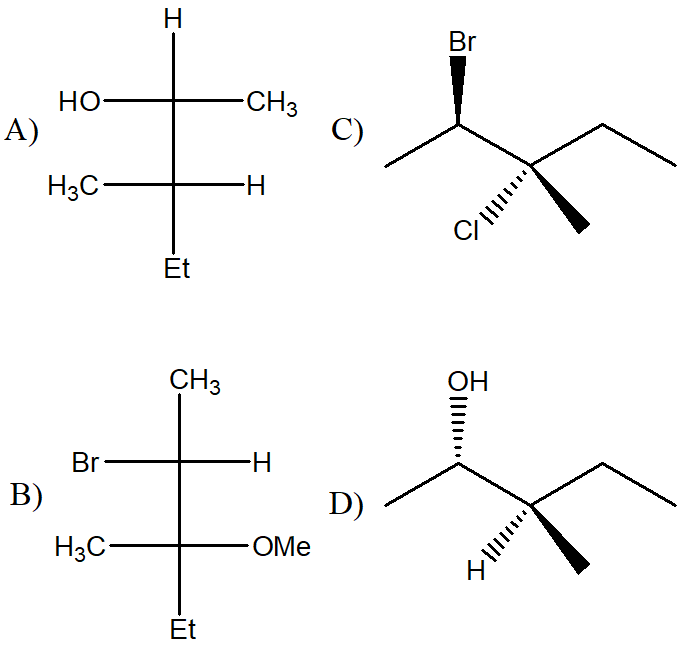
4) Dire qual è la relazione esistente tra i seguenti composti (enantiomeri/diastereoisomeri/ isomeri geometrici/isomeri conformazionali/ stesso composto/isomeri costituzionali/altro)

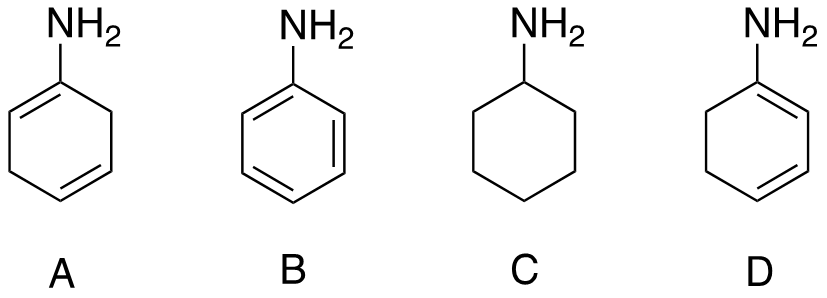
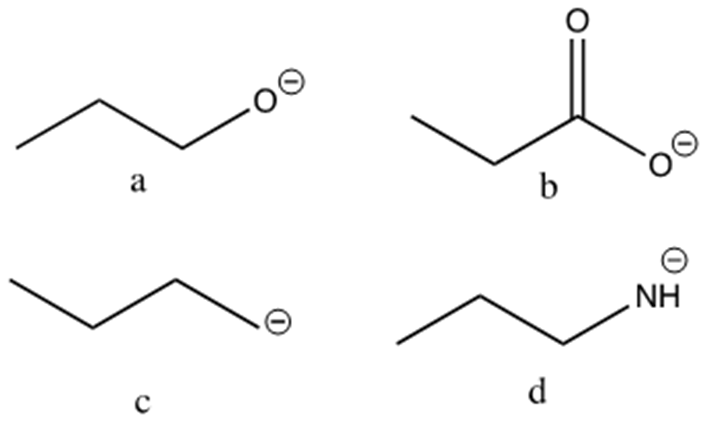
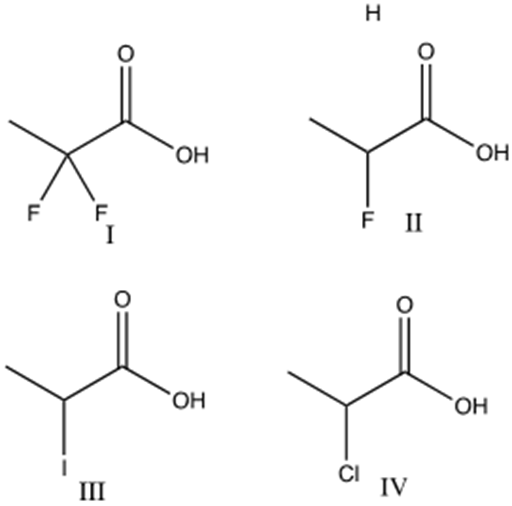
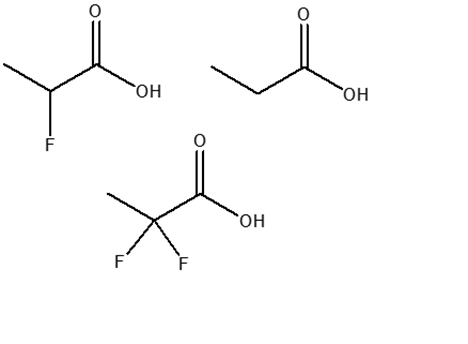
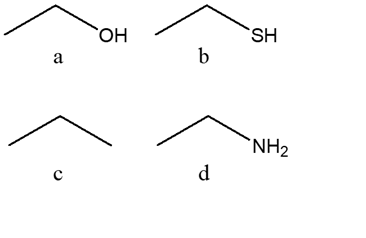
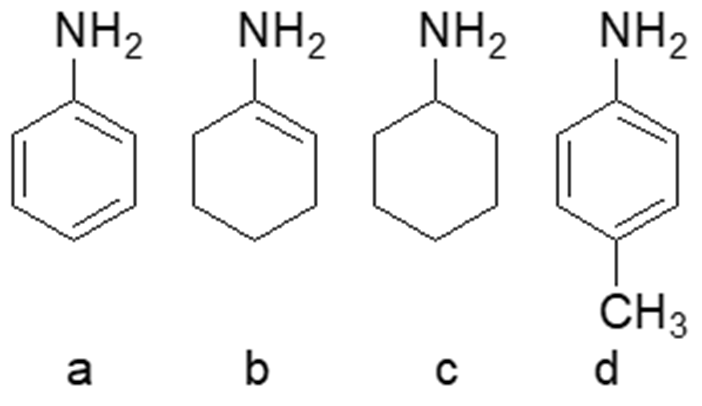
5) Disporre i seguenti composti in ordine di basicità decrescente e spiegare sinteticamente il perché:
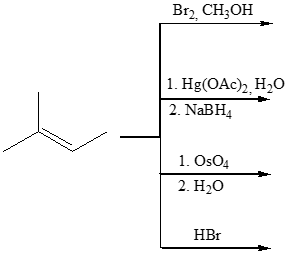
6) Scrivere i prodotti principali delle seguenti reazioni.


7) Mostrare le condizioni di reazione, il meccanismo e i prodotti della reazione del ciclopentanone con dimetilammina.
8) L’acido L-aspartico è un amminoacido con R= -CH2COOH.
I valori di pKa dei gruppi ionizzabili sono i seguenti:
pKa α-COOH = 2.09
pKa α-NH3+ = 9.82
pKa COOH in catena laterale = 3.86
a) Scrivere l’amminoacido in proiezione di Fischer al punto isoelettrico
b) Determinare la configurazione assoluta del carbonio chirale
c) Calcolare il punto isoelettrico
d) Scrivere la struttura dell’amminoacido a pH>10 e a pH
TERZO SET
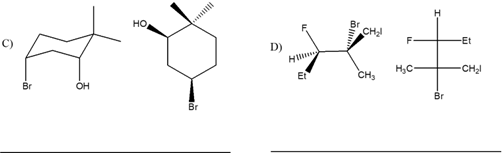
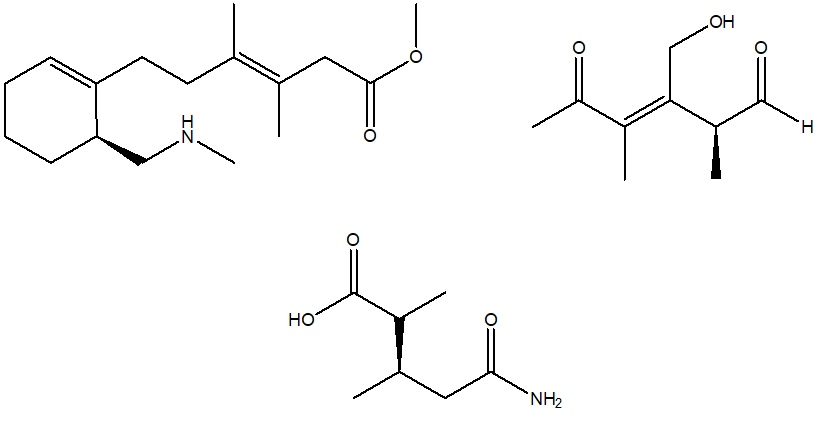
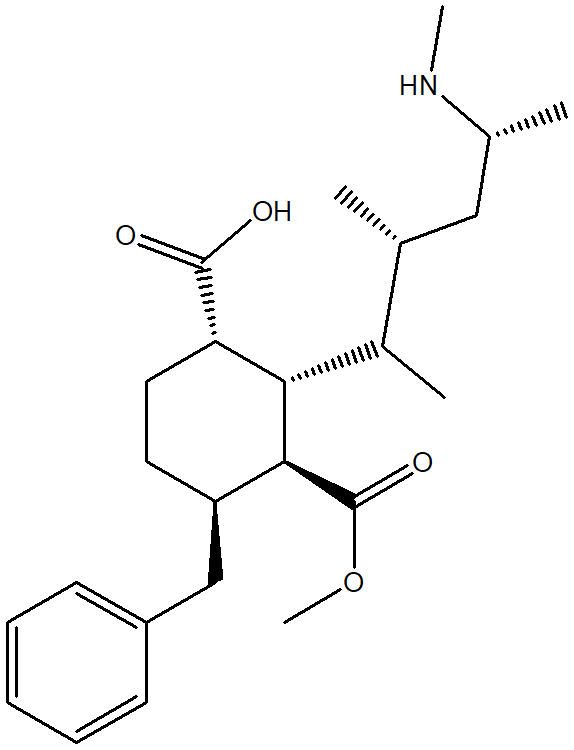
1. Attribuire il nome sistematico IUPAC, comprensivo di stereochimica, alle seguenti molecole:

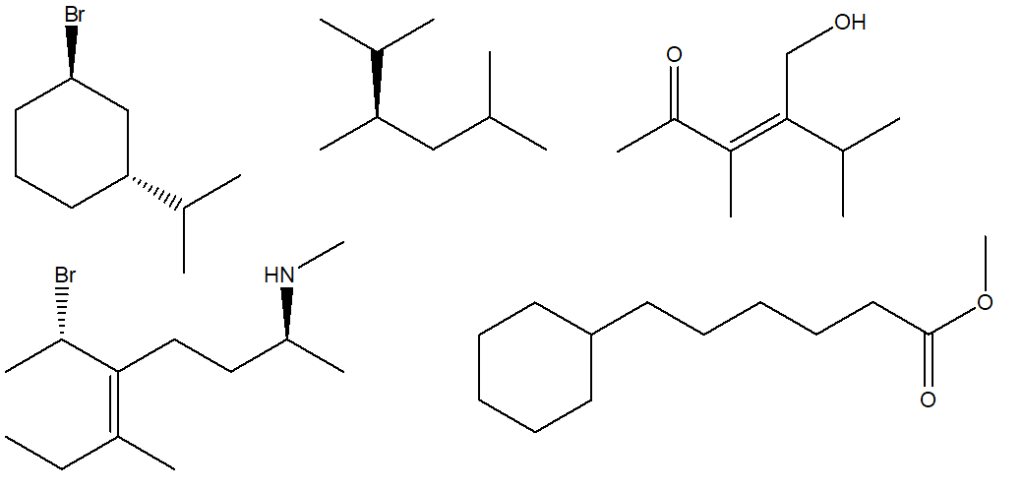
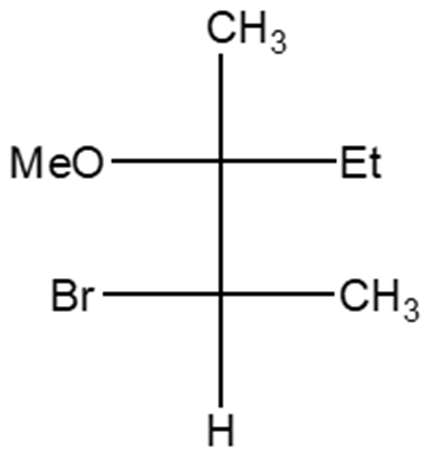
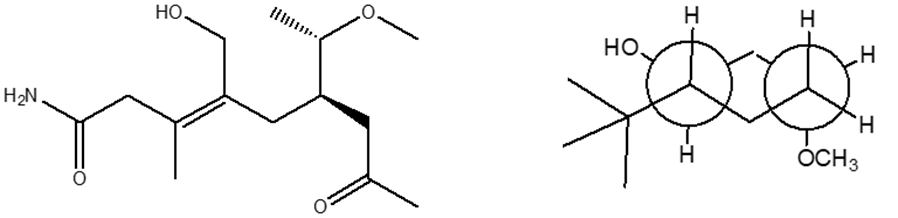
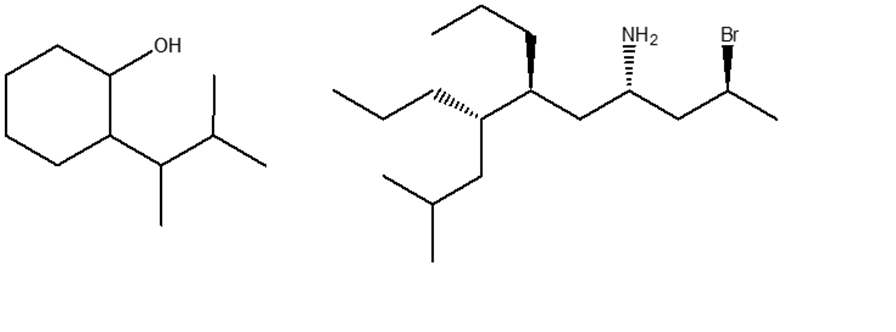
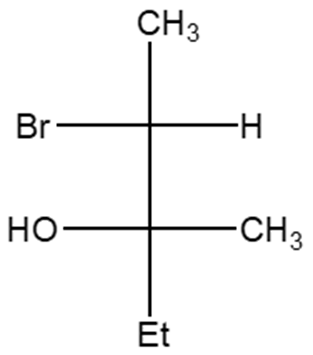
2. Stabilire le configurazioni assolute dei carboni chirali presenti nelle seguenti molecole (NB: la notazione va riportata vicino ai carboni cui fa riferimento) e dire qual è la relazione stereochimica esistente tra i composti di ciascuna coppia (isomeri conformazionali/enantiomeri/diastereoisomeri/stesso composto/altro):

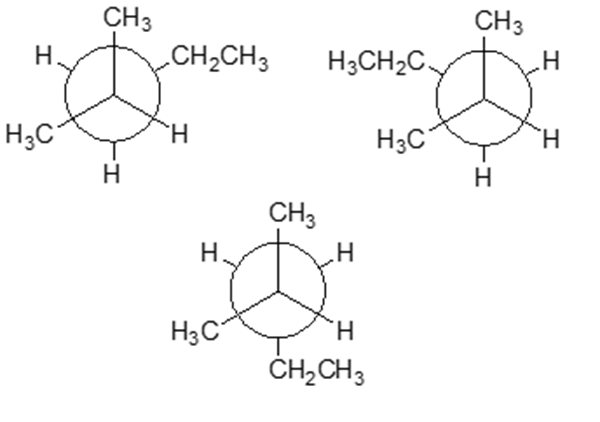
3. Prendendo in considerazione il legame C3-C4 del 2-metilpentano, scrivere la proiezione di Newman del conformero più stabile in assoluto e la struttura a cavalletto del conformero meno stabile in assoluto
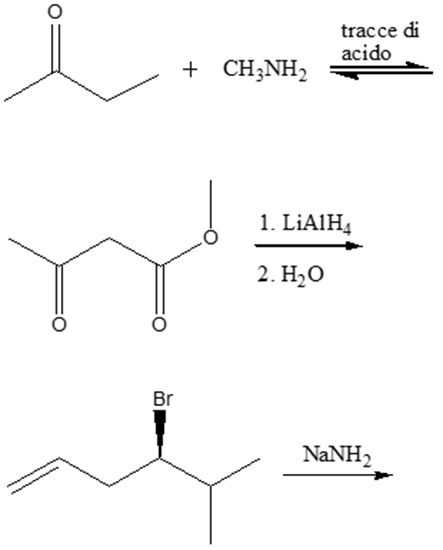
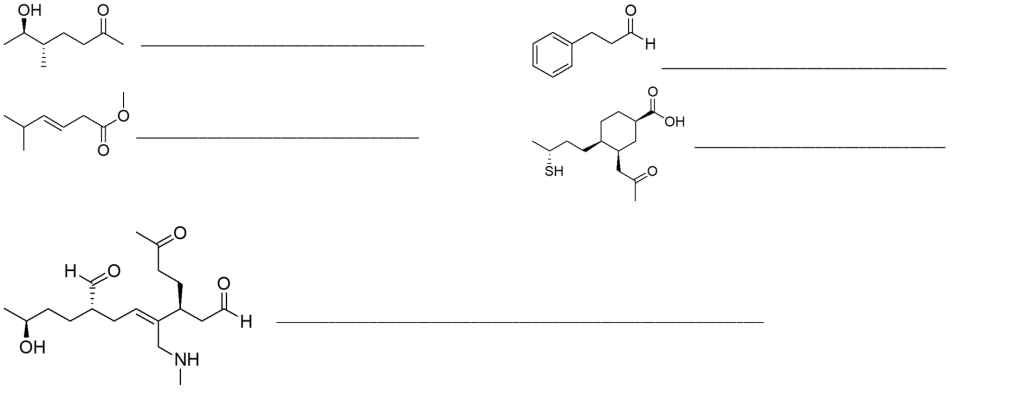
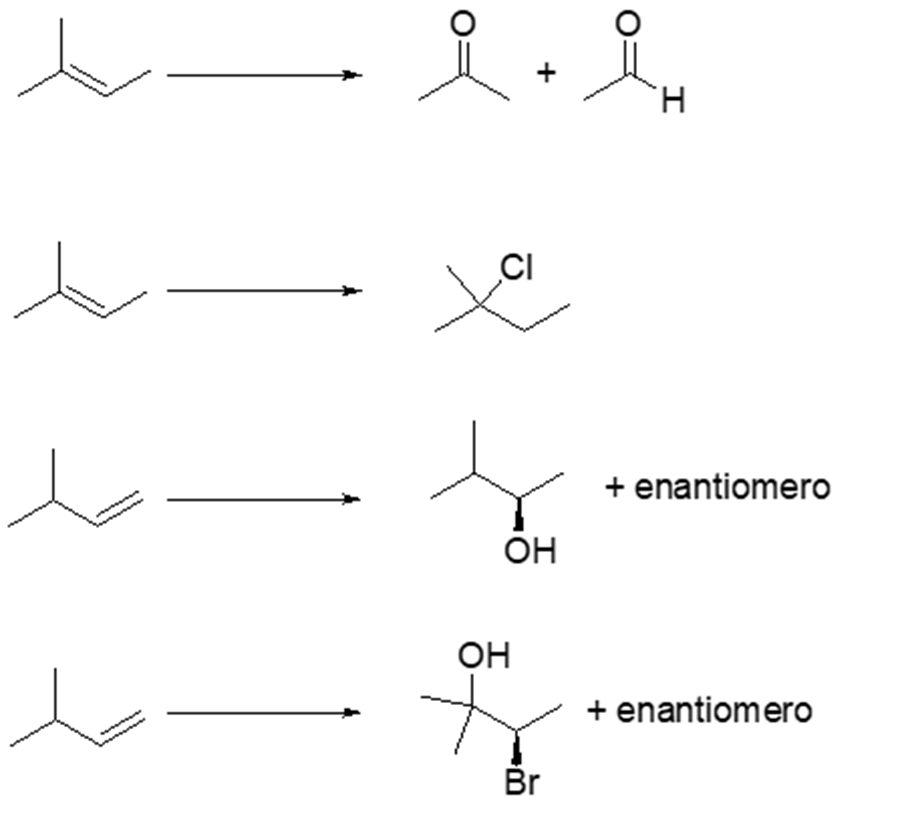
4. Scrivere i prodotti principali delle seguenti reazioni. Indicare anche il meccanismo con cui avvengono. Indicare la stereochimica, quando opportuno.
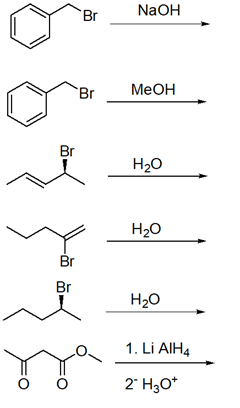
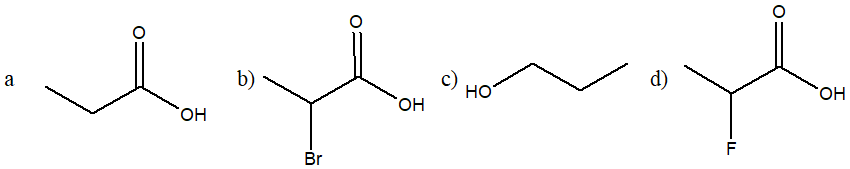
5. Ordina i seguenti composti per reattività crescente in una reazione E2

6. Mostra il meccanismo e i prodotti della seguente reazione:

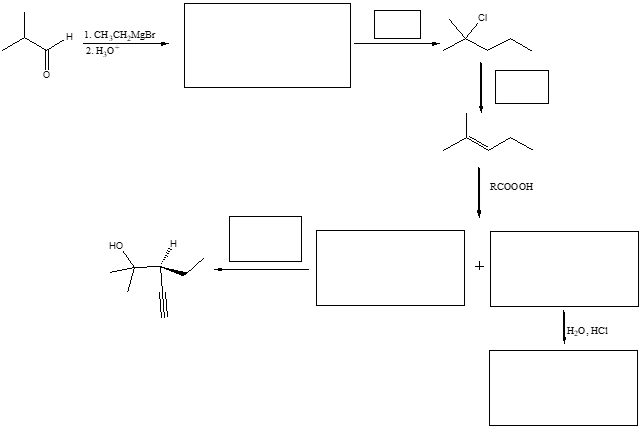
7. Completare il seguente schema inserendo le condizioni di reazione o i prodotti mancanti nei riquadri. Indicare la stereochimica quando opportuno.

8. Scrivi il dipeptide Ala-Gly sapendo che le catene laterali dei due amminoacidi sono -CH3 e -H, rispettivamente







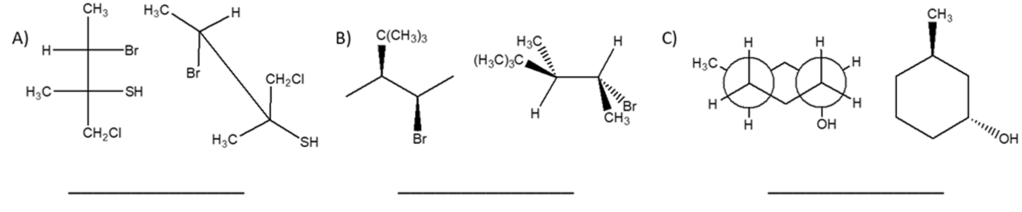































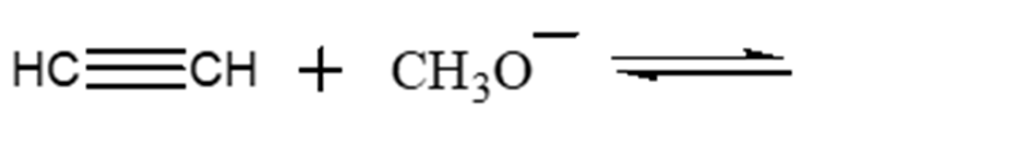



















You must be logged in to post a comment.