Introduzione alle reazioni organiche

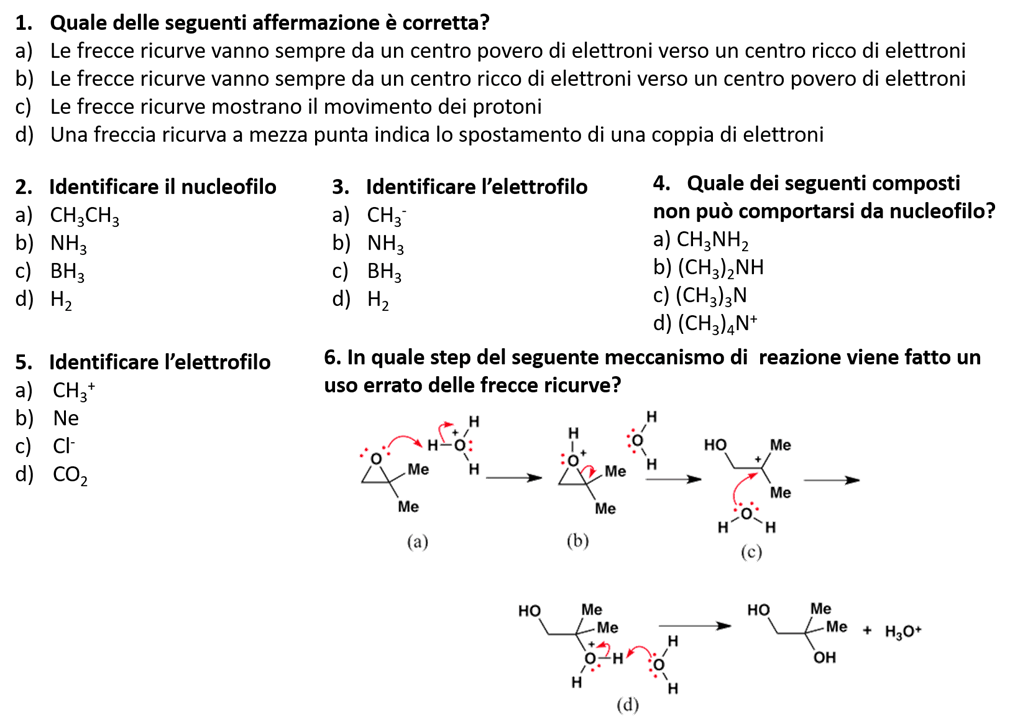
7) Dire quali delle seguenti specie chimiche tenderanno a reagire come nucleofili e quali come elettrofili
8) Sulla base del movimento degli elettroni mostrato dalle frecce ricurve nelle seguenti reazioni, disegnare i prodotti

9) Queste due reazioni formano i prodotti mostrati, ma non attraverso i meccanismi disegnati! Per ciascun meccanismo, spiegare perchè è errato e disegnarne uno corretto

10) Quale delle seguenti affermazioni è falsa:
a) se una reazione è spontanea, può avvenire velocemente
b) una reazione lenta può essere spontanea
c) se una reazione è spontanea, può avvenire lentamente
d) una reazione spontanea deve avere energia di attivazione bassa
11) Disegnare il diagramma energetico di una reazione monostadio con Keq<1. Indicare nel diagramma le parti corrispondenti a reagenti, prodotti, stato di transizione, variazione dell’energia libera di Gibbs, energia di attivazione. Il ΔG° è positivo o negativo?
12) Disegnare il diagramma energetico di una reazione a due stadi con Keq>1. Indicare nel diagramma le parti corrispondenti a reagenti, prodotti, stato di transizione, intermedio, variazione dell’energia libera di Gibbs, energia di attivazione. Il ΔG° è positivo o negativo?
13) Disegnare il diagramma energetico di una reazione esoergonica a due stadi, il cui secondo stadio sia più veloce del primo.
14) Data la seguente legge cinetica per una reazione:
velocità= k [A]1[B]2
determinare: a) l’ordine della reazione rispetto ad A; b) l’ordine della reazione rispetto a B; c) l’ordine complessivo per la reazione.
Rispondere, inoltre, alle seguenti domande: d) Che succede alla velocità della reazione raddoppiando la concentrazione di A? e) E raddoppiando la concentrazione di B?
15) Individuare, nel grafico riportato, I) l’energia di attivazione per la reazione A–>B ,II) l’energia di attivazione per la reazione B–>A

16) Basandosi sul seguente diagramma energetico, il composto________si formerà più velocemente a partire da B. Il composto più stabile è_____perchè_____________________________________________________________.
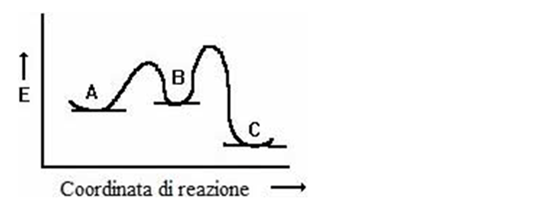
17) Di seguito è mostrato il diagramma energetico di una reazione.
a) individuare lo stato di transizione;
b) dire se la reazione è esoergonica o endoergonica;
c) cosa possiamo dire circa la costante di equilibrio di questa reazione?
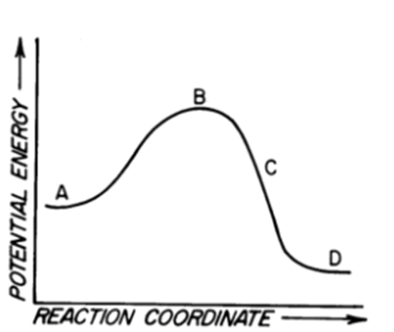
18) Rispondere alle seguenti domande sul diagramma energetico mostrato in basso
a) di quanti stadi si compone la reazione?
b) quanti e quali intermedi si formano?
c) quanti e quali stati di transizione?
d) qual è lo stadio cineticamente determinante?
e) si tratta di una reazione esoergonica o endoergonica?
f) quale sarebbe l’effetto dell’aggiunta di un catalizzatore?

19) Disegnare il diagramma energetico della reazione del 3-metil-1-butene con HBr. Mostrare le strutture dello stato di transizione e degli intermedi di reazione
20) In un tipico diagramma di reazione, a cosa corrisponde l’asse delle ascisse?
a) variazione di energia libera
b) coordinata di reazione
c) temperatura
d) variazione di entalpia
e) variazione di entropia
21) Quale tra le seguenti è la relazione corretta che intercorre tra la variazione di energia libera di Gibbs e la costante di equilibrio di una reazione chimica?

22) Si definisce stato di transizione di una reazione:
a) una delle strutture di risonanza dei reagenti
b) la struttura a più bassa energia associata ad un certo stadio della reazione
c) un carbocatione
d) la struttura intermedia tra reagenti e prodotti, isolabile e relativamente stabile
e) la struttura a più alta energia associata ad un certo stadio della reazione.
23) Quale delle seguenti coordinate di reazione è relativa ad una reazione esoergonica che procede con la formazione di un intermedio?

24) Assumendo condizioni standard e in riferimento alla seguente coordinata di reazione, quale delle seguenti affermazioni è sicuramente vera?

25) Data la seguente coordinata di reazione, la freccia rossa indica:

26) Osservando il seguente diagramma di coordinata per la reazione che da A porta a D, rispondere alle seguenti domande
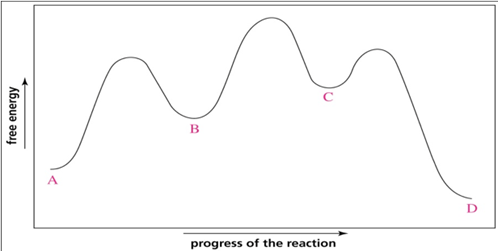
a) quanti intermedi ci sono nella reazione?
b) quanti stati di transizione ci sono?
c) qual è lo stadio più veloce nella reazione?
d) chi è più stabile A o D?
e) qual è il reagente nello stadio determinante la velocità?
f) il primo stadio della reazione è esoergonico o endoergonico?
g) la reazione, nel complesso, è esoergonica o endoergonica?
27) Molte reazioni sono più veloci ad alte che a basse temperature. Questo è in accordo con:
(I) Un aumento della energia di attivazione all’aumentare della temperatura
(II) Un aumento della costante cinetica all’aumentare della temperatura
(III) Un aumento della frequenza di collisioni efficaci all’aumentare della temperature.
a)Solo I
b)Solo II
c)Solo III
d)Solo I e II
e)Solo II e III
28) Analizzare il diagramma di energia libera/coordinata di reazione dell’addizione di HBr al 2-metilpropene e rispondere ai seguenti quesiti.

a) Cosa possiamo dire circa la Keq della reazione?
b) Cosa possiamo dire circa il ΔG° della reazione?
c) Di quanti stadi si compone la reazione?
d) Qual è lo stadio cineticamente determinante?
e) Indicare sul grafico l’energia di attivazione relativa allo stadio cineticamente determinante.
f) Cosa sono, rispettivamente, B, C e D?
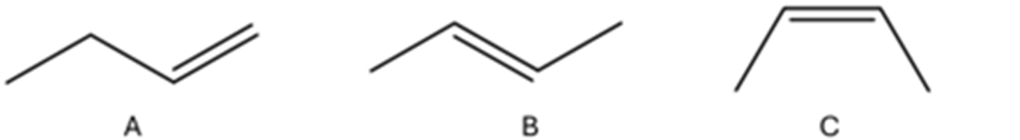
29) Disponi i seguenti composti in ordine di calore di idrogenazione decrescente

30) Disponi i seguenti composti in ordine di calore di idrogenazione crescente, motivando la scelta
Nel file seguente trovate le soluzioni degli esercizi 8,9;11,13 e 19:
https://drive.proton.me/urls/D6CYBGKDRG#laH2LZm1MSzB
Per tutti gli altri esercizi, è possibile ottenere le correzioni commentando il post ed inserendo le vostre risposte (che successivamente saranno corrette dalla docente)
La correzione dell’esercizio 12 sarà pubblicata successivamente
LikeLike
Prof buongiorno, mi scusi il disturbo, volevo chiederle nell’esercizio 15 l’energia di attivazione per la reazione inversa è E?
LikeLiked by 1 person
Sì
LikeLike
ok perfetto, grazie mille
LikeLike
Esercizio 12 https://drive.proton.me/urls/S8EBVMDRE4#IFM6GWbyFgZb
LikeLike