Acidi e basi II

1. a) L’acido metansolfonico (CH3SO3H) ha un pKa di circa -2, mentre l’etanolo (CH3CH2OH) ha un pKa di circa 16. Qual è l’acido più forte e quali caratteristiche strutturali giustificano questa grande differenza in termini di forza acida? (Suggerimento: scrivere le strutture di Lewis dei due composti).
b) Secondo te, l’acido trifluorometansolfonico (CF3SO3H) è più o meno acido dell’acido metansolfonico (CH3SO3H)? Perchè?
2. Se la Ka dell’acido formico è 1.7 x 10-4, il suo pKa sarà:
A) 1.7 B) 10.3 C) 4.0 D) 3.8 E) -2.3
(Provare a risolvere l’esercizio senza utilizzare la calcolatrice)
3. Quando il metanolo (CH3OH) si comporta da base, il suo acido coniugato è:
A) CH4OH B) CH3OH2+ C) CH3O– D) –CH2OH
4) Scrivi i prodotti delle seguenti reazioni acido-base e indica dove è spostato l’equilibrio

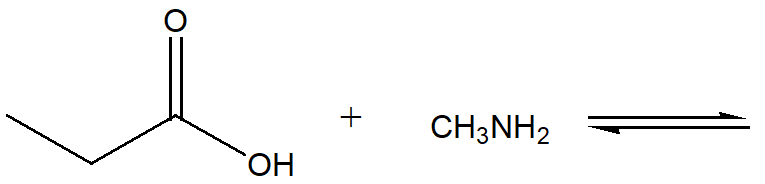
5) a) L’etene, CH2CH2, ha pKa = 44. Scrivere l’equazione che mostra dove è spostato l’equilibrio in una reazione con OH–. b) Poi, scrivere l’equazione della reazione dell’etene con –NH2. Quale sarà, tra le due, la base migliore per rimuovere il protone dall’etene? (pKa NH3 = 36, pKa H2O = 15.7)
6) Rispondere ai seguenti quesiti:
a) A quale valore di pH la concentrazione della forma basica di un composto con pKa 6.2 è 100 volte maggiore rispetto alla forma acida?
b) A quale valore di pH la concentrazione della forma acida di un composto con pKa 3.4 è 10 volte maggiore rispetto alla forma basica?
c) A quale valore di pH il 50% di un composto con pKa 7.2 si troverà in soluzione nella forma basica?
d) A quale valore di pH la concentrazione della forma basica di un composto con pKa 5.2 è 100 volte maggiore rispetto alla forma acida?
e) A quale valore di pH il 50% di un composto con pKa 6.4 si troverà in soluzione nella forma acida?
f) Quale sarà il rapporto tra forma acida e forma basica per un composto con pKa 5.0 in una soluzione a pH 4.0?
g) Quale sarà il pKa di un composto che a pH=7.5 è presente in soluzione in un rapporto forma acida:forma basica pari a 10:1
(PRIMA di svolgere questo esercizio, si consiglia di consultare il problema risolto presente sul libro a pagina 73-problema 44).
7) Per ciascuno dei seguenti composti, scrivi la forma predominante a pH 3; 6; 10; 14
a) CH3CH2OH (pKa= 15,9)
b) CH3COOH (pKa= 4,8)
c) CH3CH2NH3+ (pKa= 11,0)
8) La molecola mostrata di seguito è l’acido lisergico, quale sarà l’idrogeno più acido?
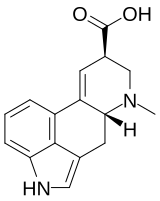
Curiosità: L’acido lisergico è un composto prodotto dal fungo Claviceps purpurea, anche noto come Ergot o Segale Cornuta, parassita delle graminaceae. Se assunto in certe dosi, l’acido lisergico, causa una sindrome nota come ergotismo (sindrome relativamente diffusa in passato a causa del consumo di cereali infettati dal fungo). Un derivato dell’acido lisergico, l’LSD è una potente droga allucinogena.
9) Fornire una definizione di acido e base di Lewis
10) Quali dei seguenti composti sono basi di Lewis? Quali sono acidi di Lewis? a) AlCl3 b) PH3 c) H2S d) H2O e) BH3
Soluzioni: https://drive.proton.me/urls/QYB6KFMBQ0#tBeHnBbePdtE
LikeLike