Esercizio opzionale

Per chi volesse ragionare ulteriormente sull’esercizio opzionale proposto nella prova di oggi, segue la traccia dell’esercizio in questione.
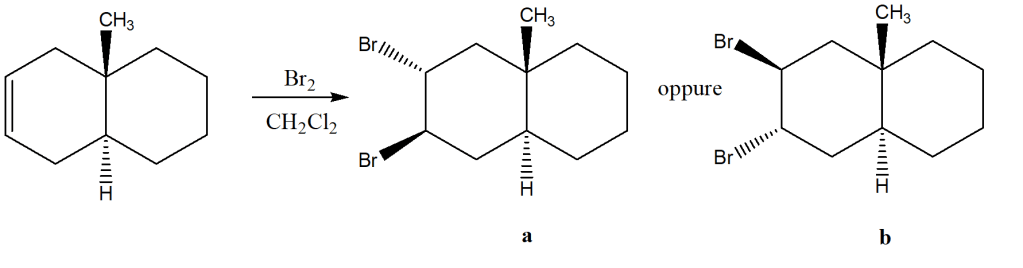
La reazione del seguente bicicloalchene con bromo porta alla formazione di un trans-dibromuro. Tra i due prodotti che è ipoteticamente possibile formare (a/b), se ne forma solo uno. Specificare quale, giustificando la risposta.
Suggerimento:
Non rispondere in maniera frettolosa, ma tener conto del meccanismo di reazione, facendo attenzione anche ad eventuali vincoli dovuti alla struttura del composto di partenza, degli intermedi di reazione e del prodotto.
Si consiglia anche di rivedere il materiale didattico con voi condiviso
Si forma solo il composto a. Nel composto a il metile ed il bromo sono ai lati opposti tra loro ed in questo modo è molto ridotta la tensione sterica rispetto al composto b dove il metile ed il bromo sono entrambi dallo stesso lato del piano. Essendo il composto a di stabilità maggiore anche lo stato di transizione sarà di stabilità maggiore e quindi con un energia di attivazione minore e la sua formazione più veloce.
LikeLike
Non è così banale come sembra: qui trovate altri suggerimenti https://chimicaorganicadistabif.com/2023/11/19/weekend-organic-chemistry-challenge-riproviamo/
LikeLike
Allora, dovendo cambiare ragionamento ho deciso di disegnare le conformazioni a sedia dei due prodotti e mi sono accorta di una cosa: nel composto a, nonostante i due atomi di bromo sono opposti tra loro hanno una tensione sterica più alta perché uno si trova in equatoriale verso il basso ed un altro in equatoriale verso l’alto (sembra che si scontrano); mentre nel composto b i due atomi di bromo sono sempre opposti tra loro ma con una disposizione più favorevole a livello energetico perché c’è meno interazione tra le nubi elettroniche, uno in assiale verso l’alto ed uno in assiale verso il basso. A questo punto ho pensato di ragionare su come avviene l’attacco da parte dello ione bromuro per arrivare a quella disposizione più stabile. Lo ione bromuro attacca un carbonio legato al bromo nello ione bromonio, e l’altro bromo resta legato all’altro carbonio, questo per la lacuna elettronica presente sui carboni visto che gli elettroni di legame sono attratti verso il bromo. Ora, secondo me il legame e quindi l’attacco da parte del bromo avviene dal basso. Se il bromo sia avvicina da davanti al piano di osservazione si scontra col metile, che non può andare incontro a facile rotazione a causa della rigidità della struttura di partenza, il metile è legato ad uno dei due carboni che tengono legati i due cicli. Quando si avvicina dal basso, il legame del carbonio col bromo nello ione bromonio si rompe, questi elettroni di legame vanno verso il bromo che rimane legato all’altro carbonio davanti al piano di osservazione (cuneo verso l’alto e posizione assiale verso l’alto), sempre perché deve avvenire in anti per minimizzare la repulsione tra i due sostituenti che si legano, l’altro bromo (quello che si avvicina dal basso) si lega all’altro carbonio in posizione opposta dall’altro (cuneo con tratteggio, posizione assiale verso il basso), e poiché l’attacco dal basso è più favorevole energeticamente garantisce anche una migliore sovrapposizione degli orbitali quando si forma il legame, quindi dei legami più stabili. Quindi si forma solo il composto B perché più stabile.
LikeLike
Perchè affermi che B è più stabile? In ogni caso il punto su cui ragionare non è la stabilità del prodotto, ma il meccanismo di reazione (ovviamente tenendo conto di aspetti importanti, quale ad es. la stereochimica della reazione con particolare attenzione al fatto che si tratta si un cicloesene che fa parte di un sistema di due anelli condensati). Vedi il materiale didattico sulle reazioni degli alcheni per le reazioni dei cicloeseni.
LikeLike
Terzo tentativo
La struttura di partenza è un sistema di due anelli condensati, quindi ci sono due carboni adiacenti in comune tra questi due cicli che legano due sostituenti in trans tra loro, tra cui il metile in assiale verso l’alto. E’ una struttura molto rigida e questo determina una limitata ibertà di movimento attorno alla giunzione, soprattutto perché il metile tenderà a disporsi in modo tale da minimizzare la tensione sterica con gli altri idrogeni della struttura.
Meccanismo
Quando si forma lo ione bromonio, l’anello a tre termini è molto instabile e reagirà con il nucleofilo che c’è in soluzione, in questo caso lo ione bromuro. L’attacco avviene sul lato meno ingombrato del composto, Br- è “obbligato” ad attaccare il carbonio meno ingombrato perché dall’altro lato c’è il metile che è come se fosse un ombrello che limita l’accesso all’altro carbonio. E poiché non ci può essere facile rotazione, la direzione è obbigata. La stereochimica è in anti, i due atomi di bromo si dispongono in posizione antiperiplanare l’uno dall’altro e quindi questo suggerisce che l’attacco dello ione Br- quando si rompe l’anello a tre termini deve avvenire in modo che i due Br siano in relazione diassiale.
Br- attacca da retro rispetto al metile e quindi sarà disposto opposto ad esso, e il bromo dell’anello si dispone in anti rispetto allo ione bromuro che sta attaccando sempre per questioni steriche; così facendo l’unico prodotto della soluzione sarà il composto che, disegnando la conformazione a sedia, avrà i due atomi di bromo in posizione assiale antiperiplanare, quindi il composto B.
LikeLike
l’attacco dello ione bromuro in questo modo massimizza l’interazione in fase dell’orbitale Homo pieno di Br- e Lumo vuoto del carbonio che accetta l’attacco, quindi interazione legante del legame C-Br che si forma appunto dall’attacco in opposto al metile. Interazione che non è ottimale nel caso di attacco al carbonio ingombrato appunto per ragioni di ingombro sterico.
LikeLike