Weekend Organic Chemistry Challenge…riproviamo

Regolamento:
- Vincerà la sfida chi risponderà per primo CORRETTAMENTE al seguente quesito
- La risposta dovrà essere inserita come commento al post.
- Ognuno può rispondere solo una volta (anche in presenza di più di un commento pubblicato dalla stessa persona, soltanto il primo sarà preso in considerazione).
- La challenge sarà aperta fino alla mezzanotte di oggi.
- Il vincitore (2 punti) sarà annunciato lunedì a lezione.
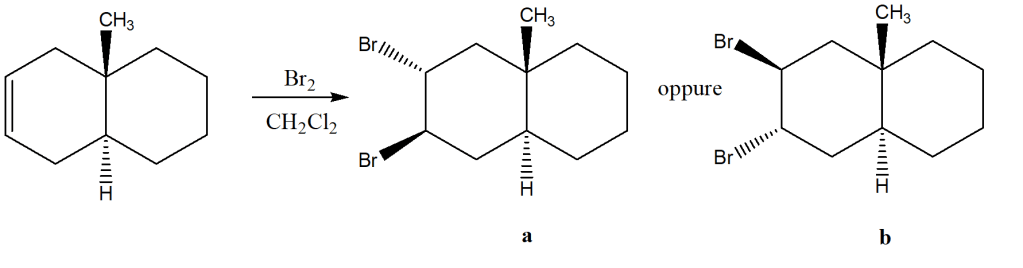
Dato che nessuno ha vinto la challenge di ieri, vi sarà data una seconda possibilità…L’unico prodotto formato è b. Ora, sulla base di questa informazione, a voi la possibilità di dare una spiegazione…
Qui il link alla challenge precedente, con il quesito originale.
Un ulteriore suggerimento da aggiungere al precedente: ragionate su come devono formarsi i legami a seguito dell’attacco in anti (potrebbe essere utile pensare agli orbitali coinvolti)…e sul tipo di giunzione dei due cicloesani…
Credo che il motivo possa essere questo: si tratta di due cicloesani con giunzione trans, ragionando su tutti i conformeri possibili, nel conformero a barca se i due sostituenti (Br e CH3) si trovassero in anti tra di loro ci sarebbe troppa repulsione tra le nubi elettroniche, questo è dovuto alla posizione dei sostituenti ad asta di bandiera. Repulsione che invece verrebbe minimizzata se si disponessero sullo stesso lato del piano cioè entrambi verso l’alto. Per questo motivo il più stabile è il conformero B
LikeLike
mi sono riferita ai due sostituenti che nell’immagine sono mostrati verso l’alto, di conseguenza quelli ad asta di bandiera devono stare in anti
LikeLike
Ragionandoci bene, l’UNICO PRODOTTO della nostra reazione è B. Questo si deve alla disposizione degli orbitali di legame nello spazio. Infatti, inizialmente i carboni che presentano il doppio legame sono ibridati sp2. L’ibridazione sp2 comporta che gli orbitali siani giacenti su un piano e trigonalo tra loro. Questo comporta che l’orbitale P non ibridato sia perpendicolare a questi con i due lobi rivolti verso l’alto e verso il basso. L’attacco in B porta i due atomi di bromo in posizione assiale, incontrando dunque i due lobi (una volta quello verso l’alto, l’altro verso il basso) con cui instaurare il legame, cosa che invece non è possibile e che non succede in A quando l’attacco avverebbe in posizione equatoriale (non è presente alcun orbitale a cui legarsi in quella posizione!). In seguito a queste considerazioni l’unico prodotto possibile è B.
LikeLike
il composto di partenza è un cicloalcano condensato con giunzione trans, ed è per questo che il gruppo metilico e l’idrogeno mostrati al centro, sono in anti tra loro.
Tenendo in considerazione la struttura di questo composto, si può apprendere che la formazione dello ione bromonio ciclico, vede il coinvolgimento di un legame assiale di un carbonio, ed uno equatoriale del carbonio adiacente nel caso di un conformero a sedia, oppure, se facciamo riferimento al conformero a barca, due legami assiali dei due carboni che in partenza formavano il doppio legame, oppure due equatoriali: il bromo carico positivamente, e di conseguenza il ciclo a tre termini, può essere rivolto verso l’osservatore o lontano dall’osservatore.
La mia idea è che il ciclo si formi rivolto verso il basso, in maniera tale da non collidere con la nube elettronica del gruppo metilico, e permettendo un’interazione stabilizzante con l’orbitale di antilegame del legame C-C del metile. Proprio questa potrebbe essere la ragione per cui il bromo del ciclo a tre termini “riesce a discriminare” su quale carbonio rimanere legato a seguito dell’attacco da parte dello ione bromuro (cioè se tra quello in alto a sinistra o in basso a sinistra nella foto): in un conformero a sedia, questa interazione descritta potrebbe essere possibile poiché il legame C-C del metile e il legame C-Br, sono tra loro paralleli, così come gli orbitali di legame e antilegame. A quel punto, la “scelta” dello ione bromuro è obbligata, perché deve avvenire in anti rispetto al bromo (lontano dall’osservatore ) e necessariamente sul carbonio più prossimo al gruppo CH3 stesso, per colmare la lacuna elettronica che si forma dalla dissoluzione dello ione bromonio, legandosi, di conseguenza, in anti rispetto al bromo come descritto dal meccanismo di alogenazione, ma in sin rispetto al metile.
LikeLike