Weekend Organic Chemistry Challenge

Regolamento:
- Vincerà la sfida chi risponderà per primo CORRETTAMENTE al seguente quesito
- La risposta dovrà essere inserita come commento al post.
- Ognuno può rispondere solo una volta (anche in presenza di più di un commento pubblicato dalla stessa persona, soltanto il primo sarà preso in considerazione).
- Il tempo massimo a disposizione sarà di 24h dalla pubblicazione del post.
- Il vincitore (2 punti) sarà annunciato lunedì a lezione.
Dire quale tra i due composti mostrati di seguito è il più basico, motivando la risposta:
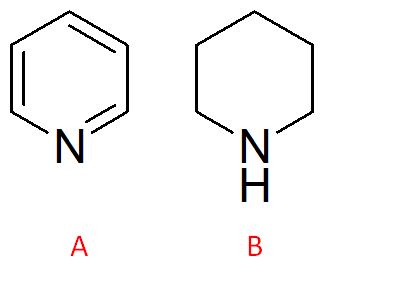
il composto più basico è il composto “a” in quanto in entrambi i composti, tutti gli atomi di Carbonio sono implicati in 4 legami e l’unica specie che può accettare un portone e l’azoto che, essendo ibridato sp2 presenta un doppietto libero con cui legare uno ione H+
LikeLike
Il più basico dovrebbe essere A perché l’idrogeno legato all’atomo che meglio regge la carica negativa(più elettronegativo) è quello del legame N-H di B, in più in A possiamo avere anche legami sp2(più elettronegativo di un legame sp3) e anche risonanza
LikeLike
B è il composto più basico poiché l’azoto nella figura B presenta un’ibridazione sp3 data dal legame con due Carboni, l’idrogeno e la coppia solitaria. Mentre la figura A presenta un’ibridazione sp2 per i legami(tra cui un doppio legame) con due Carboni e la coppia solitaria. L’ibridazione sp2 sta ad indicare una maggiore acidità del composto per via del maggior carattere s rispetto al l’ibridazione sp3, di conseguenza sarà la figura B ad essere il composto più basico.
LikeLike
il primo è il composto più basico perché avendo ibridazione sp2, è più stabile e quindi più basico
LikeLike
Il composto B è quello più basico poiché è caratterizzato dall’atomo che si protonerà con più facilità.
Inoltre il composto A presenta un’ibridazione sp2 dato dalla presenza dei doppi legami, quindi vi sarà un quantitativo maggiore di s, mentre il composto B presenta un’ibridazione sp3 per la presenza di legami singoli.
LikeLike
Deprotonare ***
LikeLike
il composto A è più basico del composto B per la presenza di una coppie di elettroni non condivisa (che si trova nell’orbitale sp2) dell’atomo di Azoto, perciò in ambienta acido tende a protonarsi più facilmente.
LikeLike
Il composto più basico sarà il composto A perché, anche se esso è più stabile grazie ai legami sp2, nel composto b è presente il gruppo NH che supporta meglio la carica negativa
LikeLike
Il composto B è il più basico. A causa della risonanza presente nel composto A, l’N rende più acida la molecola per effetto elettron-attrattore. Di conseguenza la molecola B è più basica
LikeLike
Il primo composto è una base più debole (più stabile) della seconda in quanto il suo doppietto elettronico di non legame si trova in un orbitale sp2 e il suo acido coniugato è più forte rispetto all’acido coniugato del secondo.
LikeLike
Secondo me il composto più basico è il composto B perché nel composto A c’è anche il doppio legame con ibridazione sp2 mentre nel composto B ci sono solo legami singoli con ibridazione sp3 e sappiamo che un atomo legato ad un carbonio ibridato sp2 è più elettronegativo perché ha un maggiore carattere s ed è più vicino al nucleo.
LikeLike
il composto più basico è il composto B, questo perchè il composto A esiste come ibrido di risonanza dunque la carica negativa viene condivisa fra i vari carboni con conseguente diminuzione della densità elettronica (maggiore volume) e quindi risulterà la base coniugata più debole e stabile (rispetto a quella del composto B) risultando così nettamente più acida. Il composto B presenta la sua base coniugata più instabile così risulta che essa sia meno acida e dunque la sostanza fra le due più basica. Inoltre l’azoto del composto B ha ibridazione sp3 con conseguente minore carattere s rispetto all’azoto del composto A ibridato sp2, l’ibridazione sp3 permette quindi una minore elettronegatività e di conseguenza una minore acidità che fa si che il composto più basico sia appunto il composto B
LikeLike
Il composto B è più basico, in quanto presenta in modo localizzato la carica negativa nella sua base coniugata a differenza del composto A più acido per l’ibridazione sp2 e per la delocalizzazione elettronica, la cui base coniugata avrebbe un ibrido di risonanza più stabile e di conseguenza più debole.
LikeLike
Il composto più basico è B.
Perché il composto A, presenta dei doppi legami, quindi ha ibridazione del tipo sp2.
Il composto B ha ibridazione sp3 (legami singoli).
l’sp2 presenta un carattere s maggiore rispetto all’sp3 e sono anche più vicini al nucleo, quindi questo contribuirà a rendere l’’atomo legato ad carbonio sp2 più elettronegativo, di conseguenza piu acido.
LikeLike
La molecola B è quella più basica.
Questo poiché la basicità di una molecola è la sua capacità di attrarre a sé ioni H+, grazie al doppietto elettronico. Quindi in questo caso più il doppietto elettronico rimane sull’atomo di azoto, più la molecola è basica.
Nella molecola A il doppietto elettronico può essere delocalizzato, di conseguenza la molecola B sarà quella più basica.
LikeLike
Il composto A è più basico siccome la coppia di elettroni risiede in un orbitale sp2 con maggiori carattere s rispetto al composto b che la coppia di elettroni risiede in un orbitale sp3 che ha minore carattere s. E quindi un maggiore carattere s porta ad una maggiore stabilità e quindi una basicità maggiore.
LikeLike
Il composto più basico è la B, in quanto presenta ub ‘ibridazione del tipo Sp3.
LikeLike
Il composto B risulta essere quello più basico poiché contiene l’atomo che si protonerà più facilmente.
Inoltre, il composto B risulta essere più basico del composto A poiché, in quest’ultimo, essendo presenti dei doppi legami, avremo un’ibridazione del tipo sp2, mentre nel composto B avremo un’ibridazione del tipo sp3. L’ibridazione sp2 presenta un carattere s maggiore rispetto ad sp3, e saranno anche più vicini al nucleo; ciò contribuisce a rendere l’atomo legato al carbonio sp2 più elettronegativo e quindi più acido. L’ibridazione di tipo sp3 consente un’elettronegatività inferiore e, quindi, il composto B risulta essere quello meno acido, cioè il composto più basico tra i due.
LikeLike
Rileggendo la risposta data in precedenza ho visto che ho scitto il contrario di quello che volevo dire quindi se va bene mi vorrei correggere:
Il composto A è il meno basico siccome la coppia di elettroni risiede in un orbitale sp2 con maggiori carattere s rispetto al composto b che la coppia di elettroni risiede in un orbitale sp3 che ha minore carattere s. E quindi un maggiore carattere s porta ad una maggiore stabilità e quindi una minore basicita. Il composto più basico è B
LikeLike
Il composto più basico è B perché è l’atomo che porta la carica negativa è ibridato sp3 (rispetto al composto A che è ibridato sp2) dunque è meno elettronegativo, meno stabile e la base è più forte
LikeLike
Il composto A è il più basico in quanto l ‘ atomo di azoto ha un elettrone non appaiato e può accettarlo facilmente da una specie acida.
LikeLiked by 1 person
Secondo me il composto più basico è la lettera B perchè l’azoto in questo composto è ibridato sp3, mentre nel composto A l’azoto è ibridato sp2, dato che si tratta di confrontare uno stesso atomo in due strutture differenti andremo a guardare in questo caso come sono ibridati, e quindi posso affermare ciò perchè orbitale ibridi sp2 somo più elettronegativo rispetto a quelli sp3 poiché abbiamo una maggiore presenza del carattere s e quindi si troverà più vicino al nucleo
LikeLike
Sebbene il ritardo, ci tengo a dare la mia risposta. A mio parere il composto che presenta una basicità maggiore è il composto B. Questo perché del composto A è possibile scrivere un ibrido di risonanza, dovuto ai doppi legami presenti nel composto. Ciò comporta una maggiore stabilità del sistema dovuta ad una carica elettronegativa delocalizzata su tutta la struttura del composto. Maggiore volume, minore densità, maggiore stabilità. Questo comporta che la struttura A è un acido più forte, con conseguente basicità più debole.
LikeLike
A è il composto più basico. Questo è dovuto alla delocalizzazione per risonanza del doppietto elettronico presente sull’atomo di azoto. La densità elettronica sull’azoto diminuisce e di conseguenza anche la sua basicità.
LikeLike
il composto più basico è il composto B. Questo perché nel secondo composto non è possibile scrivere una struttura di risonanza, ciò significa che la coppia solitaria dell’azoto sarà localizzata su quest’ultimo, quindi la disponibilità della coppia solitaria dell’azoto determina la probabilità di accettare un protone e quindi la forza della base.
Se la coppia solitaria è più disponibile, l’ammina è una base più forte.
LikeLike
Il composto più basico è il composto B. Entrambi i composti hanno una coppia solitaria sull’azoto, ma nel composto A si trova in sp2 mentre nel composto B si trova in sp3. Trovandosi in sp3 può essere ceduto più facilmente e il composto si comporta da base.
LikeLike
A – è acido poiché sono presenti carboni ibridati sp2 con doppio legame ed è più stabile quindi oiu acido .
B – è la risposta corretta poiché è più basico visto che tutti i carboni sono ibridati sp3 e quindi è meno stabile e più basico con maggiore valore di pka e maggior comportamento basico
LikeLike
In entrambi i casi l’azoto presenta una coppia solitaria ma in A è ibridato sp2 (1/3 di carattere s fa sì che la vicinanza al nucleo trattenga maggiormente gli elettroni) e permette risonanza, risultando una molecola più stabile e più acida. B invece è ibridato sp3 (1/4 s) é quindi un acido meno forte ed una base più forte.
Inviato da Outlook per Androidhttps://aka.ms/AAb9ysg ________________________________
LikeLike
la base più forte è il secondo composto, questo perché il primo composto è stabilizzato per risonanza, essendo stabilizzato per risonanza sarà una base più debole che tende a reagire meno facilmente. Poichè la basicità è proprio la tendenza ad accettare un protone, la base più forte è il secondo composto
LikeLike
La challenge è chiusa…domani a lezione vedremo la soluzione
LikeLike