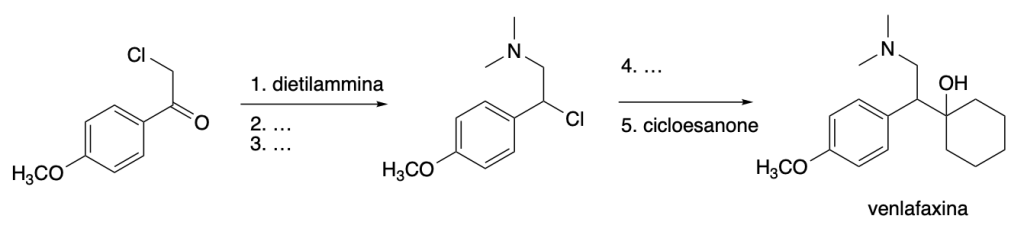
Svolgimento esercizio n. 1 del 13 novembre 2024:

Verso la terza prova intercorso: reazioni degli acheni 2
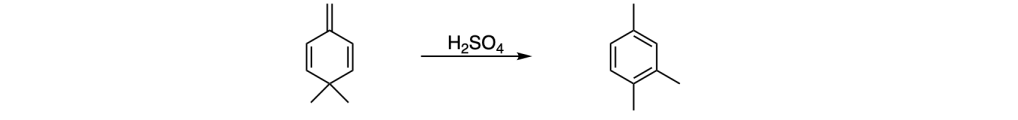
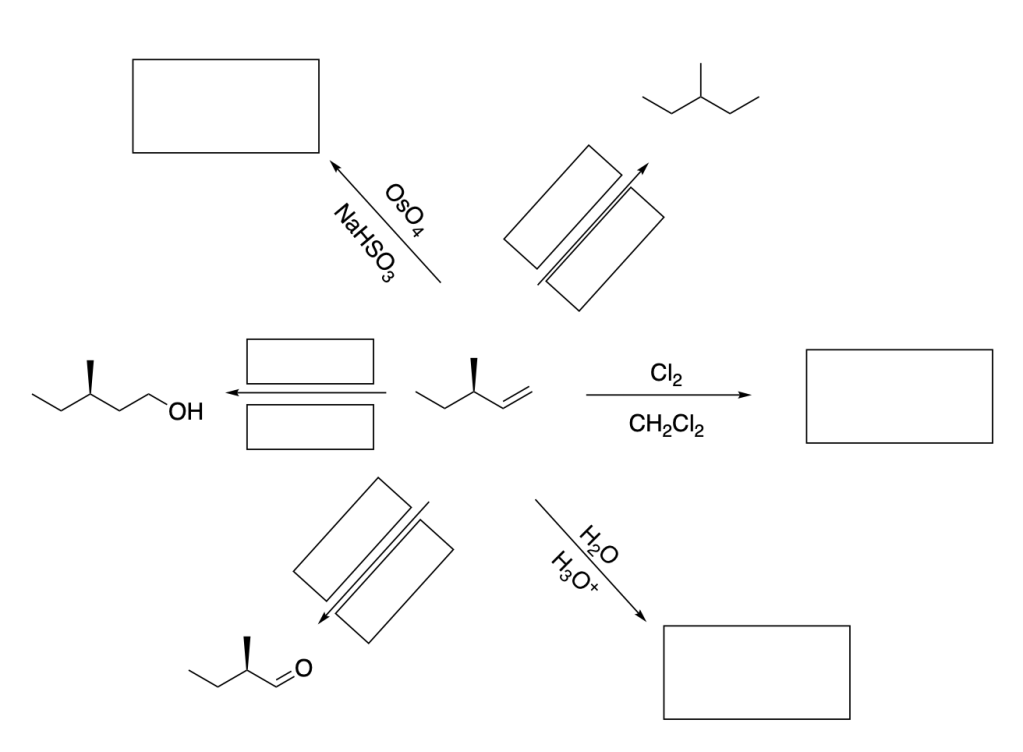
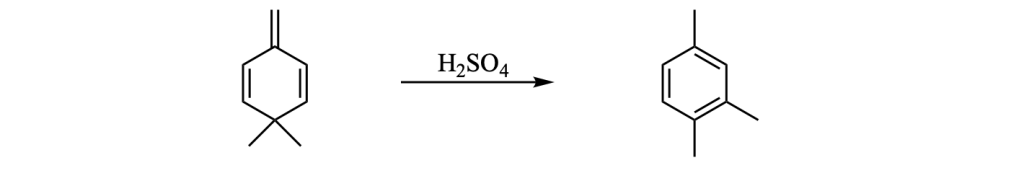
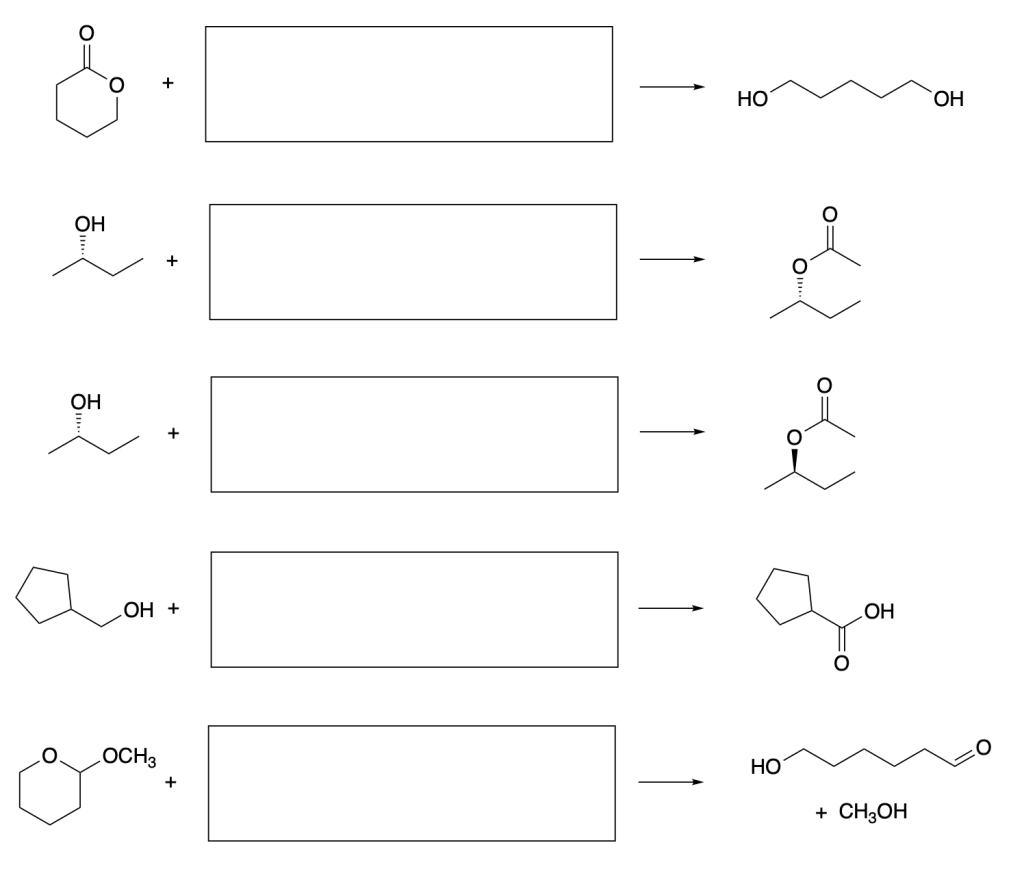
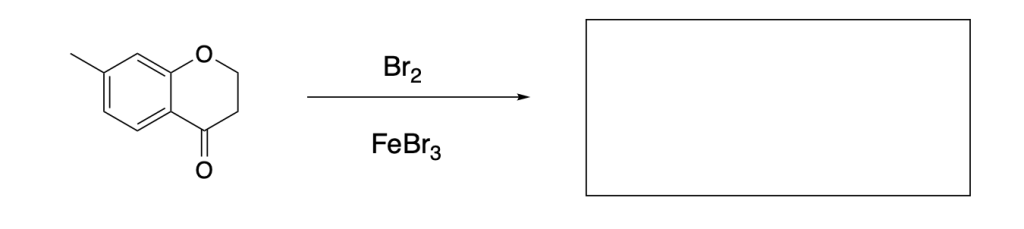
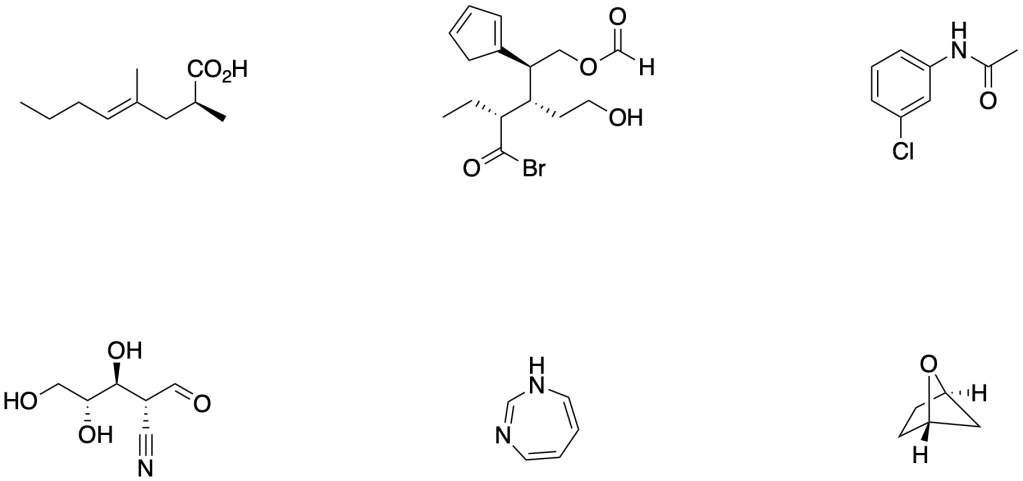
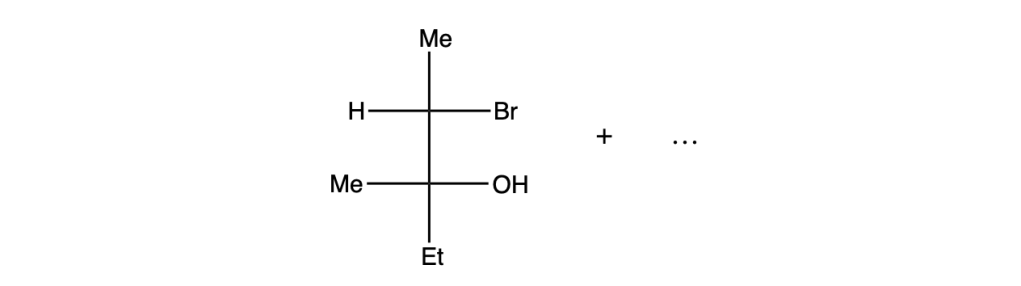
Esercizio n. 1
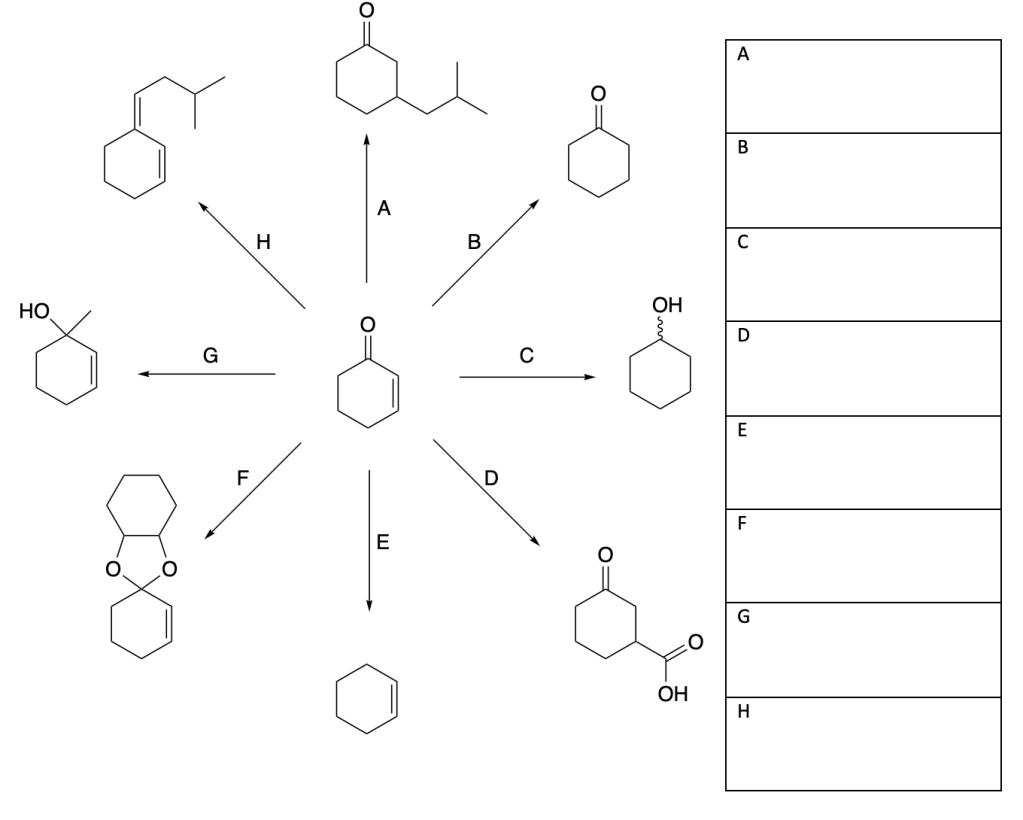
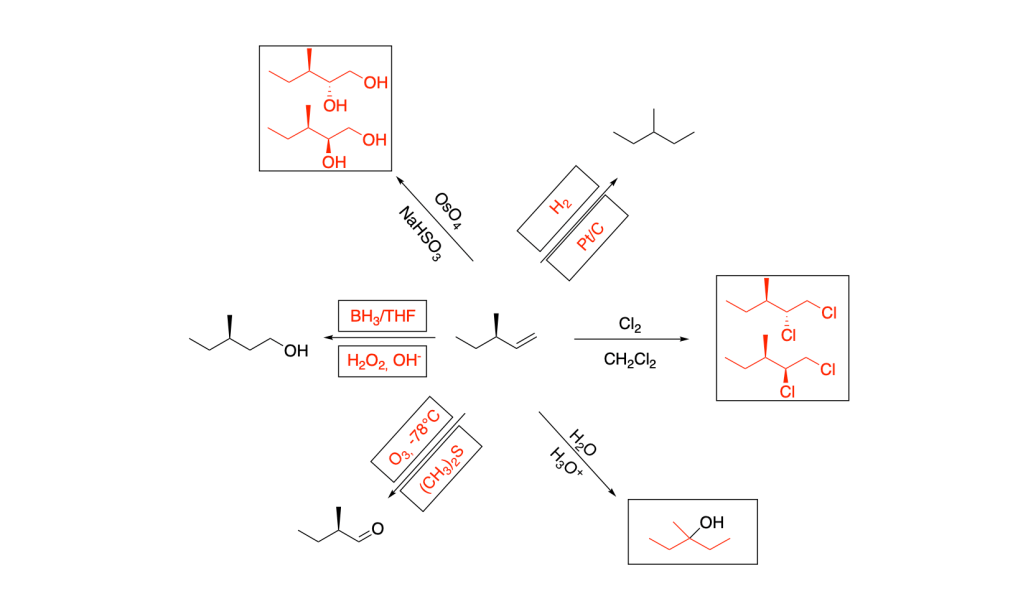
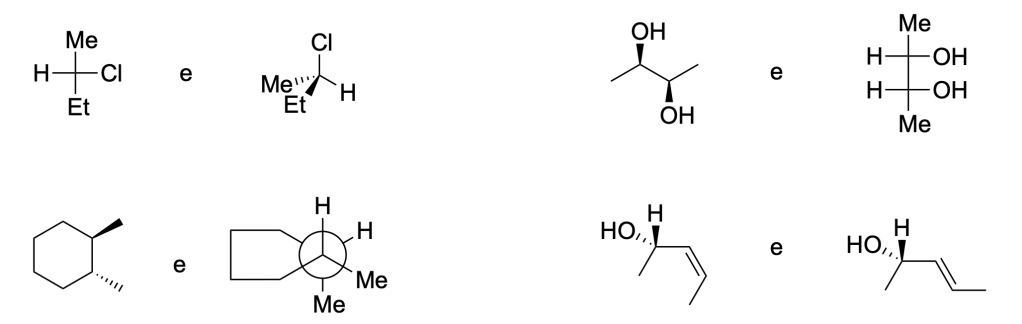
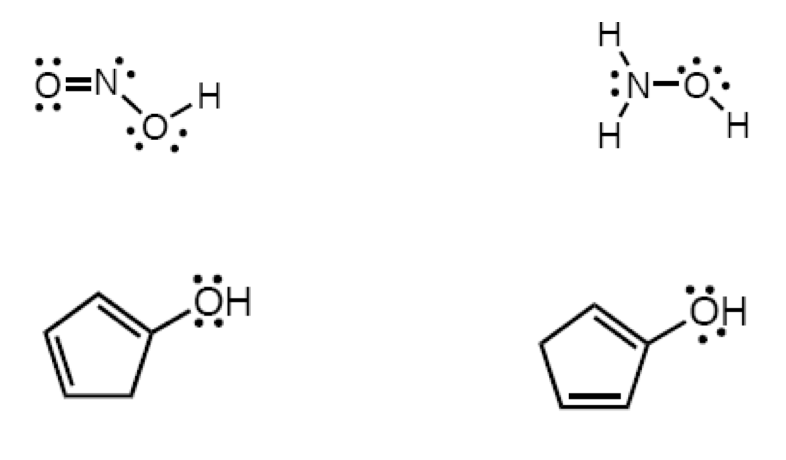
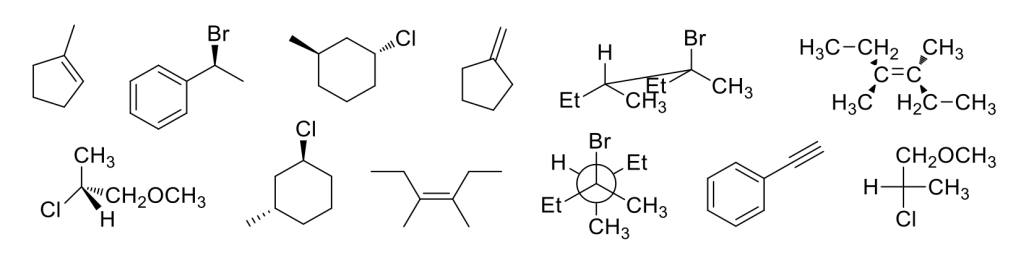
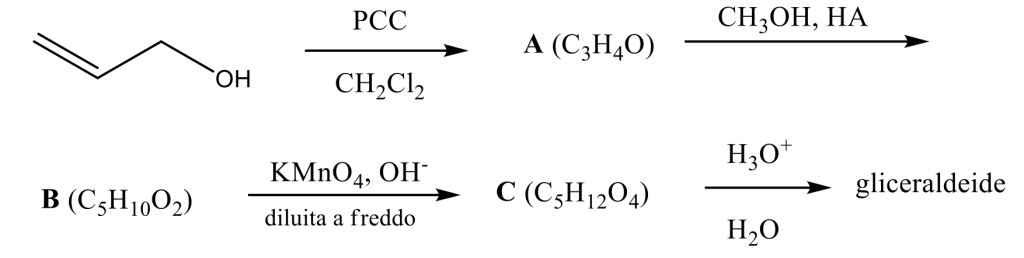
Scrivere il meccanismo delle reazioni elencate di seguito utilizzando l’(R)-6-fenil-1-metilcicloesene e qualsiasi altro reagente necessario. Per ogni reazione porre attenzione, dove appropriato, alla regioselettività, stereoselettività e alla stereospecificità. Assegnare, inoltre, il nome IUPAC ai prodotti di ogni reazione, specificandone la stereochimica e la relazione esistente tra loro (enantiomeri, diastereoisomeri, composto meso, ecc).
- Addizione di acidi alogenidrici
- Addizione di acqua, acido-catalizzata
- Ossimercuriazione (o alcossimercuriazione)-demercuriazione
- Idroborazione-ossidazione
- Addizione di alogeni
- Addizione di alogeni in presenza di acqua (o alcol)
- Idrogenazione catalitica
- sin-Ossidrilazione
- Epossidazione
- Scissione ossidativa con permanganato di potassio
- Ozonolisi
soluzione-esercizio-1.1Download
soluzione-esercizio-1.2Download
soluzione-esercizio-1.3Download
soluzione-esercizio-1.4Download
soluzione-esercizio-1.5Download
soluzione-esercizio-1.6-1Download




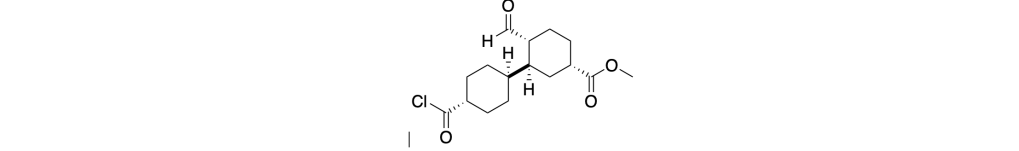
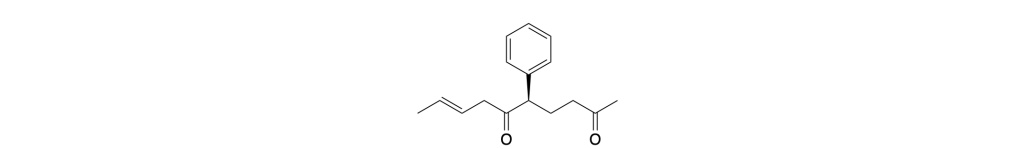

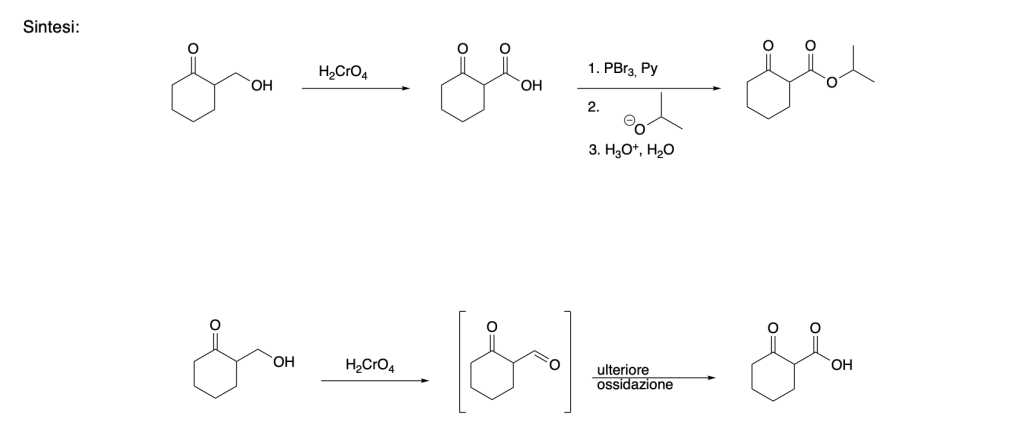
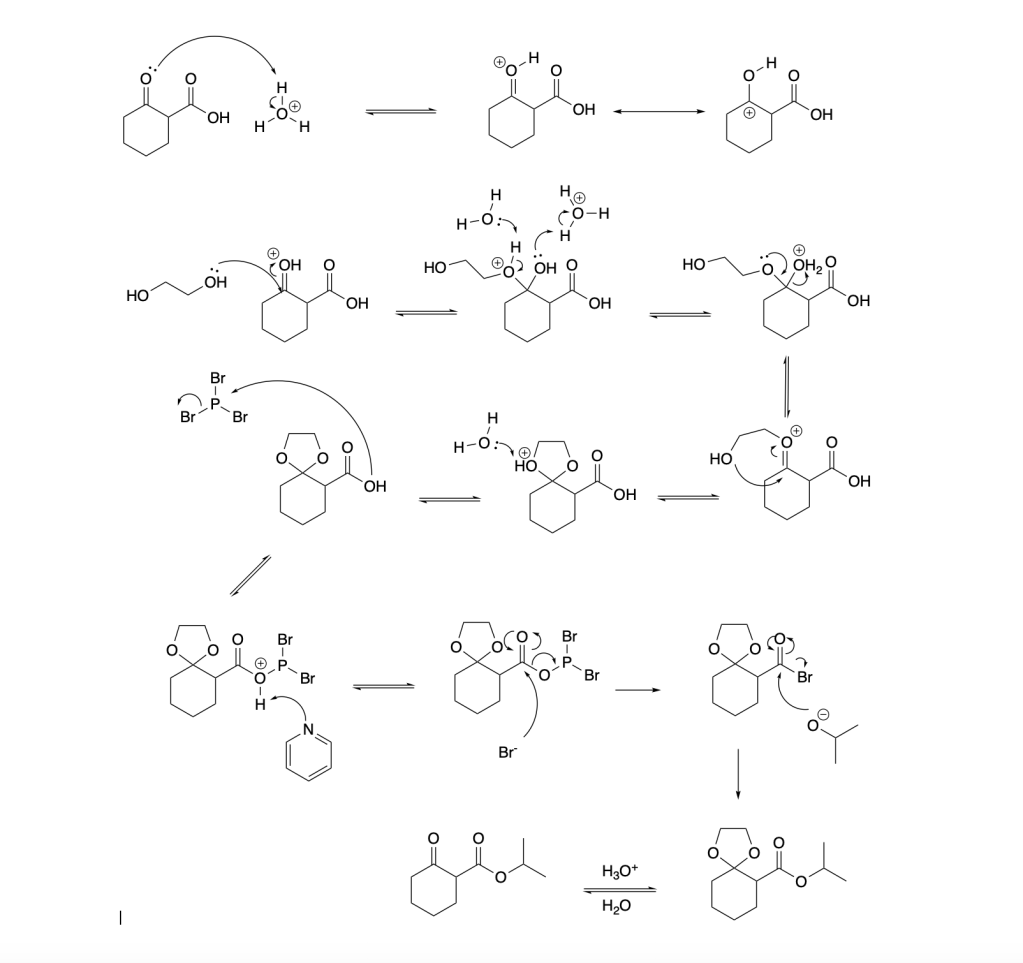


























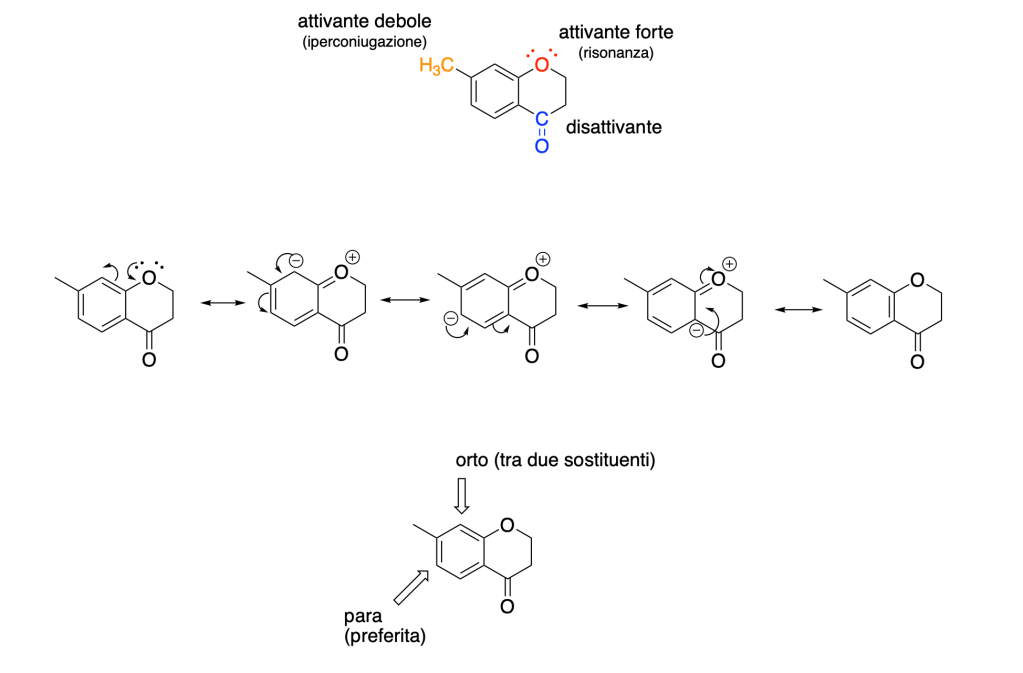

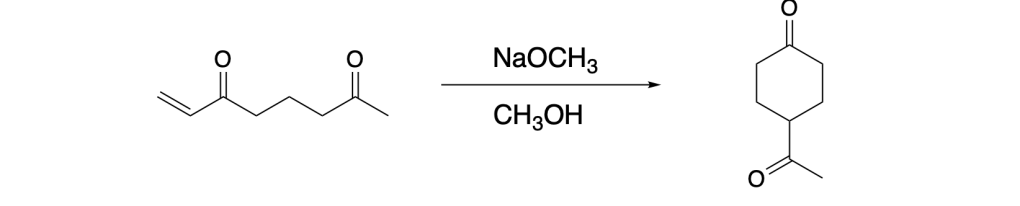


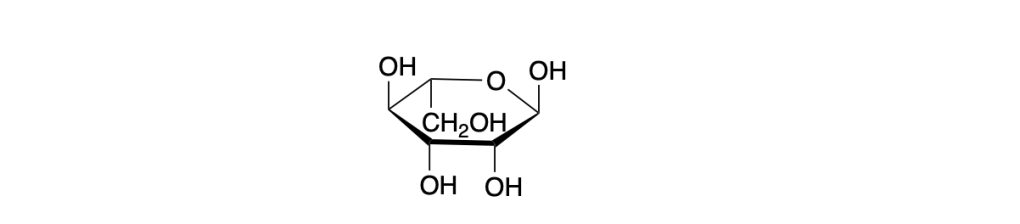


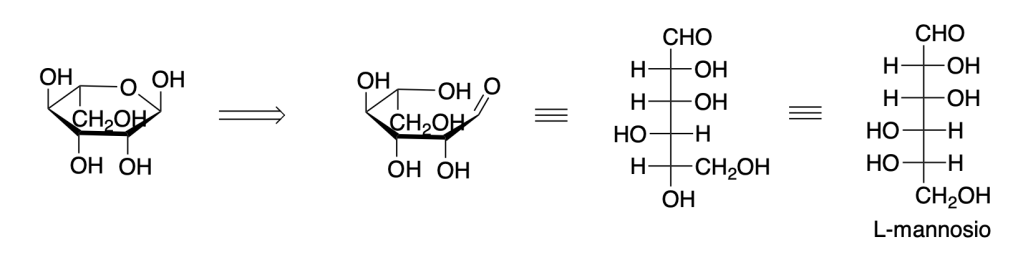














You must be logged in to post a comment.