Training X

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomenti…e a breve altre liste di domande saranno pubblicate. In ogni caso, potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti. In fondo alla lista, troverete anche una classifica del livello di difficoltà delle domande.
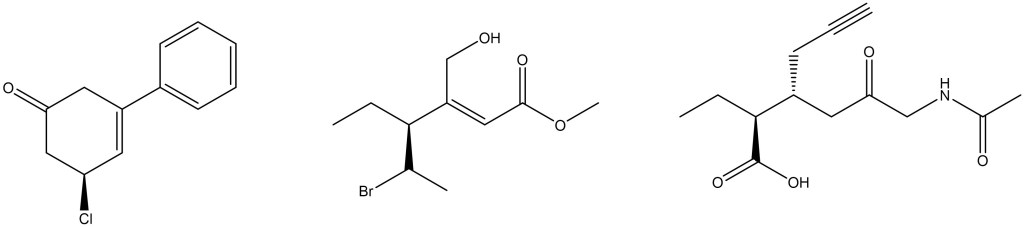
- Assegnare il nome IUPAC ai composti in alto.
- Spiegare perchè un triplo legame è più corto di un doppio legame, che è più corto di un legame singolo.
- Confrontare tra loro i legami carbonio-idrogeno di etano, etilene (=etene) e acetilene (=etino): discuterne forza e lunghezza, giustificando le differenze.
- Fare un esempio di alcol e di ammina terziari.
- Confrontare tra loro i due isomeri geometrici del 1,2-dicloroetene. Perchè si tratta di due molecole diverse, che non si interconvertono? L’assorbimento della luce da parte del doppio legame porta all’eccitazione di un elettrone dall’orbitale molecolare pi-greco a quello di molecolare di antilegame pi-greco*. Spiegare perchè questo assorbimento può portare all’interconversione dei due isomeri.
- Scrivere l’1-bromo-2-metilcicloesano. Quanti isomeri ottici sono possibili con questa struttura?
- Sceglierne uno e scrivere il prodotto principale di eliminazione E2.
- Classificare e spiegare i meccanismi di reazione studiati.
- Che cosa significa descrivere un meccanismo di reazione? Quali aspetti vanno presi in considerazione?
- Definire i parametri cinetici e termodinamici utili a capire l’andamento di una reazione.
- Che cosa si intende per calore di idrogenazione?
- Disegnare il diagramma di reazione di una reazione a due stadi, esoergonica, il cui primo passaggio sia endoergonico e quello cineticamente determinante.
- Spiegare perchè l’1,3-ciclopentadiene ha un pKa relativamente basso (circa 15).
- L’acido glutammico è un amminoacido con catena laterale (-CH2CH2COOH). I pKa dei due gruppi carbossilici sono 2.10 per uno e 4.07 per l’altro. Assegnare il valore di pKa a ciascun gruppo carbossilico e spiegare perchè uno dei due gruppi carbossilici è molto più acido dell’altro.
- La reazione dell’1-metil-1-vinilciclopentano con HCl porta principalmente alla formazione dell’1-cloro-1,2-dimetilcicloesano. Proporre un meccanismo per la sua formazione.
- Il carbocatione propenilico è un carbocatione primario, ma è molto più stabile del carbocatione 1-propilico. Spiegare perchè.
- Proporre un metodo per sintetizzare il 5-ossoeptanale a partire dal 5-cloro-2-pentanone (sono necessari più passaggi). Puoi scegliere i reattivi da utilizzare. Mostrare i meccanismi di reazione, se tra quelli studiati.
- Prendere in considerazione il butanoato di etile e il 2-pentanone. Mostrare il meccanismo di condensazione di Claisen di questi due composti.
- Il beta dichetone ottenuto in 18 ha idrogeni più acidi rispetto ai due composti di partenza. Spiegare perchè.
- Suggerire il meccanismo che, a partire da 2-cloro-1-etanolo porta alla sintesi dell’ossirano.
- Descrivi il meccanismo di apertura dell’epossido in condizione acide, basiche, neutre.
- Introdurre la reazione di sostituzione nucleofila acilica. Spiegare perchè è anche chiamata addizione/eliminazione. Fornire un ordine di reattività dei derivati degli acidi carbossilici. Spiegare in che modo la base debole favorisce il primo e il secondo passaggio della reazione.
- Mostrare il meccanismo di reazione del ciclopentanone con etanolo in ambiente acido.
- Il chetone in 23 può formare un emiacetale, ma non un acetale in ambiente basico. Inoltre, l’acetale formato in 23 può essere idrolizzato in ambiente acido, ma non in ambiente basico. Spiegare perchè.
- Fornire una definizione di carboidrati.
- Scrivere la struttura del beta-D-glucopiranosio
- Il beta-D-glucopiranosio in soluzione è in equilibrio con la forma a catena aperta e con il suo anomero. Prendere in considerazione la forma a catena aperta. Definire l’ibridazione di tutti gli atomi di carbonio.
- Nella forma a catena aperta, il carbonio 1 è un carbonio prochirale. Spiegare perchè.
- Raffigurare il legame peptidico e spiegarne le caratteristiche.
- L’acido acetilsalicilico è un importante farmaco antiinfiammatorio (e non solo). Illustrare l’importanza delle sue caratteristiche acido-base in relazione al suo trasporto e al suo meccanismo d’azione.
Grado di difficoltà delle domande:
Alto (richiedono più passaggi e/o notevole padronanza della disciplina): 17
Medio (domande che vanno al di là della mera esposizione/applicazione di concetti teorici): 5, 8, 24, 30
Basso (domande che riguardano l’esposizione di concetti teorici, la dimostrazione di semplici meccanismi di reazione, l’applicazione diretta di concetti teorici di base): tutte le domande non incluse nelle due liste precedenti.
You must be logged in to post a comment.