Training IX

Le domande che seguono possono essere utili per capire se ci sono alcune parti del programma su cui ci sono ancora dei dubbi. Attenzione: le domande non sono certamente esaustive dato che non coprono tutti gli argomenti…e a breve altre liste di domande saranno pubblicate. In ogni caso, potete utilizzarle per fare un controllo della vostra preparazione su alcuni argomenti. Se avete difficoltà a rispondere ad alcuni quesiti, è probabilmente il caso di approfondire quegli argomenti. In fondo alla lista, troverete anche una classifica del livello di difficoltà delle domande.
- Fornire una definizione di composto aromatico.
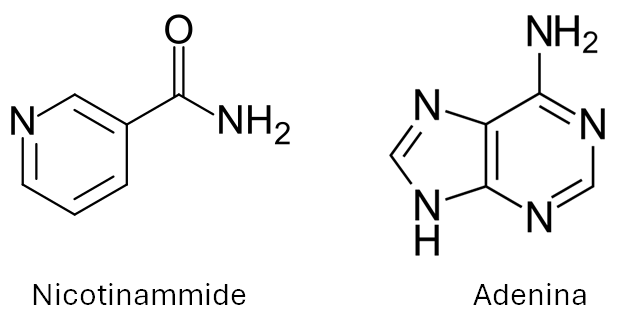
- La nicotinammide (o niacinammide), mostrata alla fine del post, è una piridina sostituita. Si tratta o meno di un composto aromatico?
- Spiegare cosa si intende per energia di risonanza o di delocalizzazione.
- Concentriamoci ora sul gruppo funzionale ammidico presente nella nicotinammide. Cosa possiamo dire circa: a) ibridazione deli atomi coinvolti; b) lunghezza dei legami e forza dei legami; c) geometria molecolare; d) reattività del gruppo funzionale.
- Cosa succede se mettiamo il gruppo funzionale ammidico in presenza di LiAlH4? (Definire solo il tipo di reazione, non il meccanismo!)
- Anche l’adenina (la cui struttura è mostrata alla fine del post) è un composto aromatico. Spiegare perchè.
- Su ciascun atomo di azoto della base azotata in questione è presente una coppia solitaria di elettroni. Dire, per ciascun atomo di azoto, in che tipo di orbitali si trova tale coppia solitaria.
- A proposito di composti aromatici, non si può non parlare del benzene. Nella reazione del benzene con Br2 è necessario utilizzare un catalizzatore. a) quale catalizzatore? b) perchè dobbiamo usare un catalizzatore? c) che tipo di reazione avviene? d) mostrare il meccanismo; e) confrontare questa reazione con quella di Br2 con il 2-butene.
- A partire da uno degli isomeri del 2-butene, sintetizzare il 2-metil-2-butene. Potrebbero essere necessari più passaggi. Indicare strategia sintetica, condizioni di reazione e meccanismi (se questi ultimi sono tra quelli che dovete conoscere).
- Far reagire il 2-metil-2-butene con a) HBr; b) Br2 in CH2Cl2; c) Br2 in CH3OH; d) 9-BBN e facendo seguire una reazione di ossidazione; e) un perossiacido. Per tutti, mostrare il meccanismo e la stereochimica dei prodotti (NB: è necessario mostrare gli aspetti stereochimici contestualmente al meccanismo).
- Disegnare il diagramma dell’energia libera vs la coordinata di reazione per la reazione 10a. Indicare sul grafico reagenti, prodotti, stato di transizione e intermedi di reazione.
- L’intermedio della reazione precedente (quella della domanda 11) è un carbocatione. Stabilire un ordine di stabilità per i carbocationi primari, secondari, terziari e argomentare.
- Dire cosa succede se mettiamo i seguenti composti in metanolo: 1-bromobutano, 1-bromo-1-butene, 1-bromo-2-butene. Argomentare la risposta.
- Se mettiamo l’1-bromobutano in presenza di ione idrossido quale sarà il prodotto principale? A partire dal prodotto ottenuto, cosa si ottiene se si fa reagire con PCC? Il prodotto di questa seconda reazione ha idrogeni acidi? Perchè?
- Per il/i composto/i sintetizzato/i in 10d, disegnare la proiezione di Newman lungo il legame C2-C3 del conformero più stabile.
- Spiegare perchè i conformeri eclissati sono meno stabili dei conformeri sfalsati.
- A partire da uno dei composti sintetizzati in 10e, sintetizzare il 2,3-dimetil-2,4-esadiene. Potrebbero essere necessari più passaggi. Indicare strategia sintetica, condizioni di reazione e meccanismi (se questi ultimi sono tra quelli che dovete conoscere). Seguire sempre la stereochimica nel corso della reazione. Spiegare perchè il prodotto ottenuto sarà il prodotto principale.
- Con che meccanismo disidratano gli alcoli secondari? E i primari?
- Spiegare perchè in una reazione E2 è necessario che i gruppi da eliminare siano in posizione anticoplanare.
- Scrivere il D-ribosio nella forma a catena aperta, sapendo che si tratta di un aldopentoso e che la configurazione assoluta dei carboni 2 e 3 è R.
- Scrivere l’L-ribosio
- Scrivere il prodotto del D-ribosio con sodio boro idruro
- L’alditolo ottenuto in 22 non è otticamente attivo. Spiegare perchè.
- Partendo dal D-ribosio, effettuare una sintesi di Kiliani-Fisher.
- Dalla 24 si ottengono D-allosio e D-altrosio. Perchè si ottengono due prodotti?
- Che tipo di reazione è la prima che si usa in 24?
- Nell’ultimo passaggio della sintesi in 24 l’immina formata viene idrolizzata. Parlando di immine in generale, perchè mentre la reazione di sintesi è reversibile, quella di idrolisi non lo è nelle condizioni in cui viene effettuata?
- Tornando al D-ribosio, quale sarà il prodotto della sua reazione col reattivo di Tollens?
- Nel prodotto ottenuto in 28 c’è uno dei legami singoli C-O che è più corto rispetto agli altri. Dire quale e spiegare perchè. Spiegare anche perchè l’idrogeno del gruppo carbossilico è più acido di quello del gruppo ossidrile.
- Il ribosio può essere ossidato a dare un acido aldonico anche utilizzando acqua di bromo (Br2 in acqua). Il chetoso corrispondente, il ribulosio, può essere ossidato a dare lo stesso acido aldonico (più un altro prodotto) solo col reattivo di Tollens e non con acqua di bromo. a) Spiegare perchè; b) spiegare perchè otteniamo due prodotti; c) quanti prodotti otteniamo quando ossidiamo il ribosio con reattivo di Tollens?
Grado di difficoltà delle domande:
Alto (richiedono più passaggi e/o notevole padronanza della disciplina): 9, 17
Medio (domande che vanno al di là della mera esposizione/applicazione di concetti teorici): 6, 8, 14, 20, 24, 25, 29, 30
Basso (domande che riguardano l’esposizione di concetti teorici, la dimostrazione di semplici meccanismi di reazione, l’applicazione diretta di concetti teorici di base): tutte le domande non incluse nelle due liste precedenti.
You must be logged in to post a comment.