Rappresentazioni strutturali…e loro interconversione

Diversi tipi di rappresentazioni strutturali dei composti organici sono disponibili e ciascuna di esse è utile per mettere in evidenza determinati aspetti spaziali (e non solo). Saperle scrivere e leggere è fondamentale. Inoltre, è importante saper convertire queste rappresentazioni tra loro.
Sicuramente una struttura che vedremo spesso è quella a segmenti, in cui l’orientamento nello spazio dei sostituenti viene indicato usando un cuneo pieno (verso l’osservatore) e un cuneo tratteggiato (lontano dall’osservatore). Questo tipo di rappresentazione però non è adatta per l’analisi conformazionale, nè utile per mostrare gli aspetti stereochimici delle reazioni.
Nelle formule prospettiche, i legami sul piano del foglio sono disegnati come linee continue (vicine tra loro), quelli diretti fuori dal foglio sono cunei pieni, quelli lontani dall’osservatore cunei tratteggiati. Come disegnare le formule prospettiche? Indicazioni sono presenti nel paragrafo 4.7*. Come fare quando ci sono due centri asimmetrici? Indicazioni sono riportate nella “strategia per la risoluzione dei problemi” a pag. 175. Le formule prospettiche che troverete sul libro mostrano per lo più la struttura tridimensionale della molecola in una conformazione sfalsata. In ogni caso, è possibile anche scrivere la formula prospettica della conformazione eclissata (vedere pag. 166).
Nel paragafo 4.7 vengono introdotte anche le proiezioni di Fischer, mentre nel paragrafo 4.12 si analizzano le proiezioni di Fischer di molecole con più centri chirali. Le proiezioni di Fischer rappresentano sempre il composto in una conformazione eclissata e si ottengono osservando la molecola al centro della V definita da due dei legami del carbonio con i sostituenti. Queste rappresentazioni sono molto utili per riportare molecole con più centri chirali e rendono agevole l’attribuzione della configurazione assoluta.
Le proiezioni di Newman sono usate per rappresentare su carta le strutture tridimensionali che derivano dalla rotazione intorno ai legami sigma. Indicazioni su come scriverle sono riportate nel paragrafo 3.11. Le strutture a cavalletto mostrano il legame C-C in modo prospettico. In particolare, stiamo osservando la molecola da un angolo. I legami possono essere eclissati o sfalsati.
Una nota a parte è essenziale per le rappresentazioni del cicloesano, che sono ampiamente trattate sul libro. Nel paragrafo 3.13 vedrete come disegnare i conformeri a sedia e come effettuare la conversione d’anello. A pagina 133 sono disponibili invece informazioni su come disegnare la proiezione di Newman del cicloesano.
Note sull’interconversione delle rappresentazioni strutturali
Per poter convertire agevolmente una rappresentazione strutturale in un’altra è essenziale aver compreso a fondo ogni singola rappresentazione. Sul libro, a pagg. 187-189 troverete anche un tutorial su come interconvertire le rappresentazioni strutturali.

Un punto importante da precisare è che queste rappresentazioni guardano il legame cabonio-carbonio da diverse prospettive, ed è essenziale sapere da quale angolazione è osservata la molecola. Un’altra cosa da aver chiara, è che è possibile scrivere più rappresentazioni di uno stesso composto (anche dello stesso tipo), semplicemente cambiando il punto di osservazione. Scegliere la prospettiva ottimale che ci permette di fare le operazioni di conversione in maniera agevole è sicuramente vantaggioso, ma potrebbe essere utile anche provare a utilizzare punti di osservazione diversi.
CONVERTIRE UNA STRUTTURA A CAVALLETTO IN PROIEZIONE DI NEWMAN E VICEVERSA
Innanzitutto vediamo la relazione esistente tra la rappresentazione a cavalletto e la proiezione di Newman. Se immaginiamo la proiezione di Newman come una rappresentazione 2D della struttura a cavalletto, che invece ci mostra il legame C-C da un certo angolo, il passaggio dall’una all’altra dovrebbe essere immediato.

Per passare dalla proiezione a cavalletto a quella di Newman, immaginiamo di proiettare i legami (e gli atomi) sul foglio (vedi immagine); per fare il contrario, immaginiamo di estendere la proiezione di Newman fuori dal foglio (immaginate di prendere il carbonio più vicino a voi-cioè quello frontale sulla proiezione di Neman-e di tirarlo verso di voi).
CONVERTIRE UNA STRUTTURA A CAVALLETTO IN PROIEZIONE DI FISCHER
Vediamo che succede se abbiamo una struttura a cavalletto e vogliamo ottenere la proiezione di Fischer corrispondente. Ricordiamo che la proiezione di Fischer rappresenta un conformero eclissato. Quindi, se la proiezione a cavalletto riporta un conformero sfalsato, il primo passo è quello di eclissarla. Vediamo qui due esempi di come è possibile ottenere un conformero eclissato (NB: ricordiamo che questi sono solo due dei diversi possibili modi in cui possiamo ottenere un conformero eclissato).
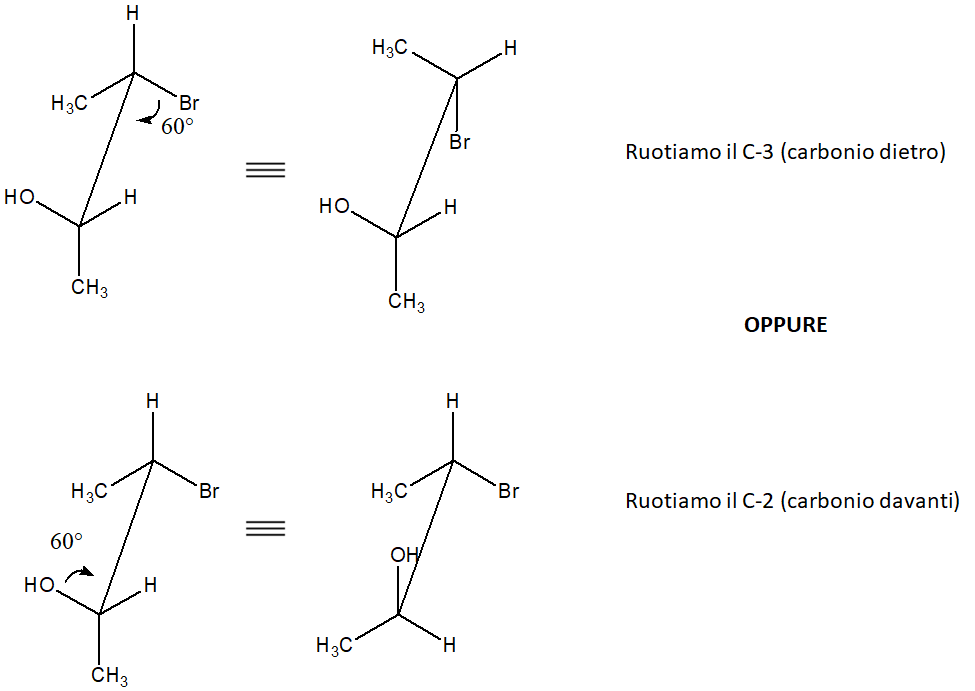
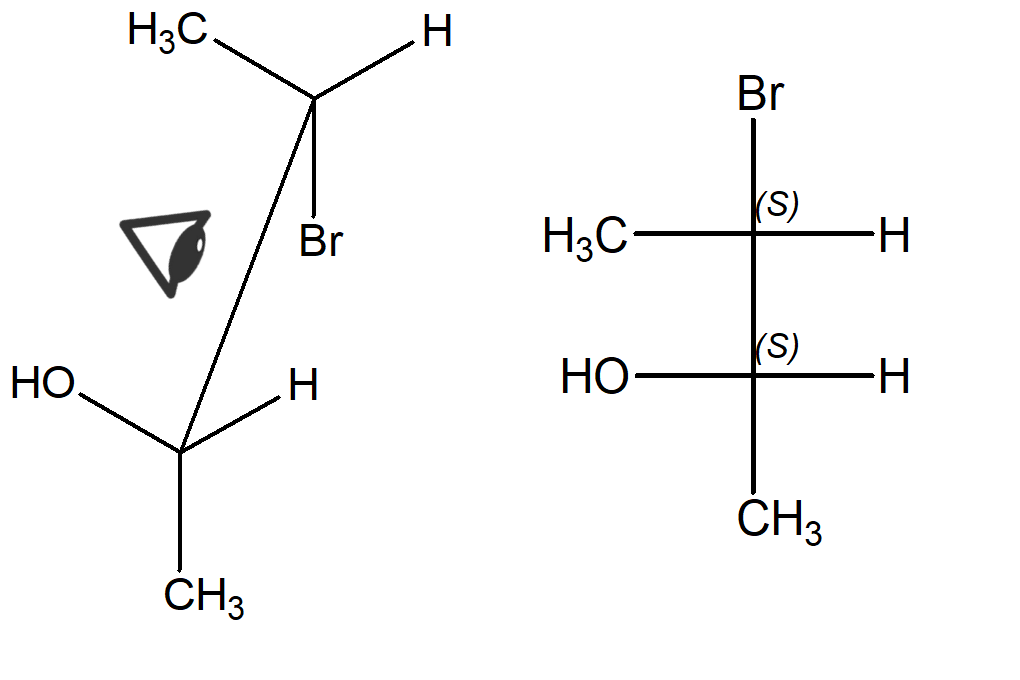
Ora prendiamo la prima struttura a cavalletto eclissata (quella in alto). Per convertirla in una proiezione di Fischer, dobbiamo innanzitutto guardarla al centro della V costituita dai legami tra i carboni chirali e due sostituenti legati a ciascun carbonio. Dobbiamo anche scegliere il punto di osservazione. Quello più immediato per chi sta guardando la struttura sul foglio è dall’alto, con lo stereocentro davanti (che nell’immagine è quello cui è legato l’ossidrile) collocato più vicino a noi. Questo carbonio sarà in basso sulla proiezione di Fischer. Così facendo, nell’esempio in questione, il bromo e il metile dovranno stare sulla linea verticale (che, ricordiamo, indica i legami lontani dall’osservatore). Il bromo però starà in alto e il metile starà in basso sulla linea verticale della proiezione di Fischer.

Mantenendo fisso il punto di osservazione, ora possiamo riportare sulla proiezione di Fischer tutti i sostituenti alla nostra sinistra (che andranno sulle linee orizzontali a sinistra) e tutti quelli che stanno alla nostra destra (che andranno sulle linee orizzontali a destra).
Possiamo guardare la molecola da altre angolazioni? Sì, però è necessario fare molta attenzione a posizionare bene i sostituenti. Immaginiamo per esempio di guardarla sempredall’alto, ma con le spalle rivolte al foglio e quindi con il C-3 (quello che lega il bromo) più vicino a noi. In quel caso avremo sempre il metile e il bromo lontani da noi, ma il metile sarà sul carbonio in alto e il bromo su quello in basso. Inoltre, i sostituenti a destra saranno l’ossidrile e il metile e a sinistra avremo i due atomi di idrogeno.
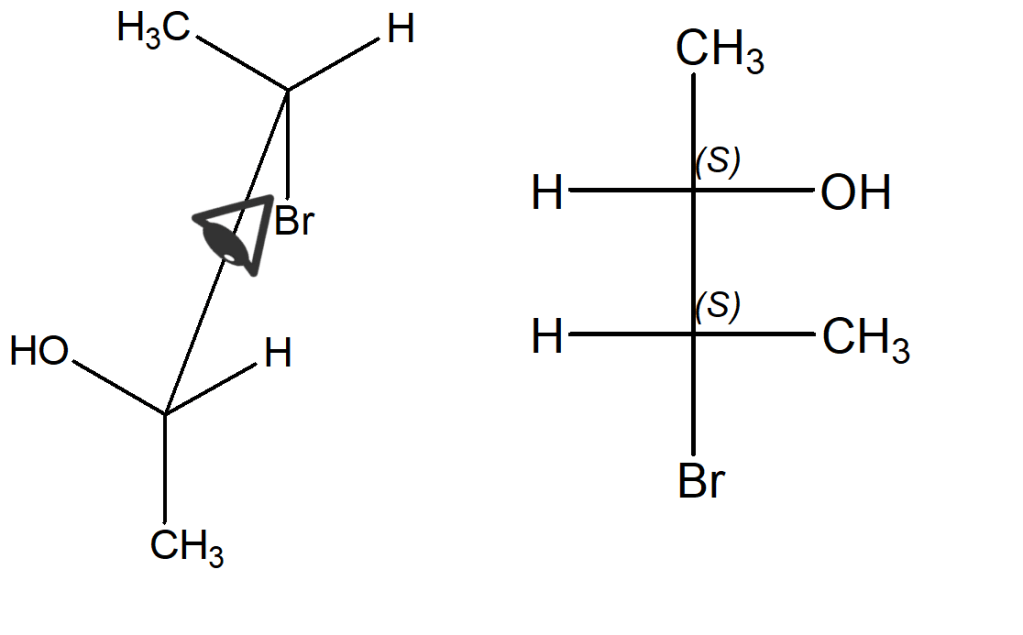
Notiamo che questa proiezione di Fischer è praticamente quella in alto, ruotata di 180° sul foglio (e quindi, sono lo stesso composto come evidenziato anche dalla configurazione assoluta dei due stereocentri).
Potremmo guardarla anche da altre angolazioni, ma queste richiedono un maggiore sforzo di immaginazione. Ad esempio, immaginiamo di guardarla tra i legami indicati in rosso nell’immagine seguente, con il carbonio davanti (C-2) più vicino a noi. In questo caso, lontani da noi sono collocati i due atomi di idrogeno. Ancora una volta dobbiamo far attenzione alla posizione relativa degli altri sostituenti (altrimenti scriveremmo uno stereoisomero del nostro composto).

Ora prendiamo il secondo conformero eclissato, quello che abbiamo ottenuto nel primo passaggio, ruotando il carbonio 2. Anche qui possiamo scegliere la prospettiva di osservazione. Immaginiamo di guardarlo dal basso e frontale (non dando le spalle al foglio). In tal caso, possiamo anche immaginare semplicemente di “ribaltare” la struttura sul foglio. Immaginiamo di appoggiare la mano nel punto indicato dalla freccia blu qui sotto e di spingere il carbonio verso l’alto, mentre l’altro carbonio resta fisso sul foglio. Otterremo il ribaltamento della struttura. Quindi l’OH starà sulla linea verticale della proiezione di Fischer in alto e l’H sulla linea verticale, ma in basso. Facciamo attenzione alla disposizione degli altri sostituenti.
Ancora una volta è comunque possibile osservarla da più angolazioni, ma bisogna sempre fare molta attenzione.

Notiamo come la configurazione dei carboni chirali è sempre la stessa. Abbiamo infatti lavorato su un singolo stereoisomero.
Consiglio: provate a lavorare con l’aiuto dei modellini!
CONVERTIRE UNA PROIEZIONE DI FISCHER IN PROIEZIONE A CAVALLETTO
Come passare da proiezione di Fischer ad una a cavalletto? Ci ricordiamo che la proiezione di Fischer è relativa ad un conformero eclissato e che i due sostituenti sulla linea verticale sono lontani dall’osservatore. Quindi, li posizioniamo come mostrato in figura
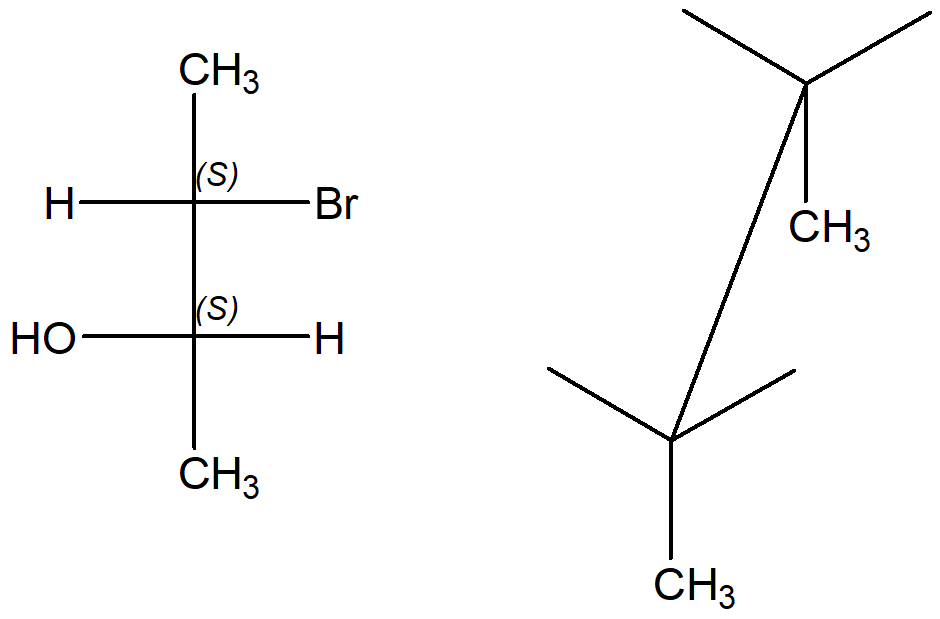
A questo punto, mettiamo sulla destra i sostituenti che stanno a destra sulla proiezione di Fischer e a sinistra quelli a sinistra (attenzione! Il nostro punto di osservazione della struttura a cavalletto in questo momento è dall’alto guardando verso il foglio).

PROIEZIONE DI NEWMAN/PROIEZIONE DI FISCHER
E per quanto concerne la conversione proiezione di Newman/proiezione di Fischer e viceversa? Se è chiara la relazione tra la proiezione di Newman e le strutture a cavalletto, non dovrebbe essere difficile…
Partiamo sempre ottenendo una delle possibili conformazioni eclissate della molecola.
Vediamo un esempio di passaggio dalla proiezione di Newman a quella di Fischer.

Qui la stiamo osservando sempre dall’alto e rivolti verso il foglio (o lo schermo).
E se l’abbiamo eclissata nel modo seguente?

In questo caso, possiamo seguire il consiglio del libro e quindi “muovere” verso il basso il legame che coinvolge il metile sul carbonio posteriore (o in generale quello che punta verso l’alto sul carbonio in questione). Così facendo, il metile starà in basso e legherà alla sua sinistra il bromo e alla sua destra l’H. L’altro legame, quello con H che punta verso l’alto, sarà sul carbonio in alto nella proiezione di Fischer. L’ossigeno sarà alla sua sinistra e il metile alla sua destra.

Si può passare dalla proiezione di Fischer a quella di Newman agevolmente se si ricorda che Fischer rappresenta un conformero eclissato. Bisogna però essere attenti nel definire il punto di osservazione sulla proiezione di Newman e scrivere il conformero eclissato corretto. All’inizio, potrebbe essere utile “passare” per la struttura a cavalletto (vedere sopra la descrizione del metodo) e poi convertire quella in proiezione di Newman.
INTERCONVERSIONE DI VARIE RAPPRESENTAZIONI STRUTTURALI
Immaginiamo di voler rappresentare, in varie forme, il (2S,3R)-3-bromobutan-2-olo. Qui rappresentato con una struttura a segmenti:

Ricordiamo che i legami non esplicitati sui carboni chirali sono legami che il carbonio fa con l’idrogeno, per cui:
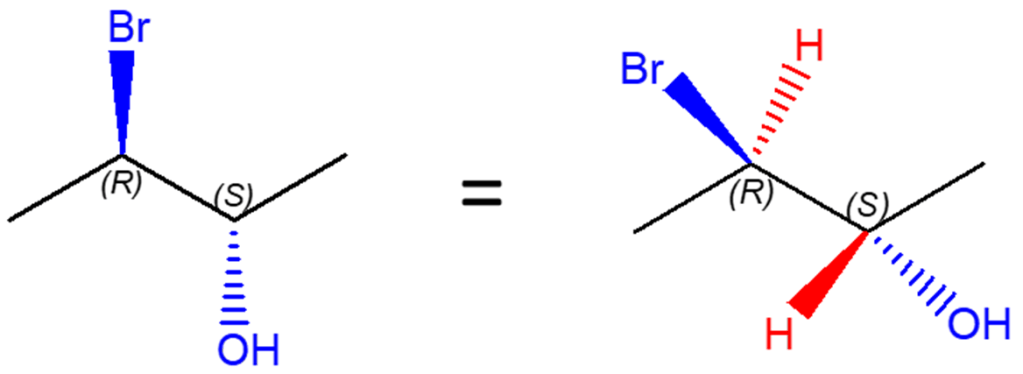
La struttura a destra nella figura in alto somiglia già a quella che è una formula prospettica, per cui questo passaggio è abbastanza semplice e ci porta ad ottenere la formula prospettica che osserviamo nella figura qui sotto (immagine a destra):

Nelle varie conversioni che seguiranno, i legami con gli idrogeni saranno sempre riportati in rosso. Fate attenzione alla lora posizione relativa. Inoltre, osservate bene sempre quale dei due carboni chirali è il 2 (quello che lega -OH) e qual è il 3 (quello che lega -Br). Notate inoltre come la configurazione assoluta dei carboni chirali non cambia MAI.
Un altro punto da chiarire è che è possibile ottenere rappresentazioni dello stesso composto da diverse prospettive.
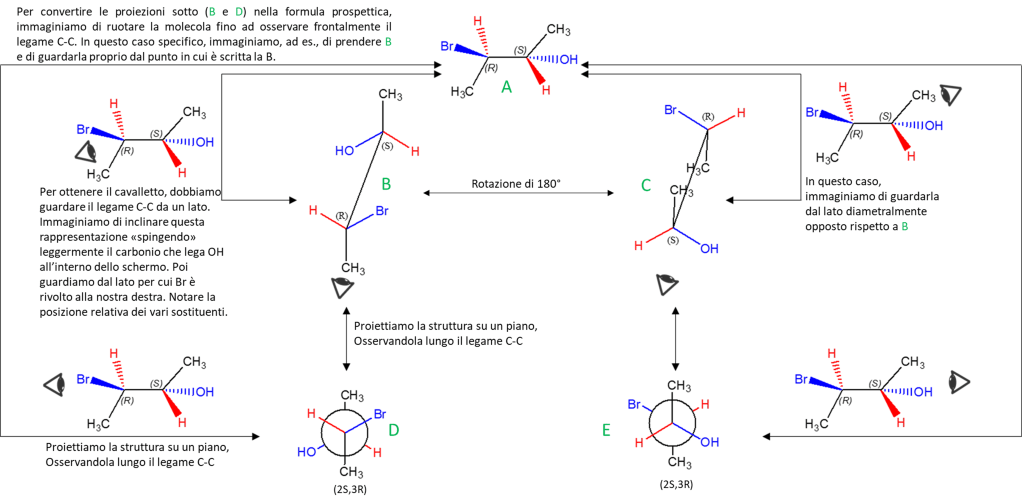
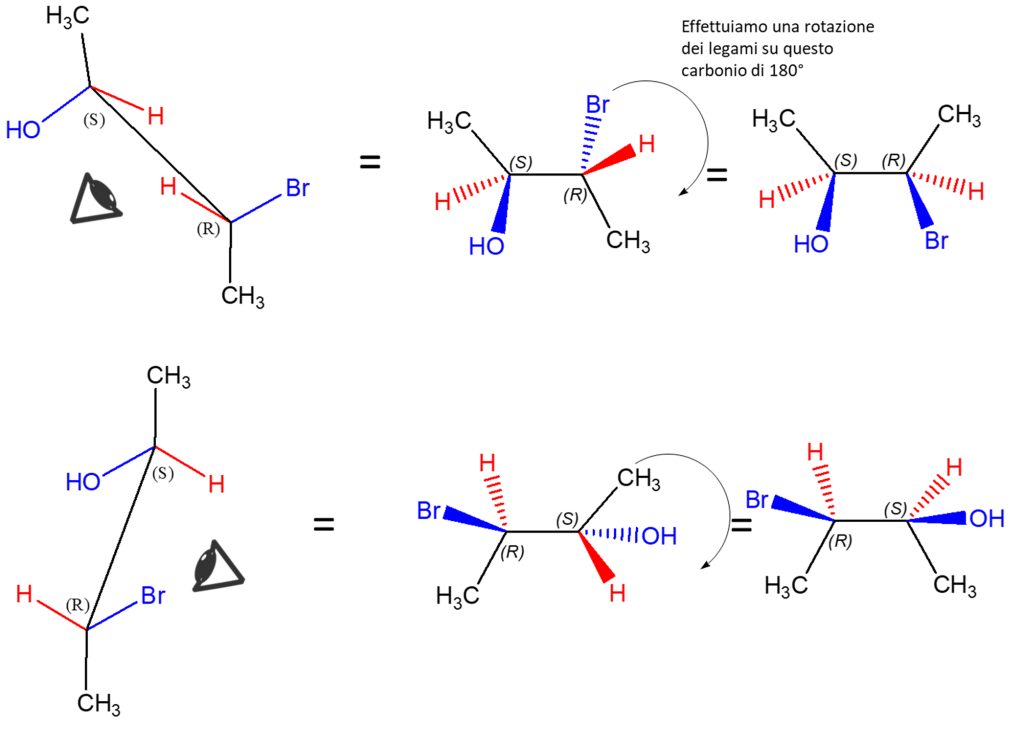
Sappiamo già come ottenere le conformazioni eclissate nelle proiezioni di Newman e a cavalletto, ma è possibile eclissare i legami anche nella formula prospettica:

A questo punto, possiamo fare le stesse operazioni viste prima su questa formula eclissata. In questo caso, possiamo scrivere anche la proiezione di Fischer (NB: per farlo, è ovviamente anche possibile eclissare le strutture a cavalletto o le proiezioni di Newman precedentemente scritte).

Il punto di osservazione ottimale per convertire le strutture a cavalletto e le proiezioni di Newman a Fischer è già stato chiarito precedentemente, all’inzio del post, ma vediamo cosa succede se eclisso le strutture, dirigendo la “V” verso il basso.
I punti di osservazioni mostrati qui sono solo alcuni di quelli possibili. Nella figura in basso si mostra, ad es., come è possibile osservare una stessa struttura a cavalletto, ottenendo due diverse formule prospettiche (che ovviamente sono equivalenti in quanto rappresentano sempre lo stesso composto). Da ogni formula sfalsata, si ottiene poi anche quella eclissata.
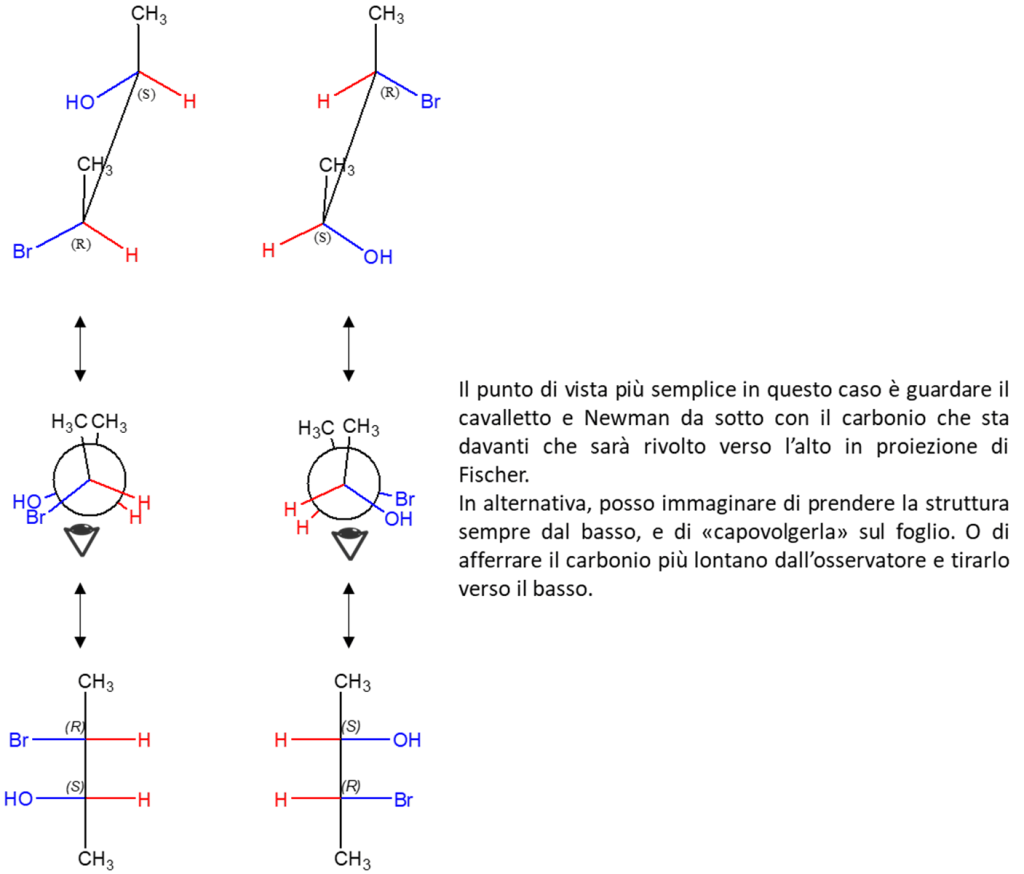
Nell’immagine seguente, un altro esempio. Una proiezione di Newman osservata da tutti i possibili punti di vista per convertirla in proiezione di Fischer. Nell’osservarla e nel confrontare le proiezioni di Fischer, fate attenzione a confrontare sempre il carbonio 2 su una proiezione con lo stesso carbonio sull’altra proiezione, non essendo sempre il carbonio 2 quello scritto più in alto (le proiezioni di Fischer a destra sono ruotate di 180° nel piano del foglio rispetto a quelle a destra).

O ancora, di seguito trovate tre dei possibili punti di osservazione di una formula prospettica (ma questi non sono tutti: è possibile osservarla anche da altri punti di vista, semplicemente ruotandola, o ad esempio guardandola dalle stesse angolazioni, ma “a testa in giù”… il che equivale ad una rotazione di 180° sul piano del foglio per la proiezione di Fischer). Il colore della proiezione di Fischer corrisponde al punto di osservazione indicato da una freccia dello stesso colore.

Passare da una rapprensentazione all’altra può sembrare complesso all’inizio. Per poterlo fare in maniera consapevole è essenziale aver capito bene ciascun tipo di rappresentazione…e tanto esercizio. Basta scegliere un composto e provare a interconvertirne le varie rappresentazioni, magari con il supporto delle indicazioni qui riportate.
*In questo post di fa spesso riferimento al libro: in questo caso ci riferiamo all’ultima edizione del Bruice. Chi ha un libro diverso, potrà avvalersi dell’aiuto dell’indice analitico
Pingback: Molecole con più unità stereogeniche e con più carboni asimmetrici | Chimica Organica-DiSTABiF
Pingback: CdL Scienze Biologiche – Avviso relativo agli argomenti della II prova intercorso | Chimica Organica-DiSTABiF