Esercitiamoci per la prova scritta III

Suggerimento: per poter usare questi set di esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 2 ore per ciascun set.
PRIMO SET
1. Attribuire il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:

2) Individuare quali (sono possibili più opzioni) tra le strutture mostrate in basso corrispondo alla struttura del seguente composto:

3) Quali tra i composti a-d dell’esercizio precedente ruotano il piano della luce polarizzata?
4) Disporre i seguenti composti in ordine di punto di ebollizione crescente. Indicare l’ordine inserendo i numeri nei riquadri sotto le strutture: 1= p.eb. più basso, 4= p.eb. più alto

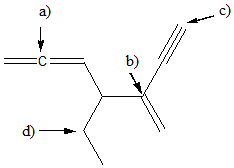
5) Descrivi ibridazione, geometria e angolo di legame per gli atomi indicati da freccia nella seguente struttura:
6) Cerchiare quella che, tra le seguenti, è la conformazione più stabile del 2-metilpentano e spiegare quali sono i fattori che la rendono tale

7) Il pKa di un idrogeno legato ad un carbonio ibridato sp3 è >60, mentre quello di un H legato ad un C ibridato sp3 in alfa ad un gruppo aldeidico è intorno a 16. Spiegare brevemente perchè
8) Il prodotto principale della reazione di idratazione acido catalizzata del seguente composto è diverso rispetto al prodotto principale della reazione di ossimercuriazione/riduzione. Mostrare il meccanismo delle due reazioni, mettendo in evidenza i fattori che determinano la formazione di due prodotti diversi.
9) Completare il seguente schema inserendo le condizioni di reazione o i prodotti mancanti. Evidenziare la stereochimica quando opportuno.

10) Il pI della leucina (R = 2-metilpropile) è 6,01. Scrivere l’amminoacido a pH = 4,75; pH = 6,01; pH = 8,00.
SECONDO SET
1. Attribuire il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:

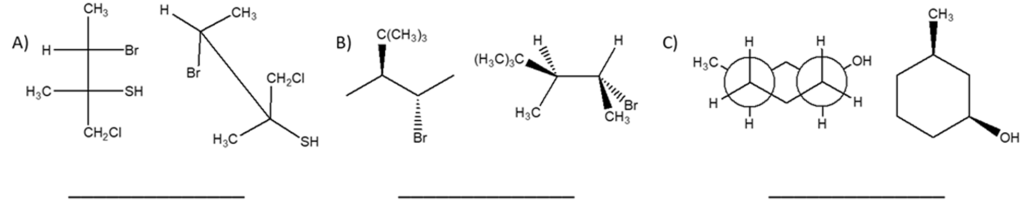
2. Dire se le strutture riportate a destra sono isomeri conformazionali, isomeri geometrici, isomeri ottici, isomeri costituzionali, o lo strutture identiche rispetto alla seguente struttura a segmenti:

3. Stabilire le configurazioni assolute dei carboni chirali presenti nelle seguenti molecole (NB: la notazione va riportata vicino ai carboni cui fa riferimento) e dire qual è la relazione stereochimica esistente tra i composti di ciascuna coppia (enantiomeri/diastereoisomeri/stesso composto/altro):
4. Elencare i seguenti idrogeni in ordine di acidità crescente (dal valore più basso a quello più alto) e motivare la scelta
5. Disegnare il conformero a sedia più stabile del trans-1-isopropil-4-metilcicloesano. Spiegare brevemente i fattori che rendono questo conformero più stabile rispetto a quello che si ottiene effettuando l’inversione della sedia
6. Illustrare, mediante l’uso delle frecce ricurve, il movimento degli elettroni delocalizzati e indicare con una X quale delle due strutture di risonanza ha minore energia.

7. Scrivere i prodotti principali delle seguenti reazioni. Indicare la stereochimica, quando opportuno.

8. Mostrare il meccanismo di apertura del seguente epossido a) con metanolo in ambiente acido; b) con lo ione acetiluro ottenuto trattando l’etino con NaNH2. Mostrare la stereochimica dei prodotti. Attribuire il nome IUPAC all’epossido e ai prodotti formati.

9. Scrivere l’epimero in 2 dell’ L-glucosio in struttura lineare e in proiezione di Haworth
TERZO SET
1. Assegnare il nome IUPAC, comprensivo di stereochimica, ai seguenti composti:
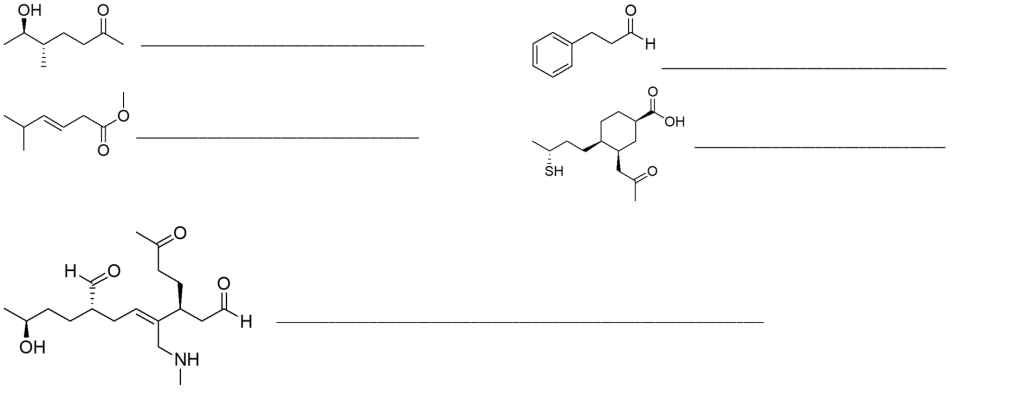
2. A quale valore di pH un composto con pKa = 7.2 sarà presente in soluzione al 50% nella forma acida?
3. Quale delle seguenti strutture corrisponde al (2S,3S)-2-bromo-3-cloroesano?

4) Quali dei seguenti composti è otticamente attivo? NB: è possibile scegliere più opzioni
a) (2S,3S)-2,3-diclorobutano
b) (2S,3R)-2,3-dicloropentano
c) (2S,3R)-2,3-diclorobutano
d) (1S,2S)-1,2-diclorociclopentano
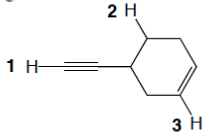
5) Nella seguente figura, alcuni dei legami sono indicati da freccia e da una lettera.

1) Etichettare i legami a-d come singoli, doppi o tripli;
2) indicare il tipo di orbitale/i molecolare/i;
3) dire quali orbitali atomici sono coinvolti nella formazione del legame.
4) Considerando tutti i legami singoli della molecola (ed escludendo i legami C-H) qual è il legame più corto?
6) Che cosa rappresentano (a), (b) e (c) nel seguente diagramma di energia?

7) Disporre i seguenti composti in ordine di acidità crescente e giustificare la scelta

8) Prevedere i prodotti principali di reazione E2 del 1-cloro-1-metilcicloesano rispettivamente con metossido di sodio e con terz-butossido di potassio
9) Indicare le condizioni ottimali per le seguenti reazioni:
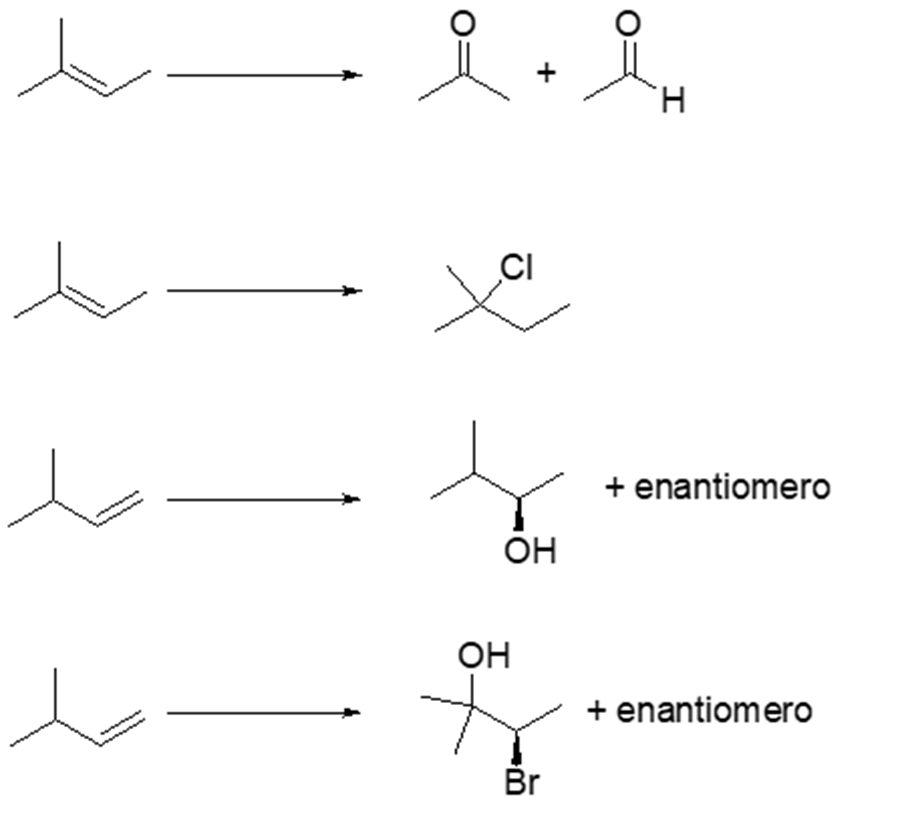
10) Mostrare il meccanismo e i prodotti della reazione del ciclopentanone con etanolo in ambiente acido
11) L’L-mannosio è l’epimero in 2 dell’L-glucosio. Scrivere il beta-L-mannopiranosio
Cosa fare se si riscontrano difficoltà o se si hanno dubbi:
-rivedere gli argomenti problematici (NB: non si possono risolvere gli esercizi senza aver studiato la teoria, per cui sarà necessario studiare e approfondire l’argomento ed eventualmente-successivamente-esercitarsi ulterioremente utilizzando sia gli esercizi del libro sia quelli presenti su questo blog).
-contattare il docente: è possibile sia chiedere spiegazioni, sia fare ricevimento (anche in gruppo) o organizzare esercitazioni dedicate
You must be logged in to post a comment.