Reazioni di sostituzione ed eliminazione di alogenuri alchilici

Raccomandazioni prima di affrontare questi esercizi:
1) studiare le reazioni degli alogenuri alchilici, inclusa la problematica relativa alla competizione tra i meccanismi di reazione e gli effetti del solvente. Prendere, inoltre, visione del materiale didattico pubblicato.
2) Non farsi spaventare dal numero di esercizi e affrontarli in maniera razionale cercando di applicare quanto studiato.
3) Alla fine del post troverete un link in cui sono riportati alcuni degli esercizi svolti/guidati che possono essere una guida per affrontare anche gli altri esercizi

2) Individuare quali alogenuri alchilici dell’esercizio 1 non vanno incontro a sostituzione con meccanismo SN2 e spiegare perchè. Per questi, mostrare il meccanismo SN1, indicando anche le condizioni di reazione.
3) Quali delle seguenti affermazioni sono vere per sostituzioni nucleofile che avvengono con meccanismo SN2 e quali sono vere per sostituzioni nucleofile che avvengono con meccanismo SN1?
a) gli alogenuri terziari reagiscono più velocemente dei secondari;
b) se si usa un substrato otticamente attivo, la configurazione del prodotto è opposta a quella del prodotto di partenza;
c) la velocità della reazione dipende solo dalla concentrazione del substrato;
d) la reazione avviene in un solo stadio;
e) i carbocationi sono intermedi della reazione;
f) la velocità della reazione dipende dalla natura del gruppo uscente;
g) il 2,2-dimetil-1-cloropropano è poco reattivo.
4) Quali delle seguenti affermazioni sono tipiche di un meccanismo SN2:
a) La reazione procede con inversione di configurazione
b) L’ordine di reattività dell’alogenuro alchilico è il seguente: metile (più veloce) > 1° >2° > 3°
c) Possono avvenire riarrangiamenti
d) La velocità di reazione dipende dalla concentrazione del nucleofilo e dell’alogenuro alchilico
e) La reazione è, generalmente, più veloce in solventi polari aprotici
f) la velocità dipende dalla concentrazione del nucleofilo
g) la reazione avviene in uno stadio
h) Si forma un intermedio carbocationico
l) Si ottiene un prodotto in cui l’ibridazione del C che ha reagito è diversa da quella che aveva nel prodotto di partenza.
5) Spiegare come i seguenti cambiamenti influenzino la velocità di reazione del 2-bromo-2-metilpentano con metanolo
a) l’alogenuro alchilico è cambiato con 2-cloro-2-metilpentano
b) l’alogenuro alchilico è cambiato con 2-cloro-3-metilpentano.
6) Con riferimento agli alogenuri alchilici dell’esercizio 5, cosa cambierebbe se usassimo lo ione metossido invece del metanolo? E lo ione terz-butossido invece del metossido?
7) Ordina i seguenti composti per reattività crescente in una reazione SN1 :
a) 2-bromobutano
b) 1-bromobutano
c) 2-bromo-2-metilbutano
8) Mettere i seguenti composti in ordine di reattività crescente in una reazione SN1 e motivare la scelta
a) (CH3)3CI, (CH3)3CCl, (CH3)3CF, (CH3)3CBr
b) 2-bromo-2-metilbutano, 3-bromo-3-metil-1-butene, 2-bromobutano
c) 4-bromocicloesene, 5-bromo-1,3-cicloesadiene, 3-bromocicloesene
9) Mettere i seguenti composti in ordine di reattività crescente in una reazione E2 e motivare la scelta
a) 4-bromocicloes-1-ene, 5-bromo-1,3-cicloesadiene, 3-bromocicloes-1-ene
10) Mostrare il meccanismo e scrivere il prodotto principale che si ottiene quando ognuno dei composti dell’esercizio 1 subisce una reazione di eliminazione E2
11) Proporre una strategia di sintesi dei seguenti composti a partire dall’opportuno alogenuro alchilico:
a) (1R, 3S)-3-metilcicloesan-1-olo
b) 1-metil-1-cicloesene
c) pentilidenciclopentano
12) Dire quale composto delle seguenti coppie reagisce più velocemente in una reazione di eliminazione E2 e spiegare perchè:
a) (1R,3S)-1-bromo-3-isopropilcicloesano o (1R,3R)-1-bromo-3-isopropilcicloesano
b) cis-1-bromo-4-isopropilcicloesano o trans-1-bromo-4-isopropilcicloesano
c) (1R,3S,4S)-1-bromo-4-isobutil-3-metilcicloesano o (1R,3S,4R)-1-bromo-4-isobutil-3-metilcicloesano
d) (1R,3S,4S)-1-bromo-4-isobutil-3-metilcicloesano o (1R,3R,4S)-1-bromo-4-isobutil-3-metilcicloesano
13) Scrivere i prodotti delle seguenti reazioni. Mostrare il meccanismo di reazione. Indicare la stereochimica quando opportuno.
a) (2R)-2-bromo-3-metilbutano + idrossido di sodio
b) (2R)-2-bromo-3-metilbutano + idrossido di sodio a caldo (100°C)
c) (2R)-2-bromo-3-metilbutano + DBN
d) (2R)-2-bromo-3-metilbutano + acetato di sodio
e) 1-bromocicloesano + idrossido di sodio
f) 1-bromocicloesano + t-butossido di potassio
g) 1-bromo-3-metilbutano + t-butossido di potassio
h) 1-bromo-3-metilbutano + idrossido di potassio
i) 1-cloro-1-metilciclopentano + metossido di sodio
l) 1-cloro-1-metilciclopentano + acqua
14) Rappresenta i prodotti delle seguenti reazioni E2, tenendo presente la stereochimica (NB: seguire la stereochimica nel corso della reazione)
a) (2S,3S)-2-bromo-3-metilesano + OH– a caldo
b) (2S,3R)-2-bromo-3-metilesano + OH– a caldo
c) (2R,3R)-2-bromo-3-metilesano + OH– a caldo
d) (2R,3S)-2-bromo-3-metilesano + OH– a caldo
e) (2S,3S)-2-fluoro-3-metilesano + OH– a caldo
15) Partendo dall’opportuno alogenuro alchilico e scegliendo le giuste condizioni di reazione, illustrare il meccanismo di reazione della sintesi dei seguenti composti. Indicare eventuali altri prodotti fornendo per tutti il nome IUPAC completo di stereochimica.
a) 1-metil-1-cicloesene
b) (3R)-3-metil-1-1cicloesene
c) 2-metil-1-pentene
d) 2-metil-2-pentene
e) (2Z)-3-metil-2-pentene
f) (2E)-3-metil-2-pentene
16) Qual è il meccanismo di reazione (SN1, SN2, E1, E2) più probabile nelle seguenti condizioni di reazione? Argomentare la scelta fatta
a) 2-bromopropano + KI in acetone;
b) 2-bromopropano + acetato di sodio in acqua;
c) 2-bromo-2-metilpropano + etanolo;
d) 2-bromo-2-metilpropano+ etanolo, a caldo.
17) Scrivere i prodotti principali delle seguenti reazioni. Mostrare il meccanismo di reazione. Indicare la stereochimica quando opportuno. Inoltre, disegnare per ciascuna reazione il diagramma di energia libera/coordinata di reazione (corredato delle strutture degli stati di transizione e degli eventuali intermedi di reazione).
a) (2S)-2-bromo-3-metilpentano + t-butossido di potassio
b) 1-bromo-1-metilcicloesano + acqua
c) 1-bromo-1-metilcicloesano + DBN
d) (2S,3R)-2-bromo-3-metilpentano + idrossido di sodio
e) (2R)-2-fluorobutano + metossido di potassio
f) (clorometil)cicloesano + t-butossido di potassio
g) (1S,2R)-1-cloro-3-metilcicloesano + etossido di potassio
h) (1R,2R)-1-cloro-3-metilcicloesano + etossido di potassio
i) 3-bromo-1-cicloesene + acqua
l) 3-bromo-1-cicloesene + metossido di sodio
18) Scrivere i prodotti principali delle seguenti reazioni (indicare anche la stereochimica dei prodotti):
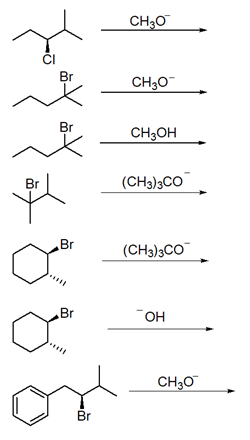
19) Scrivere i prodotti principali delle seguenti reazioni, motivando la risposta

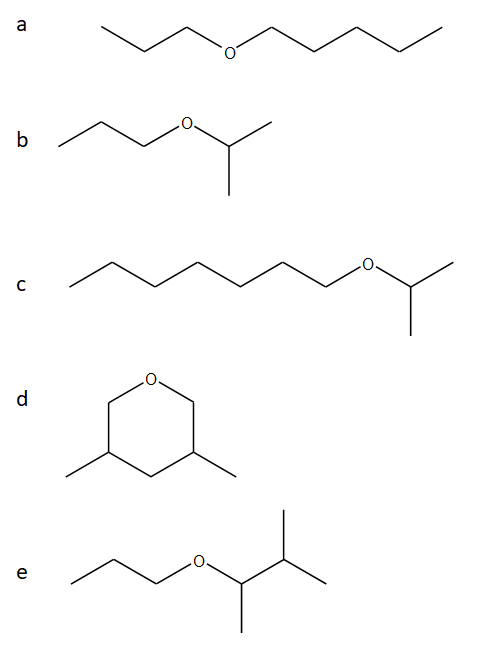
20) Proporre una strategia di sintesi dei seguenti eteri mediante sintesi di Williamson. Per ciascun etere, dire se sono possibili metodi di sintesi alternativi.
–> ESERCIZI GUIDATI (segui il link)
Qui troverete le soluzioni per la maggior parte degli esercizi: https://www.dropbox.com/scl/fi/vbf0ihl0toq92kbu3fgcj/Sostituzioni-ed-eliminazioni.pdf?rlkey=ge5ux8wdlsepkdoojxo6i5sd3&st=4pvcscmm&dl=0
In caso di dubbi, sarà possibile discuterne nelle prossime esercitazioni o a ricevimento
LikeLike
Pingback: CdL Scienze Biologiche – Soluzioni esercizi | Chimica Organica-DiSTABiF