Verso la terza prova intercorso: esercitazione

Di seguito troverete 3 set di esercizi che possono essere usati come simulazioni per la prova stessa per capire se ci sono argomenti ancora poco chiari o su cui dovete ancora esercitarvi.
Suggerimento: per poter usare questi esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 90 minuti per ciascun set.
PRIMO SET
1. Analizzare il diagramma di energia libera/coordinata di reazione dell’addizione di HCl al 2-metilpropene e rispondere ai seguenti quesiti.
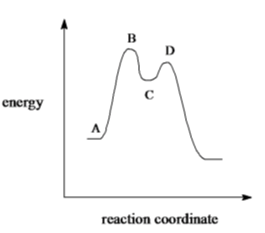
a) Cosa possiamo dire circa il ΔG° della reazione?
b) Cosa possiamo dire circa la Keq della reazione?
c) Di quanti stadi si compone la reazione?
d) Qual è lo stadio cineticamente determinante?
e) Indicare sul grafico l’energia di attivazione relativa allo stadio cineticamente determinante.
f) Cosa sono, rispettivamente, B, C e D?
g) Disegnare la struttura di B e C
h) Spiegare perché la reazione è regioselettiva
2. Disponi i seguenti composti in ordine di calore di idrogenazione crescente

3. Partendo dall’opportuno alchene, illustrare il meccanismo di reazione della sintesi del seguente composto. Indicare eventuali altri prodotti fornendo per tutti il nome IUPAC completo di stereochimica.

4. Scrivere i prodotti principali delle seguenti reazioni. Indicare la stereochimica, quando opportuno.

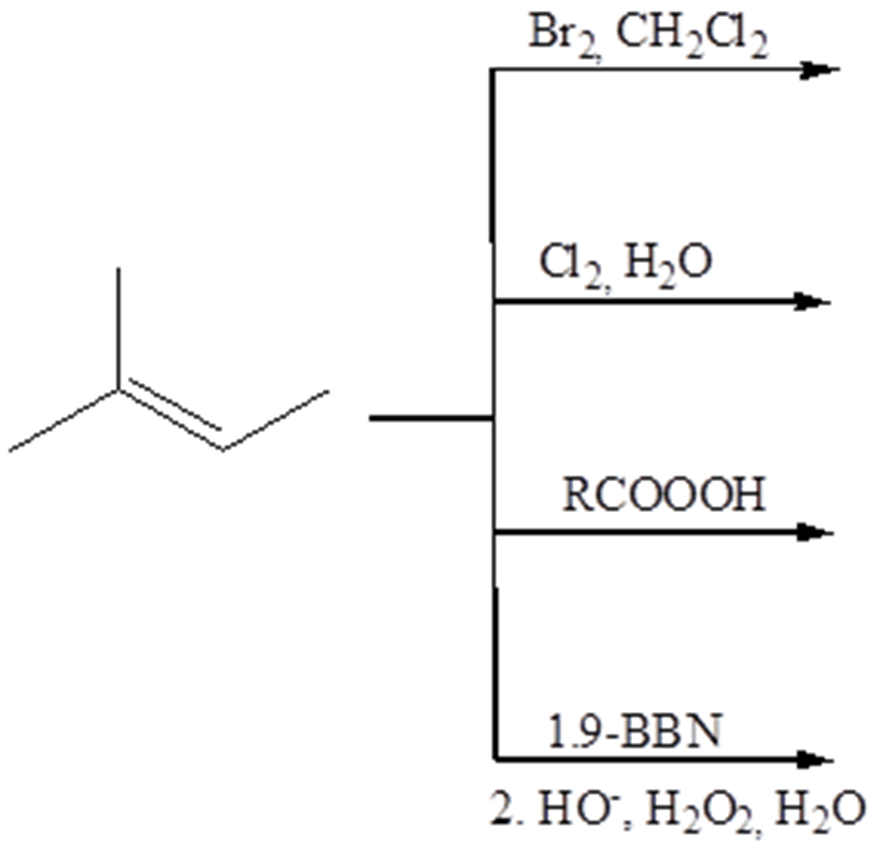
5. Indicare le condizioni ottimali per le seguenti reazioni:
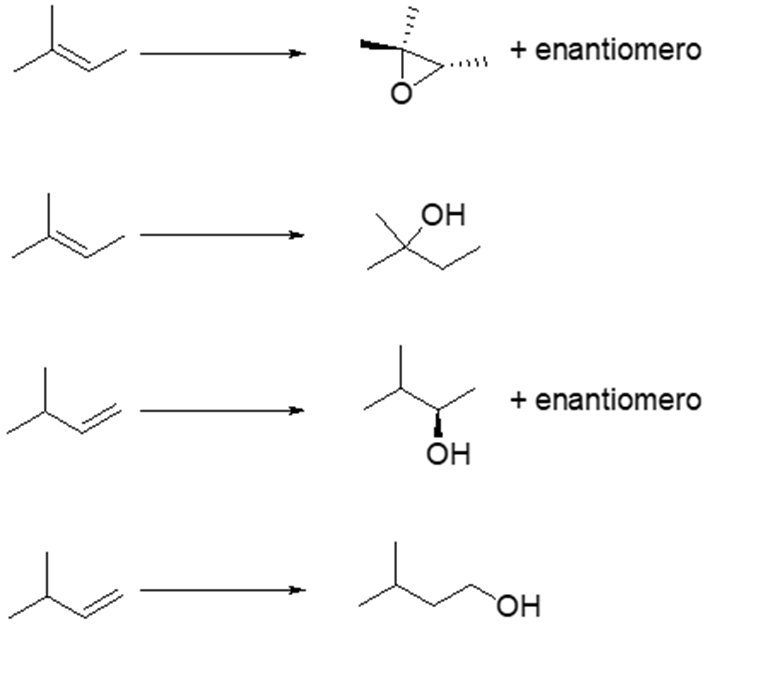
6. Mostrare le condizioni di reazione e il meccanismo della seguente trasformazione (ignorare la stereochimica).

7. Mostrare come il seguente anione è stabilizzato per risonanza
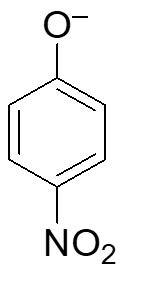
8. Disporre i seguenti composti in ordine di basicità decrescente e motivare la risposta data

SECONDO SET
1. Analizzare il diagramma di energia libera/coordinata di reazione dell’addizione di HBr al 1-butene e rispondere ai seguenti quesiti.

a) Cosa possiamo dire circa il ΔG° della reazione?
b) Cosa possiamo dire circa la Keq della reazione?
c) Di quanti stadi si compone la reazione?
d) Qual è lo stadio cineticamente determinante?
e) Indicare sul grafico l’energia di attivazione relativa allo stadio cineticamente determinante.
f) Cosa sono, rispettivamente, B, C e D?
g) Disegnare la struttura di C e D
h) Spiegare perché la reazione è regioselettiva
2. Ordina i seguenti composti dal meno stabile al più stabile

3. Scrivere i prodotti principali delle seguenti reazioni. Indicare la stereochimica, quando opportuno
4. Indicare le condizioni ottimali per ottenere ciascuno dei seguenti composti a partire dal (R)-3-metilciclopentene. Se quello ottenuto non è l’unico prodotto di reazione, indicare gli ulteriori altri prodotti formati, dire in che relazione sono col prodotto riportato e indicare se si formano o meno in quantità equimolari rispetto a quest’ultimo. NB: se non si formano ulteriori prodotti, scrivere “nessuno” nella casella dedicata.
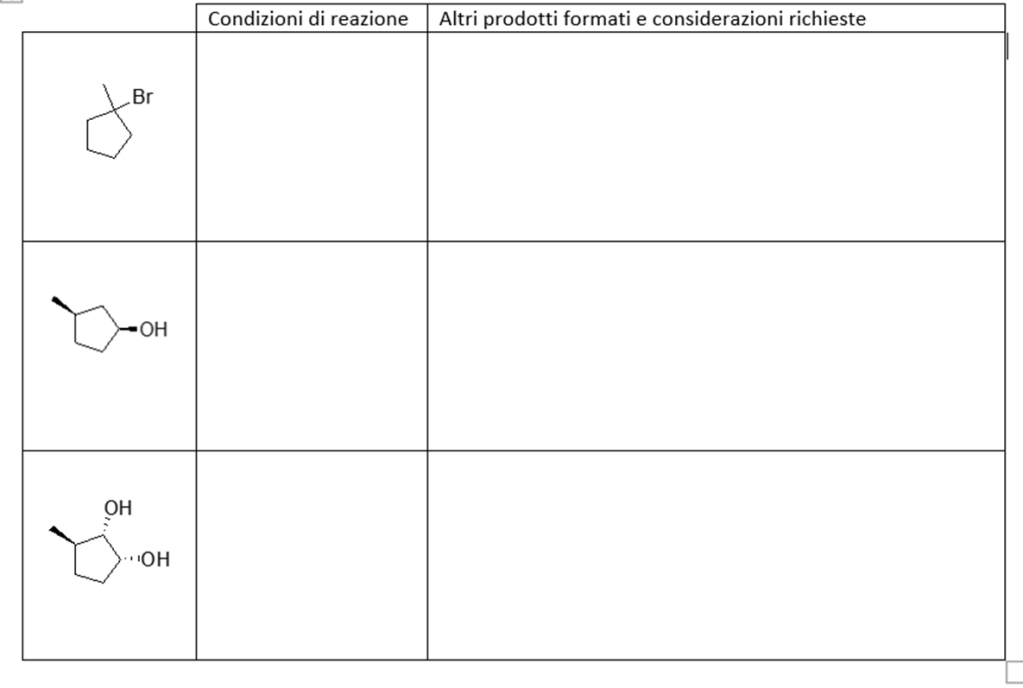
5. Partendo dall’opportuno alchene, illustrare il meccanismo di reazione della sintesi del seguente composto. Indicare eventuali altri prodotti fornendo per tutti il nome IUPAC completo di stereochimica.
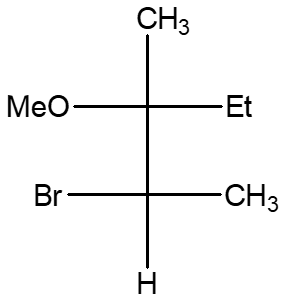
6. Scrivere tutte le strutture limite di risonanza del seguente carbocatione

7. Disporre i seguenti composti in ordine di acidità crescente e motivare la risposta data

TERZO SET
1. Partendo dall’opportuno alchene, illustrare il meccanismo di reazione della sintesi del seguente composto. Indicare eventuali altri prodotti fornendo per tutti il nome IUPAC completo di stereochimica.
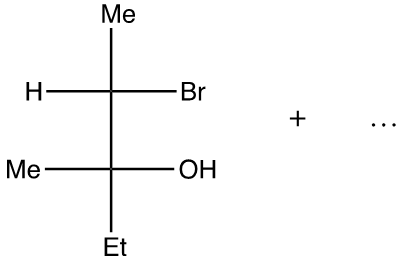
2. Il prodotto principale della reazione di idratazione del seguente composto è diverso rispetto al prodotto principale della reazione di ossimercuriazione/riduzione. Mostrare il meccanismo delle due reazioni, mettendo in evidenza i fattori che determinano la formazione di due prodotti diversi.
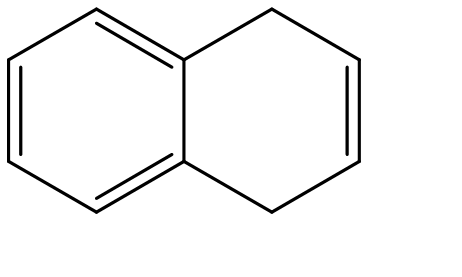
3. Completare il seguente schema inserendo le condizioni di reazioni o i prodotti mancanti. Evidenziare la stereochimica.

4. Disporre i seguenti composti in ordine di acidità crescente e spiegare sinteticamente il perché:
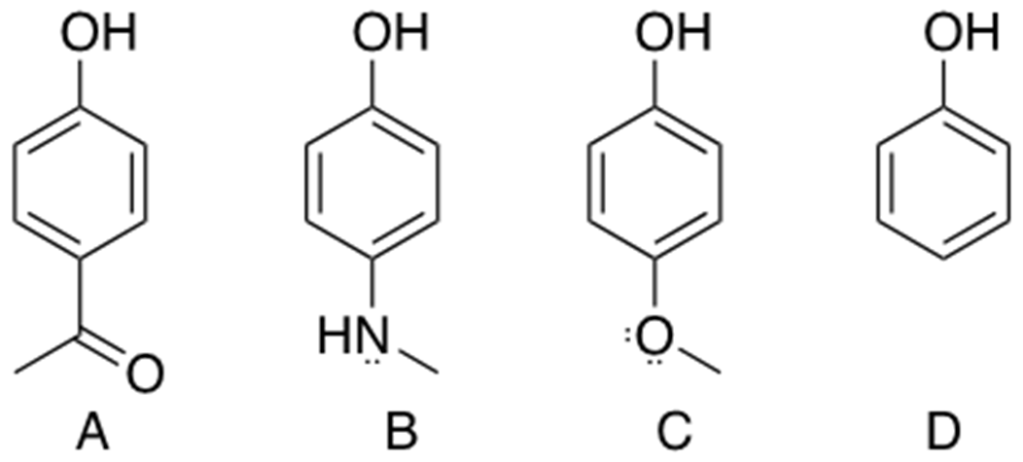
5. Dare il nome IUPAC ai seguenti composti:

6. Scrivere i prodotti principali delle seguenti reazioni.
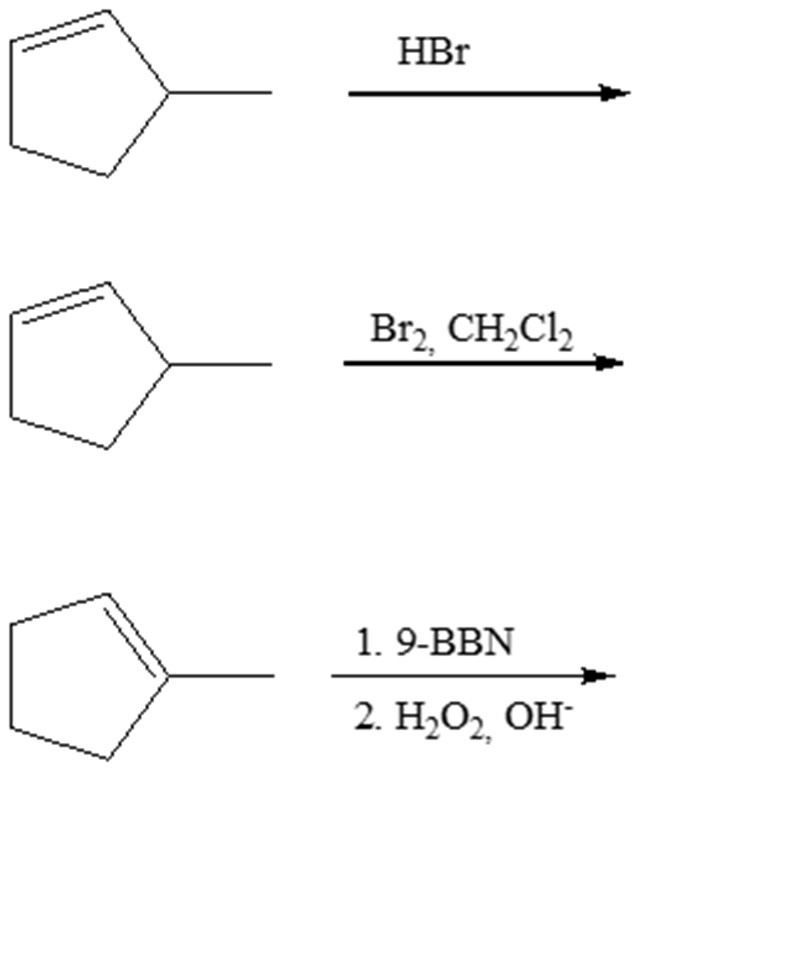
7. Ordinare i seguenti composti dal valore più alto di calore di idrogenazione (1) al valore più basso (3)

Cosa fare se si riscontrano difficoltà o se si hanno dubbi:
-rivedere gli argomenti problematici (NB: non si possono risolvere gli esercizi senza aver studiato la teoria, per cui sarà necessario studiare e approfondire l’argomento ed eventualmente-successivamente-esercitarsi ulterioremente utilizzando sia gli esercizi del libro sia quelli presenti su questo blog).
-contattare il docente: è possibile sia chiedere spiegazioni a lezione, sia fare ricevimento (anche in gruppo)
n7-secondo set – Scrivo il ragionamento per vedere se è corretto
A-> acido più forte. Il gruppo NO2 permette un’attrazione per risonanza grazie al doppio legame N=O, viene diminuita la densità elettronica nell’anello rendendo l’acido più disponibile a cedere il protone e quindi più forte.
B –> meno forte di A ma il cloro attrae gli elettroni per via induttiva e diminuisce la densità elettronica.
C e D –> Il gruppo metossi ed il metile donano gli elettroni all’anello aumentando la densità elettronica e rendendo i composti meno acidi, meno disposti a donare il protone. L’effetto di donazione del metossi è più forte del metile per via delle due coppie di elettroni che ha l’ossigeno in CH3OR che vengono donate per risonanza all’anello.
Ordine acidità dal meno acido al più acido : c>d>b>a
LikeLike
L’ordine è corretto. Gli effetti che vai a valutare vanno ovviamente a influenzare la stabilità delle basi coniugate (dovresti ragionare su queste). Se il sostituente allontana elettroni, diminuisce la densità elettronica, rendendo la base coniugata più stabile. I sostituenti che donano elettroni destabilizzano, invece, la base coniugata.
LikeLike
va bene, grazie per la risposta fuori orario
LikeLike