Verso la seconda prova intercorso: esercitazione

Di seguito troverete 3 set di esercizi che possono essere usati come simulazioni per la prova stessa per capire se ci sono argomenti ancora poco chiari o su cui dovete ancora esercitarvi.
Suggerimento: per poter usare questi esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 90 minuti per ciascun set.
PRIMO SET
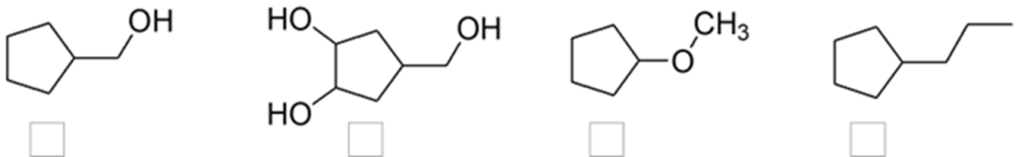
1. Disporre i seguenti composti in ordine di solubilità crescente in acqua. Indicare l’ordine inserendo i numeri nei riquadri sotto le strutture: 1= il meno solubile, 4= il più solubile
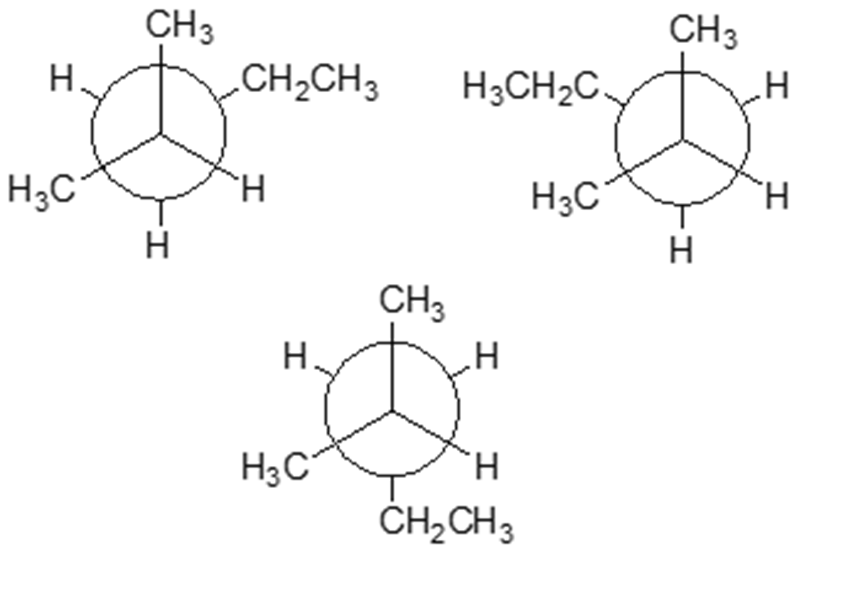
2. Cerchiare quella che, tra le seguenti, è la conformazione meno stabile del 2-metilpentano e spiegare quali sono i fattori che la rendono tale:
3. Scrivere, in proiezione di Newman secondo i legami C1-C2 e C5-C4, uno dei conformeri a sedia del trans-1,4-dimetilcicloesano. Poi, effettuare l’inversione d’anello e dire qual è il conformero più stabile
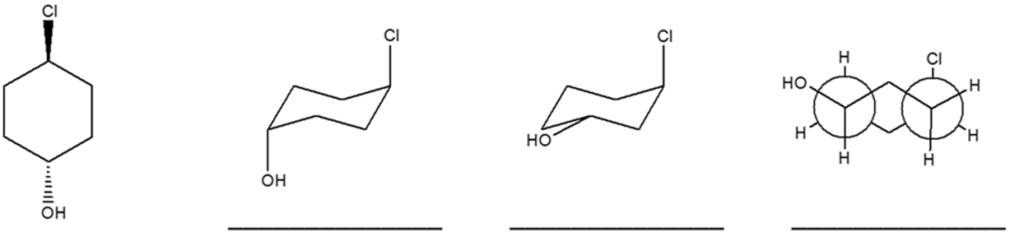
4. Dire se le strutture riportate a destra sono isomeri conformazionali, isomeri geometrici, isomeri ottici, isomeri costituzionali, o lo strutture identiche rispetto alla seguente struttura a segmenti:
5. Calcolare il numero massimo di stereoisomeri possibili per la seguente struttura. Scriverne uno a scelta e determinare la configurazione assoluta dei carboni chirali

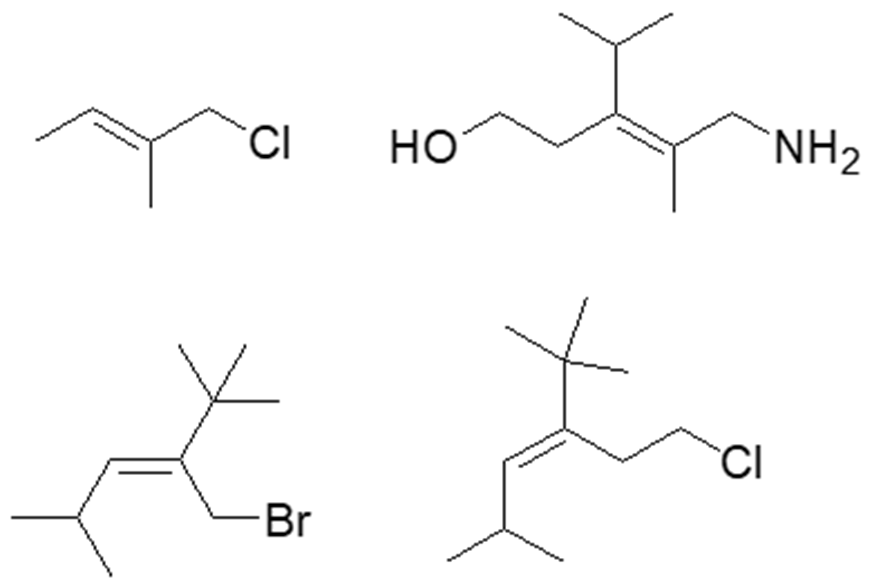
6. Indicare con una freccia i doppi legami che presentano geometria Z
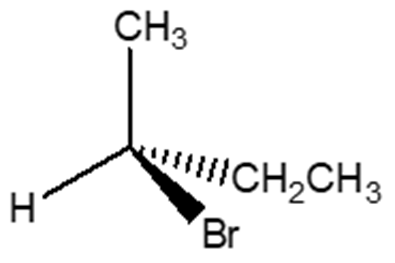
7. Attribuire la configurazione assoluta al seguente carbonio chirale:
8. Dire quale dei seguenti composti non è otticamente attivo:

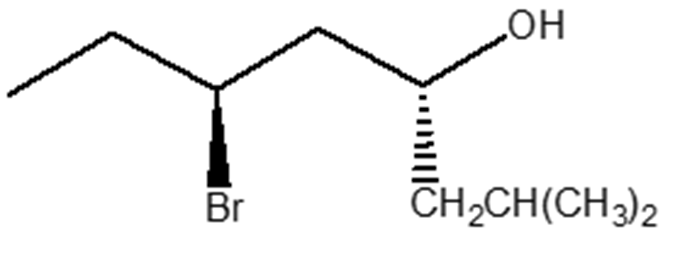
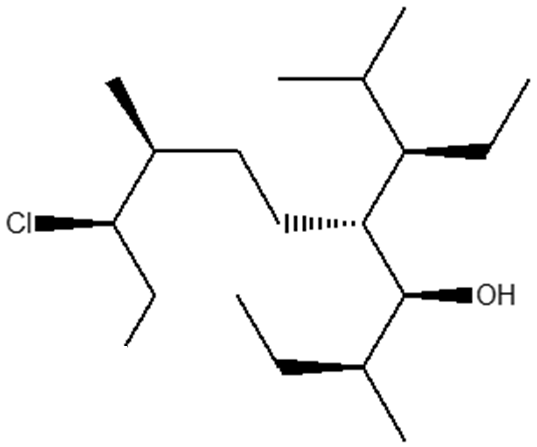
9. Assegnare il nome IUPAC comprensivo di stereochimica ai seguenti composti:
10. Stabilire le configurazioni assolute dei carboni chirali presenti nelle seguenti molecole (NB: la notazione va riportata vicino ai carboni cui fa riferimento) e dire qual è la relazione stereochimica esistente tra i composti di ciascuna coppia (enantiomeri/diastereoisomeri/stesso composto/altro):

11.Prendere in considerazione il (2R,3S)-2-bromo-3-esanolo e completare la seguente tabella, disegnando o scrivendo quanto richiesto in ogni cella

12. Disegnare un diagramma di energia potenziale per la rotazione di 360° del legame C2-C3 del 2-metilbutano, partendo da uno dei conformeri meno stabili e disegnando tutte le conformazioni corrispondenti ai massimi e ai minimi di energia.
SECONDO SET
1. Disegnare la proiezione di Newman secondo il legame C2-C3 del conformero meno stabile del 2,3-dimetilbutano.
2. Disegnare la proiezione di Newman secondo il legame C2-C3 del conformero più stabile del seguente composto

3. Disegnare il conformero a minore energia del trans-1-terz-butil-4-metilcicloesano e del cis-1-terz-butil-4-metilcicloesano.
Poi, confrontare tra loro i due isomeri geometrici
Quale dei due sarà quello più stabile? Perché?
4. Quello riportato di seguito è il diagramma delle variazioni di energia potenziale rispetto all’angolo diedro per l’1,2-dicloroetano.

a) A cosa corrispondono A, C, E, G?
b) Disegnare le proiezioni di Newman di tutti i conformeri eclissati, indicandoli con la lettera corrispondente sul grafico.
c) Discutere dei fattori che giustificano la minore energia potenziale dei conformeri più stabili.
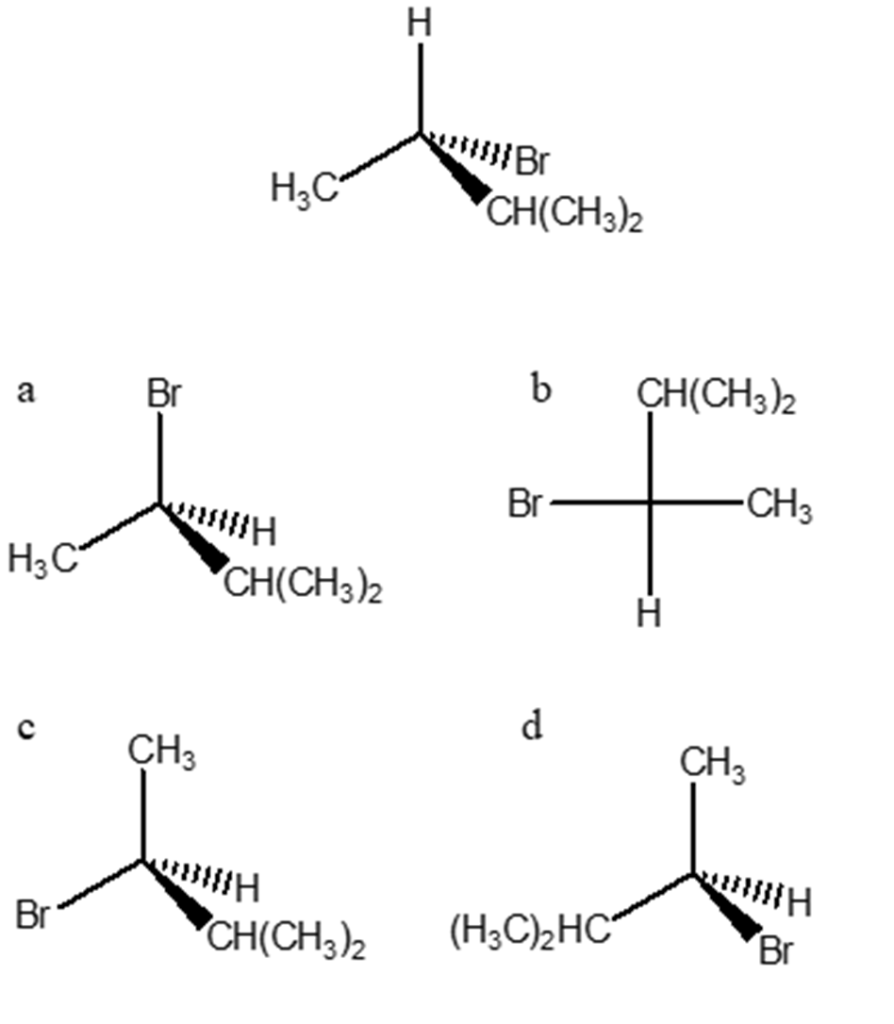
5. Dire quale tra le strutture a-d è un’atra rappresentazione del seguente composto.
6. Stabilire le configurazioni assolute dei carboni chirali e dire qual è la relazione esistente tra i seguenti composti (enantiomeri/diastereoisomeri/stesso composto/isomeri costituzionali/altro)
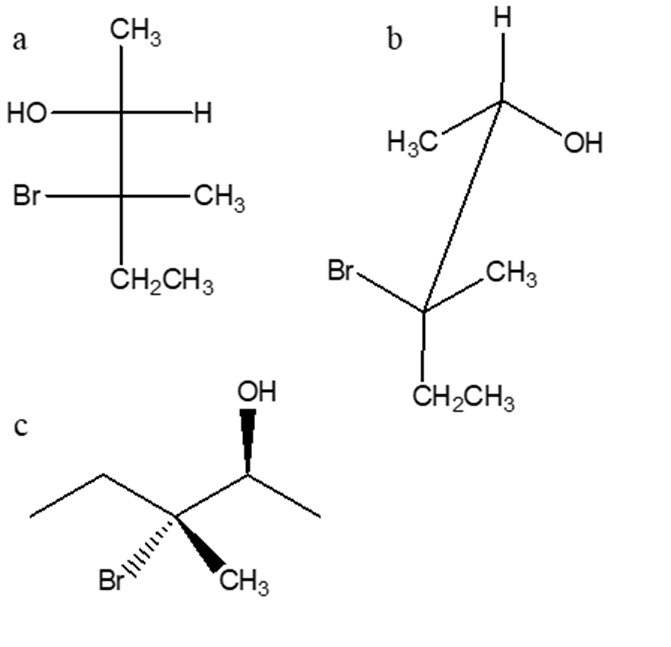
a e b sono
b e c sono
a e c sono
7. Qual è il numero massimo di stereoisomeri per il seguente composto?

8. Quali dei seguenti composti è otticamente attivo? NB: è possibile scegliere più opzioni
a) (2R,3S)-2,3-dibromoesano
b) (2R,3S)-2,3-dibromobutano
c) (2R,3R)-2,3-dibromobutano
d) (1S,2S)-1,2-dibromocicloesano
9. Scrivere, in proiezione di Fischer, il (2R,3S)-2-bromo-3-metil-3-esanolo.
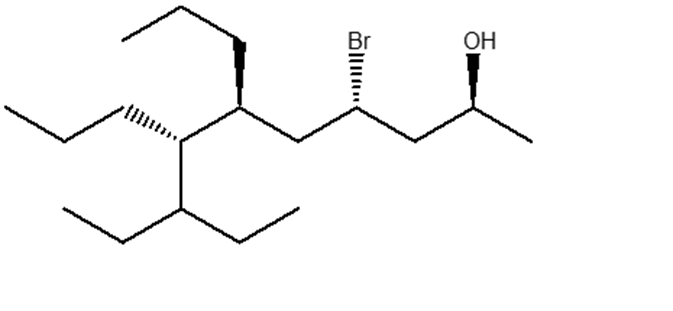
10. Assegnare il nome IUPAC comprensivo di stereochimica ai seguenti composti:

TERZO SET
1. Disegnare la proiezione di Newman secondo il legame C3-C4 del conformero più stabile del 2- metilesano
2. . Disegnare il conformero a sedia meno stabile del trans-1-t-butil-3-metilcicloesano. Spiegare brevemente i fattori che rendono questo conformero meno stabile rispetto a quello che si ottiene effettuando l’inversione della sedia
3. Quello riportato di seguito è il diagramma delle variazioni di energia potenziale rispetto all’angolo diedro per l’1,2-dicloroetano.

a) A cosa corrispondono A, C, E, G ?
b) Disegnare le proiezioni di Newman di tutti i conformeri eclissati, indicandoli con la lettera corrispondente sul grafico
c) Discutere dei fattori che giustificano la minore energia potenziale dei conformeri più stabili
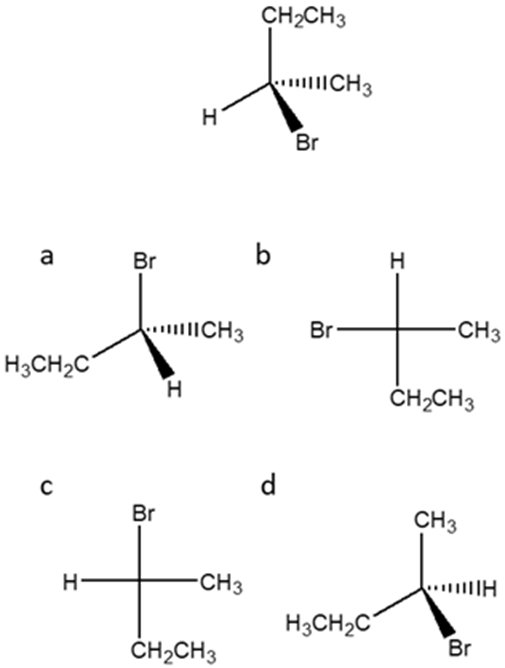
4. Dire quale tra le strutture a-d rappresenta l’enantiomero del seguente composto
5. Dire qual è la relazione esistente tra i seguenti composti (enantiomeri/diastereoisomeri/ isomeri geometrici/isomeri conformazionali/ stesso composto/isomeri costituzionali/altro)
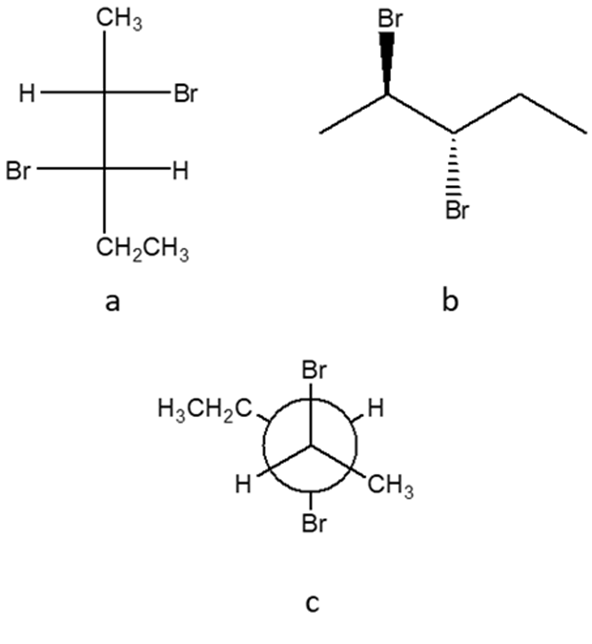
a e b sono
b e c sono
a e c sono
6. a) Qual è il numero massimo di stereoisomeri per il seguente composto?

b) Disegnare e attribuire il nome IUPAC comprensivo di stereochimica ad uno dei possibili stereoisomeri
7. Quali dei seguenti composti è otticamente attivo? NB: è possibile scegliere più opzioni (3pt)
a) (2R,3S)-2,3-dibromobutano
b) (2R,3S)-2,3-dibromoesano
c) (2R,3R)-2,3-dibromobutano
d) (1S,2S)-1,2-dibromocicloesano
8. Quale delle seguenti strutture corrisponde al (2R,3S)-2-bromo-3-metilesano?

9. Denominare le seguenti molecole secondo le regole del sistema di nomenclatura IUPAC (NB: il nome IUPAC deve includere anche le informazioni relative alla stereochimica):

Cosa fare se si riscontrano difficoltà o se si hanno dubbi:
-rivedere gli argomenti problematici (NB: non si possono risolvere gli esercizi senza aver studiato la teoria, per cui sarà necessario studiare e approfondire l’argomento ed eventualmente-successivamente-esercitarsi ulterioremente utilizzando sia gli esercizi del libro sia quelli presenti su questo blog).
-contattare il docente: è possibile sia chiedere spiegazioni a lezione, sia fare ricevimento (anche in gruppo)
Esercizio 5 primo set.
Il numero massimo di stereoisomeri possibile è 8
LikeLike
Sì. Gli elementi stereogenici sono i due carboni chirali e il ciclo che ammette isomeria cis/trans
LikeLike
Eserizi primo set:
esercizio 1) Ordine di solubilità: quadratini da sinistra verso destra 2-4-3-1.
esercizio 2) Conformazione meno stabile del 2-metilpentano: quella con due interazioni gauche tra etile e metile.
esercizio 3) La conformazione a sedia più stabile è quella con entrambi i sostituenti in equatoriale che puntano in modo opposto essendo trans, ed è pià stabile perché è ridotta la tensione sterica tra i sostituenti e gli idrogeni.
esercizio 4) Confronto, chiamando a il composto da confrontare con (guardando da sinistra a destra) b,c,d.
a e b = stesso composto.
a e c = Isomeri costituzionali , hanno formula bruta C6H11 ma diverso ordine.
a e d = isomeri geometrici, trasformando la proiezione in conformazione a sedia l’OH punta in equatoriale verso l’alto e il cloro in assiale verso l’altro diventano un cicloesano cis.
esercizio 5) 8 stereoisomeri, due centri chirali e il ciclo che puà avere isomeria cis-trans. Formula 2^n, in cui n è il numero di centri stereogenici. 2^3 = 8.
esercizio 6) il doppio legame nel composto con l’ammina ha isomeria Z e anche il doppio legame nel composto col bromo.
esercizio 7) Configurazione assoluta S.
esercizio 8) L’ultimo è un composto meso e quindi non è otticamente attivo perché ha un piano di simmetria interno.
esercizio 9) Nomenclatura:
(4R,6S)-6-Bromo-2-metilottan-4-olo
(3S,4R,8S,9R)-9-Cloro-5-[(1R)-1-Etil-2-metilpropil]-3,8-dimetilundecan-4-olo.
Esercizio 10
a) Diastereoisomeri.
b) Diastereoisomeri.
c) Non capisco se sono enantiomeri o lo stesso composto. Se mi metto davanti alla sedia l’OH finisce alla destra del mio campo visivo e quindi poi risultano essere lo stesso composto, ma se guardo la sedia così e la trasformo nella struttura a segmenti l’Oh finisce sulla sulla sinistra e si invertono le configurazioni.
esercizio 11- Ho scritto la proiezione di Fischer del (2R,3S)-2-bromo-3-esanolo con le stesse configurazioni dei carboni chirali e le altre cose che richiede la traccia. La proiezione di Newman più stabile del diastereoisomero del composto che mi risulta essere (2R,3R)-2-bromo-3-esanolo dovrebbe essere quella con il CH3 in anti con il CH2CH2CH3.
esercizio 12- Diagramma di energia potenziale , forme più rilevanti: a 180 gradi ho in anti il metile con l’etile che è quella con meno energia e quindi più stabile. A 0 gradi e 360 gradi ho le conformazioni eclissate dove si eclissano il metile e l’etile. A 60 gradi e 300 gradi ho i conformeri gauche con interazioni gauche tra metile ed etile.
LikeLike
in realtà ricontrollando l’esercizio 8, l’ultimo non mi sembra più un composto meso perché lo sarebbe se avesse configurazione R,S ma nella struttura a segmenti la configurazione è R,R e quindi non trovo più la simmetria interna
LikeLike
8. assolutamente no. Stabilisci le config assolute di tutti
9. manca la configurazione del C5 del secondo composto. Ricontrolla le configurazioni
10. Devi stabilire le configurazioni assolute per confrontare i due ciclik
LikeLike
Primo set (esercizio numero 9):
(3S,5R)-3-bromononan-5-olo
(3S,4S,5S,8S,9R)-9-cloro-5-[(5R)-1-etil-2-metilpropil)-3,8-dimetilundecan-4-olo
Secondo set (ese numero10)
(2S,4S,6R,7S)-4-bromo-8-etil-6,7-dipropildecan-2-olo
(1R,3R)-3-cloro-N-etil-N-metil-1-metossicicloesan-1-ammina
terzo set (esercizio n 9)
(4S,6S,7R)-1,7-dibromo-6-isopropil-4-metilnonano
(4E,6R,9R)-9-ciclopentil-4-metil-6-(1-metilpropil)dec-4-ene.
LikeLike
Primo set: 1. controlla il nome; 2. controlla la config del C6 del I composto. Terzo set: controlla configurazione 4 del primo composto. Ultimo composto: il ciclo ha priorità.
LikeLike
Esercizi secondo set.
Esercizio 1- conformero meno stabile con i metili eclissati.
Esercizio 2- Nel conformero più stabile ho messo in anti il metile con l’etile.
Esercizio 3 – Il trans è più stabile perchè nella sua conformazione più stabile (a meno energia) ha entrambi i sostituenti in equatoriale.
Esercizio 4 – Proiezioni eclissate: 0 gradi i entrambi i clori si eclissano in alto; 120 gradi il cloro in alto eclissa l’idrogeno e in basso a destra l’altro cloro eclissa l’idrogeno; 360 gradi i due clori si eclissano in alto.
Nei conformeri più stabili avvengono diversi fenomeni come l’iperconiugazione, ovvero la momentanea sovrapposizione degli orbitali sigma di legame e di anti legame che è la causa maggiore della maggior stabilità del conformero sfalsato, in più i sostituenti più ingombranti si posizionano per ridurre il più possibile le interazioni steriche che invece aumentano l’energia.
Esercizio 5- Il composto iniziale da confrontare ha configurazione assoluta S, poiché effettuando uno scambio mettendo l’idrogeno sul cuneo tratteggiato ottengo configurazione R. L’altro composto che rappresenta quello inziale è la lettera c perché ha la stessa configurazione , gli altri hanno tutti configurazione R.
Esercizio 6 – a e b sono diastereoisomeri, b e c sono diastereoisomeri, a e c sono enantiomeri.
Esercizio 7 – Il composto può avere 8 stereoisomeri. Ha due centri chirali e un doppio legame che può avere isomeria E o Z (generando quindi stereoisomeri), l’altro doppio legame non può avere isomeria E o Z perché un carbonio sp2 lega due sostituenti uguali e quindi non può generare uno stereoisomeri e non è un centro stereogenico.
Esercizio 8 – A, C e D sono otticamente attivi. B è un composto meso.
Esercizio 9 – Ho scritto la proiezione di Fischer avente stesse configurazioni.
Esercizio 10 – Nomenclatura
(2S,4S,6S,7S)-4-Bromo-8-etil-6,7-dipropildecan-4-olo
(1R,3R)-3-cloro-N-Etil-N-metil-1-metossicicloesan-1-ammina.
LikeLike
Esercizio 3: e quindi?
LikeLike
Prof ho un dubbio, nell’esercizio 7 del secondo set, gli stereoisomeri sono massimo 16? perché oltre i due centri chirali (che quindi danno 4 stereoisomeri) ci sono anche due stereocentri che danno isomeria geometrica, quindi ho pensato di moltiplicare 2² (degli stereoisomeri possibili per i carboni chirali) per 2² (le possibili combinazioni di cis/trans che si possono avere tra gli altri due stereocentri che danno isomeria geometrica). oppure dovevo fare direttamente 2⁴ contando tutti i possibili centri stereogenici?
LikeLike
Prof ho un dubbio, nell’esercizio 7 del secondo set, gli stereoisomeri sono massimo 16? perché oltre i due centri chirali (che quindi danno 4 stereoisomeri) ci sono anche due stereocentri che danno isomeria geometrica, quindi ho pensato di moltiplicare 2² (degli stereoisomeri possibili per i carboni chirali) per 2² (le possibili combinazioni di cis/trans che si possono avere tra gli altri due stereocentri che danno isomeria geometrica). oppure dovevo fare direttamente 2⁴ contando tutti i possibili centri stereogenici?
LikeLike
Attenzione: 1. Parliamo di unità e non di centri stereogenici; 2. Il doppio legame è un’unità stereogenica solo se ammette isomeria geometrica
LikeLike
https://chimicaorganicadistabif.com/2024/11/04/stereochimica-approfondimenti/ controlla questo materiale
LikeLike