Tensione torsionale, sterica e angolare

Gli isomeri conformazionali si interconvertono rapidamente l’uno nell’altro, in conseguenza della libera rotazione intorno al legame singolo. In genere, questi isomeri non possono essere separati l’uno dall’altro.
In virtù della rotazione intorno al legame sigma, per uno stesso composto è possibile scrivere diverse conformazioni.
In realtà, questa rotazione intorno al legame singolo non è completamente libera, dato che, nel momento in cui gli elettroni di legame vengono a trovarsi alla minima distanza (nelle conformazioni eclissate) ci sarà una repulsione tra di essi che porterà all’instaurarsi della tensione torsionale. La tensione torsionale è dunque la resistenza opposta alla rotazione dei legami ed è dovuta alla repulsione tra gli elettroni di legame. I conformeri sfalsati sono ulteriormente stabilizzati dall‘iperconiugazione, che vede la sovrapposizione momentanea di un orbitale di legame sigma, occupato da elettroni, e un orbitale di antilegame vuoto di un C-H adiacente. I due orbitali si trovano in una posizione favorevole per la sovrapposizione solo nei conformeri sfalsati.
A seguire, vediamo come questi due fattori determinano le differenze di energia nelle conformazioni dell’etano.
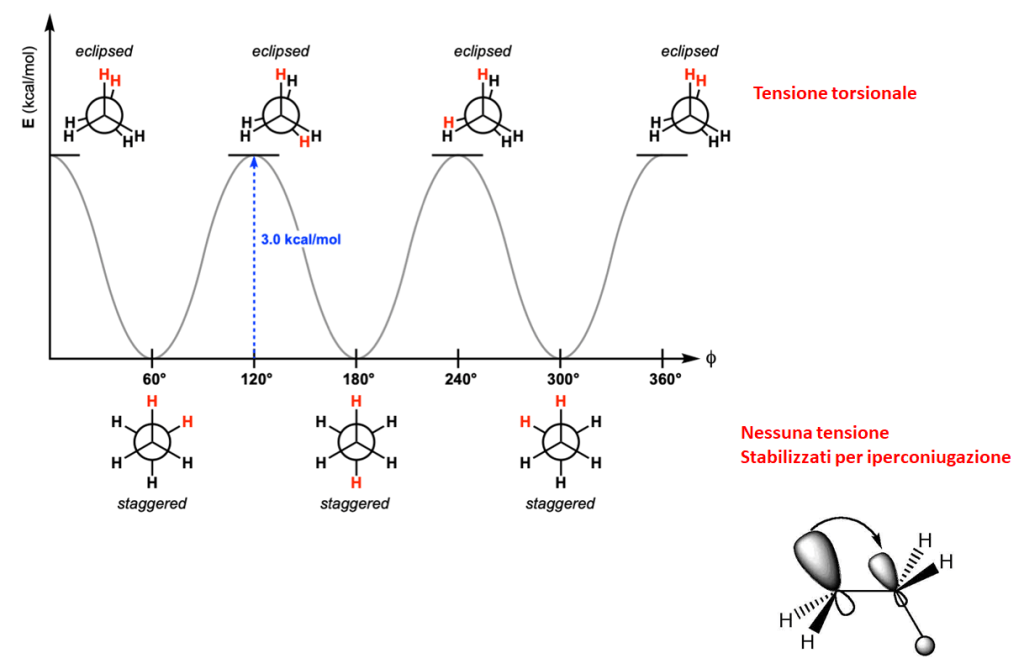
Se ai carboni sono legati dei gruppi più ingombranti dell’idrogeno, dobbiamo tener conto anche della tensione sterica, che è il risultato della repulsione tra le nuvole elettroniche di atomi o gruppi. Segue l’esempio delle conformazioni del butano secondo il legame C2-C3. Gruppi che danno maggiore ingombro sterico, contribuiranno maggiormente alla tensione sterica.

Infine, nel caso dei cicloalcani, è necessario tener presente un terzo tipo di tensione, che è quella angolare (o di anello), che si manifesta quando gli angoli di legame deviano dal valore ideale.
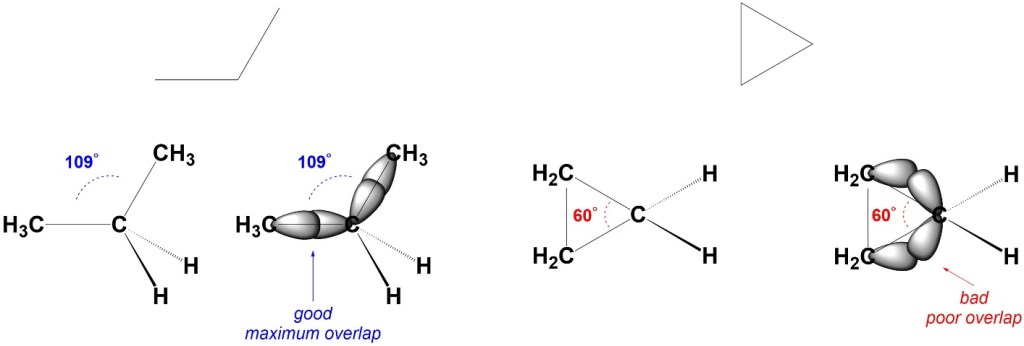
Nel caso del cicloesano, esistono diverse conformazioni caratterizzate da diverse energie. Le due conformazioni più stabili, quelle a sedia, sono prive di tensione angolare, dato che l’angolo di legame è molto vicino a quello tetraedrico, e di tensione torsionale, dato che tutti i legami C-H sono sfalsati. In presenza di sostituenti diversi dall’idrogeno, dobbiamo tener, invece, conto della eventuale tensione sterica. Il conformero a sedia con un sostituente in posizione equatoriale ha meno tensione sterica ed è perciò più stabile del conformero con il sostituente assiale. Un sostituente in posizione assiale ha interazioni 1,3-diassiali sfavorevoli.
In presenza di più sostituenti, dobbiamo valutare la stabilità relativa dei due conformeri a sedia caso per caso.
NB: questi appunti sono utili solo se prima si è studiata la teoria utilizzando il libro di riferimento.
Per informazioni su come scrivere le varie rappresentazioni, vedere https://chimicaorganicadistabif.com/2024/10/18/alcune-rappresentazioni-strutturali-dei-composti-org
Per i cicloesani a sedia e l’inversione dell’anello, vedere https://chimicaorganicadistabif.com/2024/10/18/cicloesano-inversione-di-anello/
Altro materiale utile si trova qui: https://chimicaorganicadistabif.com/2024/10/18/analisi-conformazionale-10/
You must be logged in to post a comment.