Verso la prima prova intercorso: esercitazione

Di seguito troverete 3 set di esercizi che possono essere usati come simulazioni per la prova stessa per capire se ci sono argomenti ancora poco chiari o su cui dovete ancora esercitarvi.
Suggerimento: per poter usare questi esercizi come test di autovalutazione, svolgerli senza l’ausilio di libro/appunti ed impiegando un tempo massimo di 90 minuti per ciascun set.
PRIMO SET
1. Per lo ione solfato (SO42-) è possibile scrivere diverse strutture di risonanza. Scrivere la struttura di Lewis che rappresenta una delle strutture che contribuisce maggiormente all’ibrido di risonanza. Calcolare le cariche formali per tutti gli atomi.
2. Quali sono la geometria, l’angolo di legame e l’ibridazione previste per il catione metile?
3. Rispondi alle domande sulla seguente molecola:
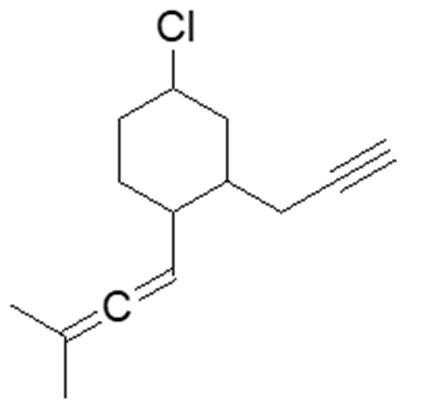
a) Quante coppie solitarie sono presenti sul cloro e quali orbitali occupano?
b) Quanti atomi di carbonio ibridati sp sono presenti?
c) Indicare con una freccia sulla figura il legame singolo carbonio-carbonio più corto.
4. Nella molecola dell’esercizio 3, sono presenti diversi legami multipli. Fornire una descrizione dettagliata dei legami formati dai due carboni impegnati nel triplo legame (informazioni necessarie: atomi con cui formano i legami; orbitali molecolari formati; orbitali atomici/ibridi coinvolti).
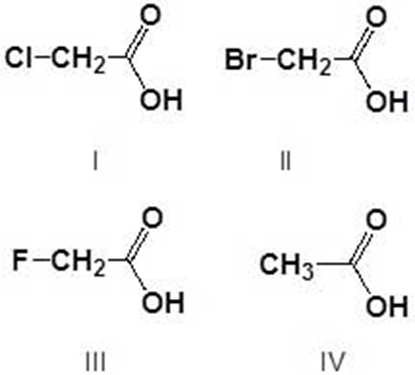
5. Disporre i seguenti composti in ordine di acidità crescente (dal meno acido al più acido) e spiegare sinteticamente il perché:
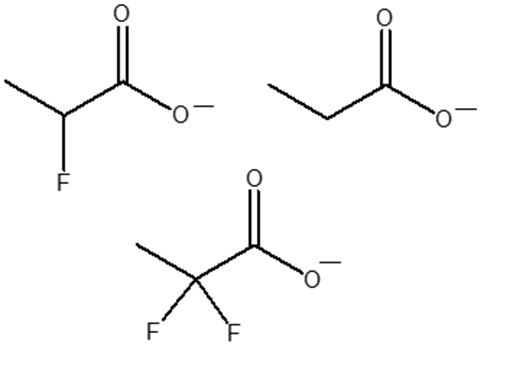
6. Disporre i seguenti composti in ordine di basicità crescente (dal meno basico al più basico) e spiegare sinteticamente il perché:
7. A quale valore di pH un composto con pKa 7.2 sarà presente in soluzione al 50% nella forma acida?
8. Scrivere e attribuire il nome IUPAC al composto di formula C5H12 che possiede solo idrogeni primari.
9. Scrivere la formula condensata e la formula molecolare del seguente composto:
4-bromo-2,2-dimetilesano
10. Scrivere la struttura a segmenti del seguente composto e dire se il nome IUPAC è corretto; se non lo è, apportare le dovute correzioni:
1-butil-1-metil-3-cicloesanolo
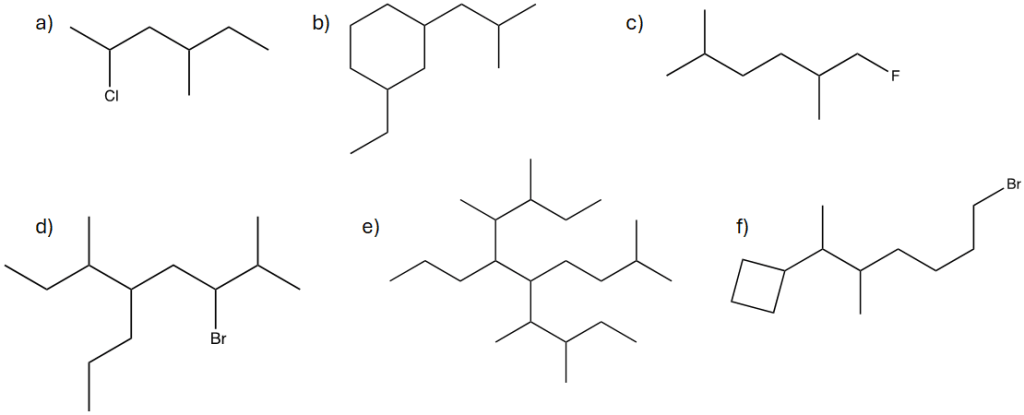
11. Assegnare il nome IUPAC ai seguenti composti:

SECONDO SET
1. Completare la seguente struttura di Lewis e calcolare la carica formale per gli atomi di carbonio e ossigeno. Attenzione: se è possibile avere più strutture di risonanza, scegliere una di quelle che contribuiscono di più all’ibrido di risonanza.

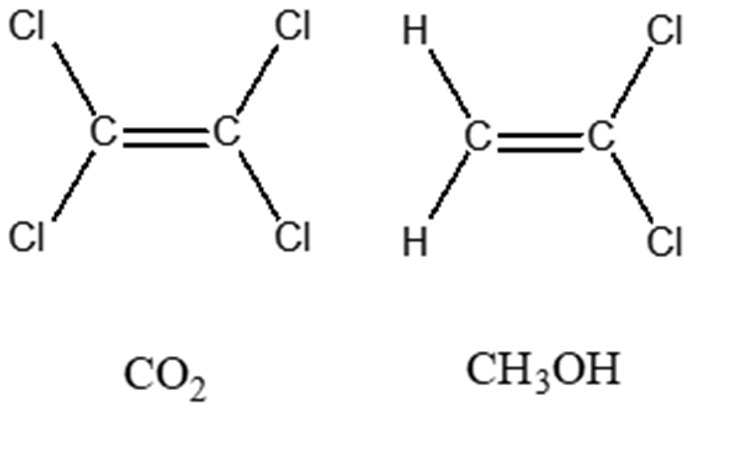
2. Cerchiare la/le molecola/e che ha/hanno momento dipolare nullo.
3. La struttura di seguito riportata è quella della chinina. Osservare gli atomi e i legami indicati da lettere e numeri e completare le seguenti frasi o rispondere alle seguenti domande.

I) La coppia solitaria dell’atomo di azoto a si trovano in un orbitale_______; quella dell’atomo di azoto b si trova in un orbitale_______
II) Osservare il legame indicato dalla c ed indicare il tipo di orbitale/i molecolare/i:
III) Quali orbitali atomici si sovrappongono per formare il legame c?
IV) Qual è il legame più corto tra quelli indicati dai numeri da 1 a 4?
4. Disporre i seguenti composti in ordine di basicità decrescente (dal più basico al meno basico) e spiegare sinteticamente il perché:

5. Cerchiare l’acido più debole e motivare sinteticamente la scelta.

6. Completare la reazione e dire dove è spostato il seguente equilibrio:

7. Scrivere e attribuire il nome IUPAC al composto di formula C6H12 che possiede solo idrogeni primari e terziari.
8. Disegnare l’ 1-sec-butil-4-etil-2-metilciclopentano.
9. Scrivere la formula condensata di un isomero strutturale del 2,3-dimetilpentano.
10. Assegnare il nome IUPAC ai seguenti composti:

TERZO SET
1. Completare la seguente struttura di Lewis e calcolare la carica formale per tutti gli atomi diversi dall’idrogeno:
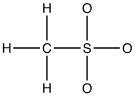
2. Quali sono la geometria, l’angolo di legame e l’ibridazione previste per l’anione metile?
3. Nella seguente figura, alcuni dei legami sono indicati da freccia e da una lettera.
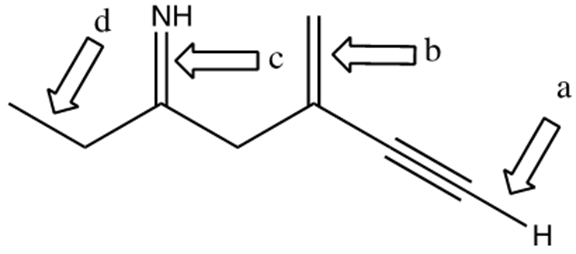
1) Etichettare i legami a-d come singoli, doppi o tripli;
2) indicare il tipo di orbitale/i molecolare/i;
3) dire quali orbitali atomici sono coinvolti nella formazione del legame.
4) Considerando tutti i legami singoli della molecola (ed escludendo i legami C-H) qual è il legame più corto?
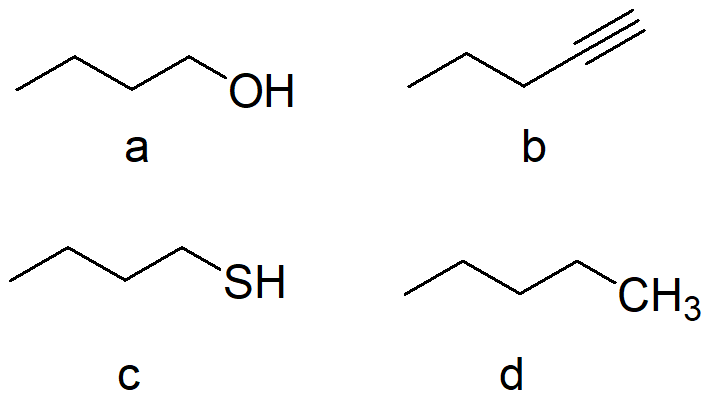
4. Disporre i seguenti composti in ordine di acidità decrescente (dal più acido al meno acido) e spiegare sinteticamente il perché:
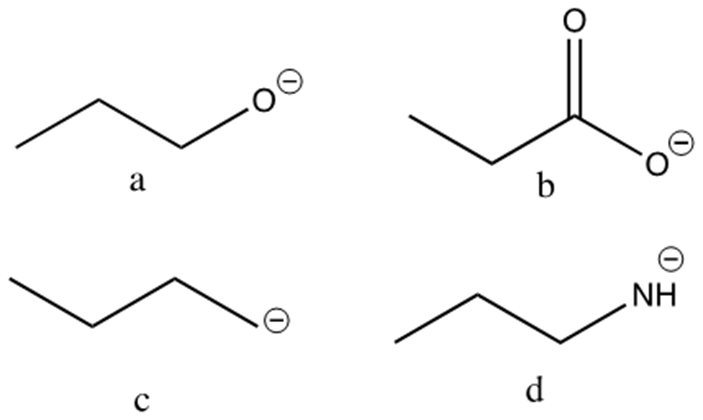
5. Disporre i seguenti composti in ordine di basicità decrescente e spiegare sinteticamente il perché:
6. Scrivere la formula condensata e la formula molecolare del seguente composto: 2,2-dibromo-4-metilesano.
7. Scrivere e attribuire il nome IUPAC al composto di formula C9H18 che possiede solo idrogeni primari.
8. Dire se il seguente nome è corretto. Se non lo è, scrivere il nome IUPAC corretto.
1-bromo-3,4-dietilcicloesano
9. Disegnare il 4-(3-bromo-3-metilbutil)-2-terz-butil-1-etilcicloesano.
10. Denominare le seguenti molecole secondo le regole del sistema di nomenclatura IUPAC:
Cosa fare se si riscontrano difficoltà o se si hanno dubbi:
-rivedere gli argomenti problematici (NB: non si possono risolvere gli esercizi senza aver studiato la teoria, per cui sarà necessario studiare e approfondire l’argomento ed eventualmente-successivamente-esercitarsi ulterioremente utilizzando sia gli esercizi del libro sia quelli presenti su questo blog).
-contattare il docente: è possibile sia chiedere spiegazioni a lezione, sia fare ricevimento (anche in gruppo)
You must be logged in to post a comment.