Acidi e Basi: risposte alle domande più frequenti

Definizioni
Acido di Brønsted-Lowry: specie che cede un protone
Base di Brønsted-Lowry: specie che accetta un protone
Reazioni acido-base: reazione di un acido con una base.
Un acido non può perdere un protone senza la presenza di una base che lo accetta: un acido reagisce sempre con una base. La reazione inversa di una reazione acido-base è anch’essa una reazione acido-base.
In queste reazioni (chiamate anche reazioni di trasferimento protonico) un acido dona un protone ad una base. L’acido si trasformerà nella sua base coniugata, la base nel suo acido coniugato.

pH= -log[H3O+] –>Descrive l’acidità della soluzione
pKa= -logKa –> indica la tendenza del composto a perdere il protone. Si tratta di una caratteristica della molecola, e in quanto tale dipende dalla struttura di quest’ultima.
Domande e risposte
Quando le due specie che reagiscono possiedono entrambe degli idrogeni acidi e delle coppie solitarie come posso capire chi si comporterà da acido e chi si comporterà da base?
Per capire chi perde il protone e chi lo acquista, bisogna confrontare i valori di pKa: L’acido che ha il valore di pKa più basso (acido più forte) è la specie che agisce da acido, perdendo un protone.

Come faccio a capire dove è spostato l’equilibrio?
L’equilibrio favorisce la formazione dell’acido più debole. Bisogna quindi individuare le specie che si comportano da acido (sia tra i reagenti sia tra i prodotti) e confrontare i valori di pKa (o, comunque, la forza acida relativa).
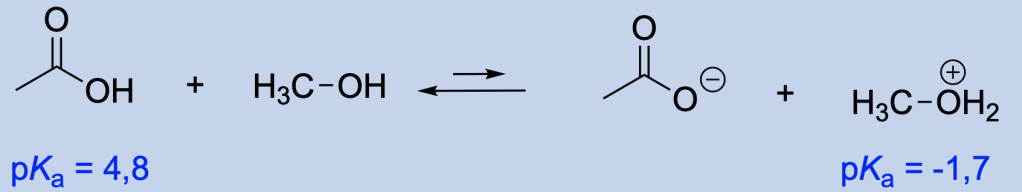
Come faccio a stimare la forza acida relativa di due composti sulla base della loro struttura?
Innanzitutto è necessario individuare il protone più acido in ciascun composto, applicando le regole che seguono (1-4), e poi bisogna confrontare i composti tra di loro, usando le stesse regole.
Ricordandoci che più debole è la base, più forte è il suo acido coniugato, è utile ragionare proprio sulla stabilità relativa delle basi coniugate. Dunque: base più stabile=base più debole=acido coniugato più forte.
1) Se i protoni sono legati ad atomi di dimensioni simili (es.: C,N,O,F), l’acido più forte è costituito da quello con il protone legato all’atomo più elettronegativo.
Perchè? La base coniugata con la carica negativa localizzata sull’atomo più elettronegativo sarà più stabile (e quindi più debole), in quanto questo “tollera” meglio la carica negativa.
Ricorda: l’elettronegatività di un atomo è influenzata anche dalla sua ibridazione (maggiore è il carattere s degli orbitali ibridi, maggiore sarà l’elettronegatività, dato che gli elettroni di legame saranno più vicini al nucleo). Dunque, un C sp è più elettronegativo di un C sp2, che è più elettronegativo di un C sp3.
2) Se i protoni sono legati ad atomi di differenti dimensioni (es.: F, Cl, Br, I), l’acido più forte risulterà quello il cui protone è legato all’atomo più grande.
Perchè? La base coniugata dell’atomo di maggiori dimensioni sarà più stabile in quanto gli elettroni di valenza si troveranno in orbitali che occuperanno via via un volume maggiore (es. 3sp3 vs. 4sp3). Questo significa che l’anione che deriva dall’atomo più grande sarà caratterizzato da una minore densità elettronica e sarà quindi più stabile rispetto a quello che deriva da un atomo di dimensioni minori.
Il seguente schema può essere utile per riassumere i punti 1 e 2.

3) Una caratteristica strutturale che ha effetto sull’acidità è la possibilità di avere risonanza: se la base coniugata è stabilizzata per risonanza, questo determina un aumento della forza dell’acido.
Perchè? La delocalizzazione degli elettroni aumenta la stabilità del sistema (NB: questo concetto sarà ulteriormente approfondito in seguito) diminuendo, nel caso della base coniugata, la densità elettronica sul singolo atomo.
4) Sostituenti (ovvero atomi che hanno sostituito un atomo di idrogeno) elettronegativi, che attirano versi di sé gli elettroni di legame, aumentano la forza dell’acido (effetto induttivo elettron-attrattore).
Perchè? Dato che questi atomi attirano a sé gli elettroni di legame, vanno a diminuire la densità elettronica sull’atomo carico negativamente, contribuendo in questo modo alla stabilità della base coniugata.
NB: mentre per i punti 1 e 2 stiamo ragionando sull’atomo che, nella base coniugata porterà la carica negativa, nel caso dell’effetto induttivo elettron-attrattore, ragioniamo su atomi che si trovano distanti 2,3 o più legami dall’atomo da cui verrà strappato il protone. In questo caso dobbiamo prendere in considerazione solo elettronegatività dell’atomo e distanza dal sito di interesse.
Errore classico: per gli alogeni (e a volte anche per atomi di altri elementi), confondere l’effetto diretto descritto ai punti 1 e 2, con l’effetto induttivo elettron-attrattore, descritto al punto 4. Nel primo caso entra in gioco la dimensione degli atomi, nel secondo caso l’elettronegatività. Si tratta infatti di due effetti diversi, che non vanno MAI confusi.
SUGGERIMENTO: quando si confrontano due o più composti, concentrarsi sempre sulle differenze, tralasciando le caratteristiche strutturali che sono comuni a tutti.
NB: stabilire la forza relativa di due acidi significa anche individuare quale dei due avrà pKa minore e quale avrà pKa maggiore.
Come faccio a stimare la basicità relativa di due composti sulla base della loro struttura?
Tralasciando per ora casi specifici che analizzeremo al momento opportuno, i punti 1-4 possono essere utilizzati anche per ragionare sulla forza delle basi. Ricordiamo che base più stabile=base più debole.
Come faccio a determinare il sito di protonazione di un composto? è necessario individuare l’atomo più basico nella molecola (vedi “strategia per la risoluzione dei problemi” pag. 58) E di un composto con elettroni delocalizzati? In questo caso, è necessario analizzare le strutture limite di risonanza per individuare l’atomo più basico, caratterizzato da una densità elettronica maggiore (vedi “strategia per la risoluzione dei problemi” pag. 58).
Come faccio a capire se, in una soluzione ad un determinato valore di pH, un composto si trova nella forma acisa o basica? Tenendo conto che il fatto che un acido perda o meno il protone in una soluzione acquosa dipende sia dal suo pKa sia dal pH della soluzione, è possibile utilizzare l’equazione di Henderson–Hasselbalch, che mette in relazione queste due misure, per capire quale sarà la forma predominante (acida o basica) di un composto in soluzione.
Pingback: CdL Scienze Biologiche – Materiale didattico su acidi e basi | Chimica Organica-DiSTABiF