Acidi e basi

1) Indicare il valore maggiore per ciascuna coppia:
a) il pKa di un acido forte e il pKa di un acido debole
b) la Ka di un acido forte e la Ka di un acido debole
2) Sulla base delle informazioni riportate sotto, indicare dove è spostato il seguente equilibrio acido-base:

3) Per ciascuna coppia acido-base coniugati, identificate la prima specie come acido o base e la seconda specie come base o acido coniugato. Inoltre, disegnare per ogni specie le strutture di Lewis, mostrando tutti gli elettroni di valenza e le cariche formali.
(a) HCOOH / HCOO–
(b) NH4+ / NH3
(c) CH3CH2O– / CH3CH2OH
(d) HCO3– / CO32-
(e) H2PO4– / HPO42-
(f) CH3CH3 / CH3CH2–
(g) CH3S– / CH3SH
4) Qual è l’acido coniugato dell’ammoniaca?
5) Mettere i seguenti composti in ordine di acidità crescente e motivare la scelta:
CH3CH2CH2SH b) CH3CH2CH2NH2 c) CH3CH2CH2OH d) CH3CH2CH2CH3
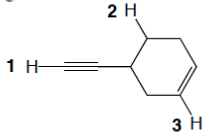
6) Dire quale atomo nella seguente molecola può essere più facilmente deprotonato

7) Elencare i seguenti idrogeni in ordine di acidità crescente (dal valore più basso a quello più alto) e motivare la scelta
8) Nell’acido acetico, CH3COOH, l’idrogeno dell’OH è più acido degli idrogeni del CH3. Spiegare il perchè.
9) Di seguito sono riportate delle coppie di composti, dire quale composto di ciascuna coppia ha il pKa più basso

10) Qual è l’acido più forte tra quelli elencati sotto? Quali caratteristiche strutturali giustificano i valori di pKa riportati?
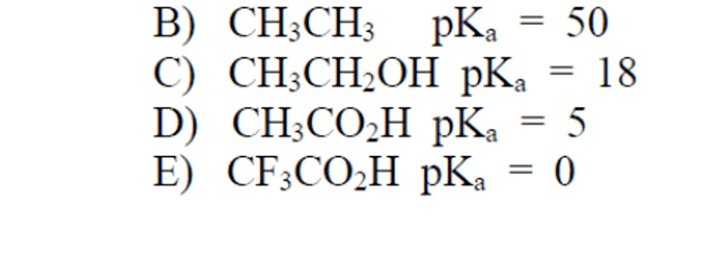
11) Disporre i seguenti composti in ordine di acidità crescente:
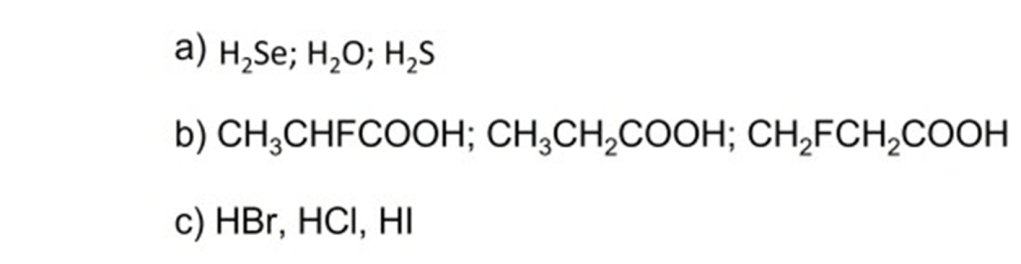
12) Di seguito sono riportate due coppie di composti. Dire quale composto di ciascuna coppia è il più acido e spiegare perché:
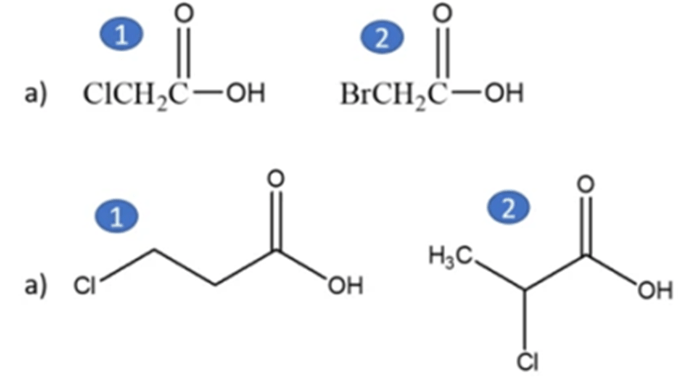
13) Disporre i seguenti composti in ordine di acidità crescente:

14) Mettere i seguenti composti in ordine di acidità decrescente e motivare la scelta:
a) CH3CH2CH2COOH b) CH3CH2CHBrCOOH c) CH3CH2CBr2COOH
d) CH3CHFCH2COOH e) CH3CHBrCH2COOH f) CH3CH2CH2CH2OH
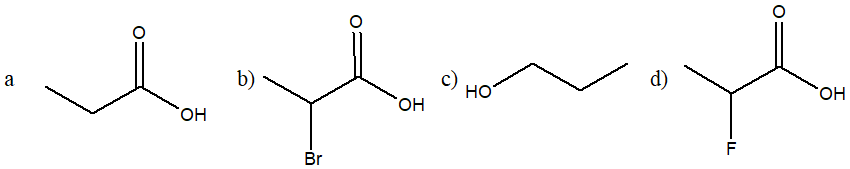
15) Metti i seguenti composti in ordine di acidità crescente e motiva la scelta

16) Cerchiare l’acido più debole e motivare sinteticamente la scelta.

17) Ordina i seguenti composti per acidità crescente e motivare la scelta
18) Dire chi è più basico nelle seguenti coppie di composti, motivando la scelta:
a) NH3 e NaNH2
b) ![]()
19) Metti i seguenti composti in ordine di basicità crescente (NB: a lezione non abbiamo ancora visto un esempio di questo tipo, ma provate a ragionarci…ne discuteremo a lezione).

20) Cerchiare la base più forte e motivare sinteticamente la scelta.

Soluzioni: https://www.dropbox.com/scl/fi/caz2pa5zdjnq865m9k89u/Acidi-e-basi-soluzioni.pdf?rlkey=vho5tlis9pv66pafe1i73sd1y&st=fb0i8cr6&dl=0
In caso di dubbi, contattare la docente
LikeLike