SVOLGIMENTO PROVA SCRITTA DEL 13 SETTEMBRE

1. Scrivere ciascuno dei seguenti composti secondo la proiezione di Fischer ed assegnare a ciascuno centro chirale la configurazione, secondo la notazione R,S. (2 pt)

2. Individuare la relazione stereochimica esistente tra i seguenti composti (1 pt):

diastereoisomeri
3. Assegnare il nome IUPAC ai seguenti composti. (3 pt)

acido (4S)-4-etil-8-(N-metilacetammido)-6-ossoottanoico
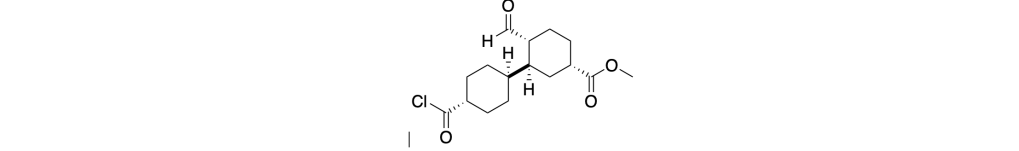
(1S,3S,4R)-3-((trans)-4-(clorocarbonil)cicloesil)-4-formilcicloesancarbossilato di metile
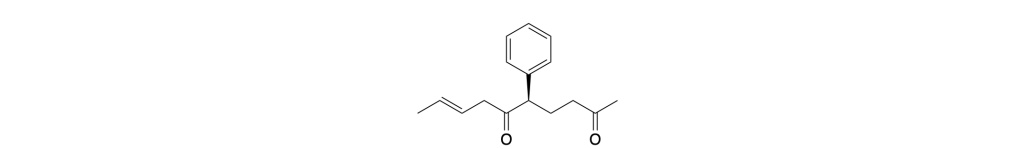
(5R,8E)-5-fenildec-8-ene-2,6-dione
4. Proporre un meccanismo per la seguente trasformazione. (6 pt)

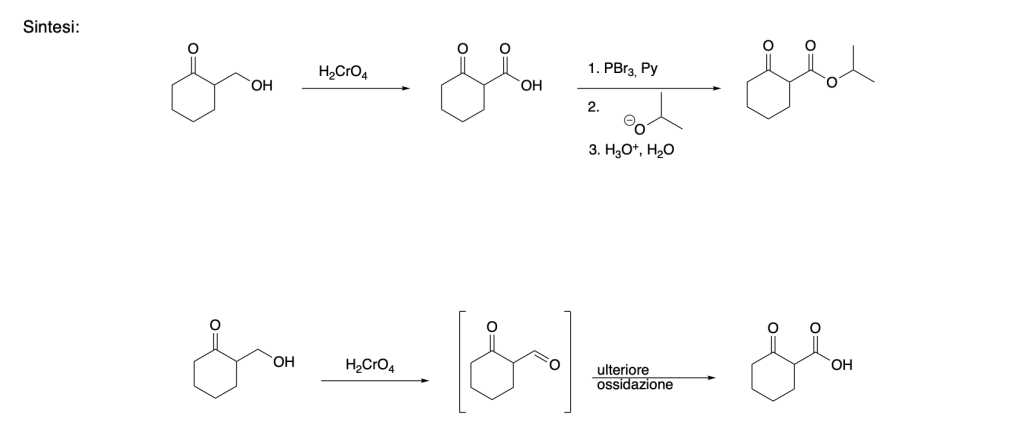
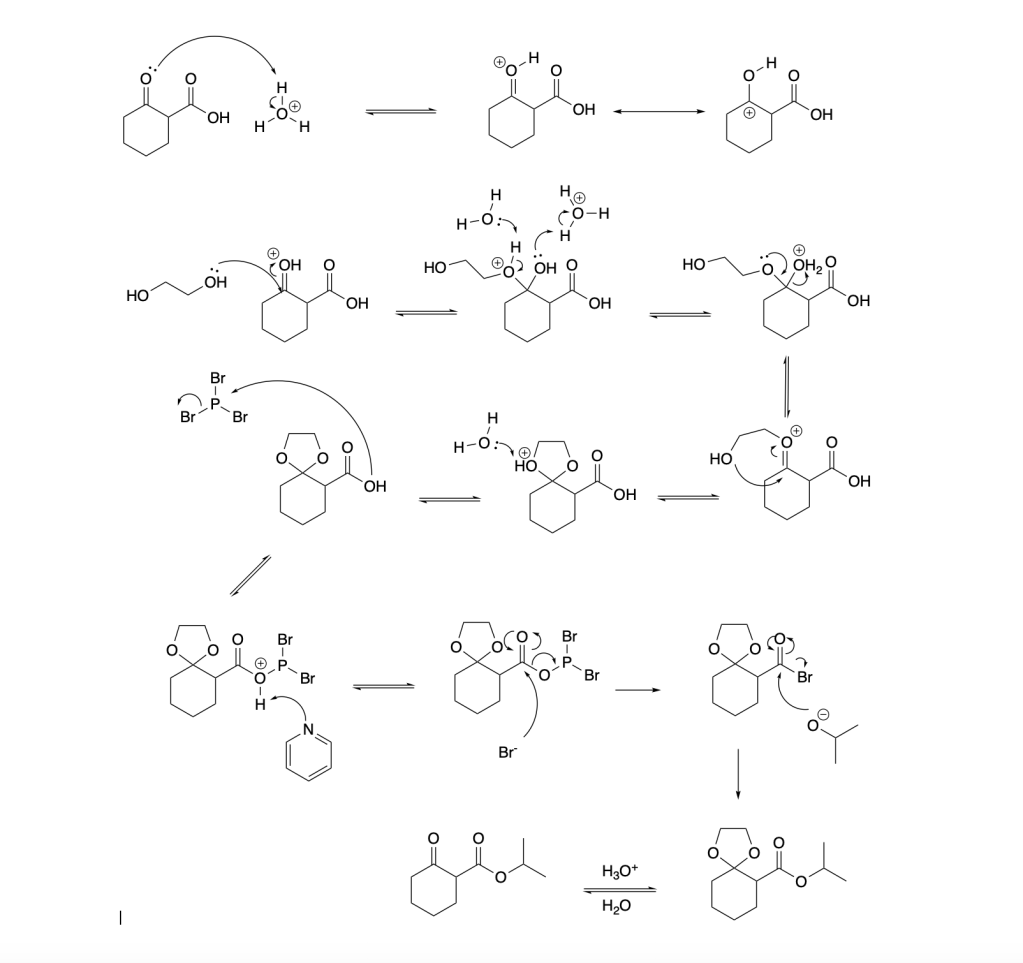
5. Indicare sulle frecce i reagenti organici e inorganici necessari per le seguenti trasformazioni. (8 pt)

6. Disegnare un diagramma per una reazione che avviene con i seguenti criteri:
- Reazione esoergonica a tre stadi
- Il primo stadio è lo stadio cinetico
- Il secondo intermedio è più stabile del primo
- Il terzo stadio è più veloce della reazione inversa del secondo stadio
Indicare nel grafico reagenti (R) e prodotti (P), i tre stati di transizione (ST1, ST2, ST3) i due intermedi (I1 e I2); illustrare, inoltre il DG° dell’intera reazione e i DG‡ dei tre stadi. (2 pt).

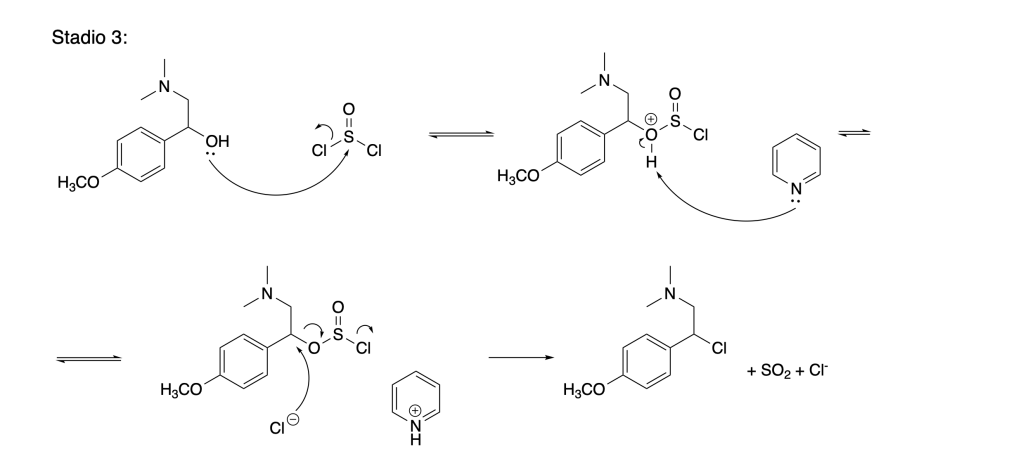
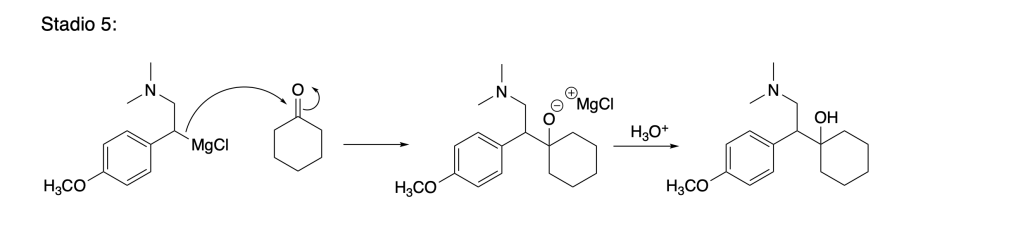
7. Proporre una sintesi per la venlafaxina a partire dal 2-cloro-4-metossifeniletanone, dalla dietilammina, dal cicloesanone e qualsiasi altro reagente necessario. (8 pt)

Proporre i reagenti degli stadi 2,3 e 4 e indicare il tipo di reazione che avviene in ogni stadio 1-5.
- Sostituzione Nucleofila SN2
- Riduzione del gruppo carbonilico
- Conversione di un alcol in un cloruro alchilico
- Preparazione del Reattivo di Grignard
- Addizione nucleofila
Mostrare il meccanismo di reazione per gli stadi 3 e 5 .
Gentile professore, nell’esercizio 5 lettera D il CN non attaccherebbe il carbonile? Abbiamo studiato che le addizioni 1,4 sono prodotte da nucleoli ingombrati storicamente, mentre le add 1,2 da nucleofili piccoli come CN.
LikeLike
In genere non rispondo a chi non mostra il proprio nome, ma voglio sottolineare che “avete” studiato male. Se “abbiamo” si riferisce al corso, le suggerisco di rivedere meglio gli appunti e il libro di testo. A lezione non si è mai parlato di ingombro sterico dei nucleofili nelle addizioni dirette o coniugate ma di nucleofili hard e soft che dipende dalla loro polarizzazione… le consiglio di studiare meglio l’argomento.
LikeLike
Gentile prof, nell’esercizio numero 4 l’alcol in ambiente acido attaccherebbe anche il gruppo chetonico con formazione dell’acetale, essendo lo stesso in eccesso. Bisognerebbe proteggere il chetone con un protettore. Tuttavia l’idrolisi acida per rimuovere il gruppo protettore scinderebbe anche l’estere. Come ci si comporta inala caso??
LikeLike
Guardi lo svolgimento. per evitare reazioni collaterali, meglio procedere come indicato
LikeLike