ORGANIC CHEMISTRY CHALLENGE – CDS FARMACIA

Regolamento:
- Vincerà la sfida (2 punti di bonus sulla terza prova intercorso) chi risponderà per primo CORRETTAMENTE al quesito
- La risposta va inserita nei commenti al post.
- Ognuno può rispondere solo una volta (anche in presenza di più di un commento pubblicato dalla stessa persona, soltanto il primo sarà preso in considerazione).
- Il tempo massimo a disposizione sarà di 12 ore dalla pubblicazione del post.
- L’eventuale vincitore sarà annunciato a lezione.
CHALLENGE
Quando si mette il (3E)-4-ciclobutilpent-3-en-1-olo in ambiente acido tra i prodotti si ottiene il 6-metil-1-ossaspiro[4.4]nonano.
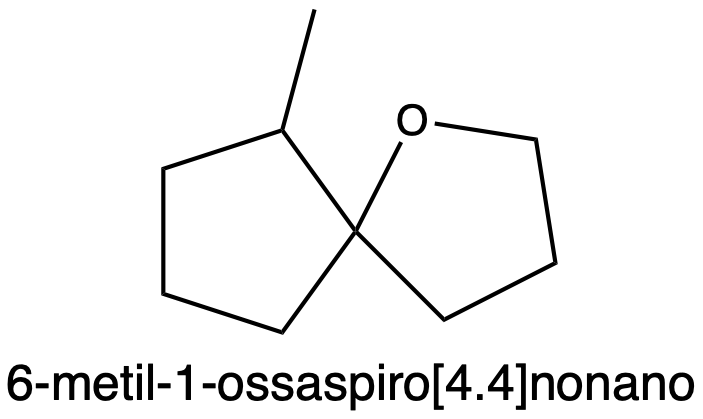
Descrivere nei dettagli il meccanismo che giustifica la formazione di questo prodotto indicando anche il numero di stereoisomeri che si ottengono

soluzione:
Parliamo di un’addizione di alcol agli alcheni, essa richiede l’utilizzo di un catalizzatore acido H2SO4 e darà come prodotto della reazione l’etere in questione. Dalla reazione di CH3OH con H2SO4 ottengo CH3OH2+ che essendo elettrofila attrae il doppio legame del reagente in questione, il doppio legame di spezza e si forma il carbocatione sul carbonio terziario mentre H+ si lega al C con più atomi di Idrogeno, il carbocatione però pur essendo terziario è instabile per la presenza del ciclo butano e quindi viene trasposta la carica sul carbonio successivo del ciclo estendendolo da 4 a 5 atomi di C. A questo punto il carbocatione sara secondario quindi avviene una trasposizione dello ione metilico dove vi era il carbocatione e quest’ultimo si sposta dove vi è il carbonio terziario da cui prima si è spostato lo ione. Ora che il carbocatione è terziario gli elettroni dell’ossigeno di CH3OH sono attratti dal carbocatione e si legano, sull’O si crea una carica positiva ,gli elettroni dell’O sulla catena principale verranno attratti dall’H legato all’O con carica + , si legano e si perde H2O. Avremo quindi un carbocatione sulla catena principale che ha perso OH che attirerà gli elettroni presenti sull’ossigeno che lega CH3 e il ciclo, si legano O e C+ formando un’altro ciclo furanosico ( 4C e 1 O) ma nuovamente l’O ha carica positiva perciò lo ione metilico legato si stacca e si lega all’acqua precedentemente formatasi, riformando quindi il catalizzatore usato e l’etere.
LikeLike
4 stereoisomeri*
LikeLike
Facciamo reagire con H2O e con catalizzatore H3O+:
reazione= il doppio legame prende il protone da H3O+–>il protone si attacca al C con più h e la carica positiva sta sul C che lega il ciclo( è un carbocatione terziario ma è instabile a causa del ciclo quindi trasponiamo un legame del ciclo e la carica positiva si sposta sul c1 del ciclo, non basta perchè ora ho un carbocatione secondario e trasponiamo il CH3 sul c1 del ciclo e la carica positiva ritorna sul c di partenza) .
Facciamo reagire con H2O–>il doppietto dell’ossigeno prende il protone del gruppo OH e si riforma il catalizzatore e sull’ossigeno ho una carica negativa che viene attratta dalla carica positiva del c . Si attacca formando un secondo ciclo(si preferisce sempre chiudere un ciclo ).
Stereoisomeri:4(c*formatdurante la reazione,ciclo)
LikeLike
Si tratta di addizione di un alcol ad un alchene, c’è bisogno di un catalizzatore acido H2SO4. Dalla reazione di CH3OH con H2SO4 si ottiene CH3OH2+ che è un elettrofilo (povero di elettroni) attrae il doppio legame dell’anchene (ricco di elettroni), il legame pi-greco si rompe (processo abbastanza lento) e si forma un carbocatione terziario in quanto per la regola di Markonicov il protone, H+ ,si lega al C che è legato a più atomi di H. il carbocatione però pur essendo terziario è instabile a causa della presenza del ciclo butano, un ciclo a 4 termini, avviene quindi una trasposizione: viene trasposta la carica presente sul carbonio successivo del ciclo, ottenendo così in estensione da un ciclo a 4 termini a un ciclo a 5 termini ( più stabile a causa della tensione angolare). Avremo un carbocatione secondario, instabile, si vede se se ne può ottenere uno più stabile, avviene allora la trasposizione dello ione metiluro (shift 1,2-metiluro) da dove vi era il carbocatione al carbonio adiacente , formando così un carbocatione terziario ( più stabile). la trasposizione è talmente veloce che il metanolo in soluzione non riesce ad avvicinarsi al carbocatione secondario, e quindi solo una volta che si forma il carbocatione terziario gli elettroni dell’ossigeno di CH3OH , che è ancora in soluzione ,sono attratti dal carbocatione si forma il legame (il metanolo si lega tramite l’O più la sua coppia solitaria al carbocatione) .Sull’ossigeno si ha carica positiva , allora gli elettroni presenti sull’ossigeno della catena principale che si è formata attrarranno l’H legato all’Ossigeno che ha carica positiva, e legandosi si avrà la perdita di H2O. Abbiamo così un carbocatione sulla catena principale che ha perso un OH che attirerà gli elettroni presenti sull’ossigeno che lega CH3 (metanolo) e il ciclo, si legano l’ossigeno e il carbocatione formando un ciclo furanosico ( 4 atomi di carbonio e 1 ossigeno ) ma di nuovo l’O ha carica positiva quindi lo ione metiluro viene attratto e si stacca legandosi all’acqua che si era formata ,riformando quindi il catalizzatore usato( in quanto durante una reazione il catalizzatore non viene consumato ma lo troviamo inalterato alla fine della reazione) e l’etere in questione. Dal 6-metil-1-ossaspiro[4.4]nonano otteniamo 4 stereoisomeri (2 carboni chirali , per la regola 2alla2 =4).
LikeLike
si tratta di addizione di un alcol ad un alcheni, c’è bisogno di un catalizzatore acido H2SO4. dalla reazione di C3 OH con H2S o quattro si ottiene CH3OH2+ che è un elettrofilo ( povero di elettroni) attrae il doppio legame dell’alchene ( ricco di elettroni), il legame pi-greco, si rompe (processo abbastanza lento) e si forma un carbocatione terziario in un quanto per la regola di Markonicov il protone , H+, si lega al carbonio che è legato a più atomi di H. Il carbocatione però pur essendo terziario è instabile a causa della presenza del ciclobutano, un ciclo a 4 termini, avviene quindi una trasposizione :viene trasposta la carica presente sul carbonio successivo del ciclo, ottenendo così un estensione da un ciclo a 4 termini a un ciclo a 5 termini ( a causa della tensione angolare). avremo un carbocatione secondario instabile , si vede se se ne può ottenere uno più stabile, avviene allora la trasposizione dello ione metiluro( shift 1,2-metiluro) da dove vi era il carbocatione al carbonio adiacente , formando così un carbocatione terziario ( più stabile) la trasposizione è talmente veloce che il metanolo in soluzione non riesce ad avvicinarsi al carbocatione secondario e quindi solo una volta che si forma il carbocatione terziario gli elettroni dell’oO di CH2OH che è ancora in soluzione sono attratti dal carbocatione, si forma così il legame (il metanolo si lega tramite l’O più la sua coppia solitaria al carbocatione). sull’ossigeno si ha carica positiva, allora gli elettroni presenti sull’ossigeno della catena principale che si è formata attrarranno l’H legato all’ossigeno che ha carica positiva e legandosi si avrà la perdita di H2O. Abbiamo così un carbocatione sulla catena principale che ha perso un OH che attirerà glie elettroni presenti sull’ossigeno che lega CH3 ( metanolo) e il ciclo, si legano l’ossigeno e il carbocatione formando un ciclo furanosico (4 atomi di carbonio e 1 ossigeno). ma di nuovo l’O ha carica positiva quindi lo ione metiluro viene attratto e si stacca legandosi all’H2O che si era formata , riformando quindi il catalizzatore usato ( durante una reazione il catalizzatore non viene consumato ma lo troviamo inalterato alla fine della reazione) e l’etere in questione . dal 6-metil-1-ossapiro[4.4.]nonano otteniamo 4 stereoisomeri ( 2 carboni chirali ,per la regola 2 alla 2 =4)
LikeLike
per avere questo prodotto dobbiamo far reagire il nostro alchene con l’acqua, nel seguente modo:
1. disegniamo l’alchene con configurazione E + H3O+ (che deriva dalla dissociazione dell’acqua in ambiente acido, dato da un catalizzatore come H2SO4)
2. Il legame pigreco del doppio legame rappresenta il centro di reazione, perchè è nucleofilo –> disegniamo una freccia di reazione che parte dal doppio legame ed arriva ad un H del H3O+, quest’ultimo rompe immediatamente il legame con H3O+ (perchè non è bivalente, l’H intendo)
3. dove aggiungiamo l’H? secondo la regola di markovnikov, va legato al carbonio che lega più H, quindi lo leghiamo al carbonio 3 della catena principale –> si crea una carica positiva sul carbonio 4 e di conseguenza un carbocatione terziario
4. per quanto un carbocatione terziario possa essere stabile, quest’ultimo lega un ciclobutil ed un ciclobutil non è stabile a causa della tensione dell’anello –> abbiamo un’espansione di anello
5. ora la carica positiva si trova sul carbonio 2 del ciclopentil, otteniamo quindi un carbocatione II
6. dato che dobbiamo raggiungere il livello di stabilità massimo, vediamo che possiamo fare la trasposizione del gruppo CH3 – (questo trattino è un legame), legato al carbonio 4 della catena principale, che legherà ora il carbonio 2 del ciclopentil –> si sposta la carica positiva sul carbonio 4 della catena principale ed otteniamo un carbocatione terziario –> ecco il primo intermedio di reazione
7. questo intermedio reagisce nuovamente con H2O, in particolare avremo una freccia che parte dall’ossigeno dell’acqua ed arriva al carbonio con carica positiva
8. il carbonio 4 della catena principale legherà ora l’acqua –> l’ossigeno forma tre legami –> ha carica positiva –> ecco il secondo intermedio di reazione
9. il secondo intermedio di reazione reagisce nuovamente con l’acqua, in questo caso però l’ossigeno dell’acqua è interessato al protone dell’acqua legata al carbonio 4 della catena principale
10. avremo un ciclopentil che in posizione 1 lega un OH e sempre in posizione 1 un CH2CH2CH2OH e in posizione 2 un CH3, cosa succede? i due gruppi OH interagiscono ed eliminano una molecola d’acqua –> si forma il 6 – metil – 1 – ossaspiro(4,4)nonano
LikeLike
il 6-metil-1-ossaspiro[4.4]nonano si può ottenere facendo reagire il (3E)-4-ciclobutilpent-3-en-1-olo con un alcol richiedendo l’intervento di un catalizzatore acido in tracce(es.H2SO4) che vada a fornirmi un protone che funga da elettrofilo( l’H dell alcol non è abbastanza acido per reagire ed inoltre si formerebbe un intermedio carico negativamente che non possiamo avere in ambiente acido).
Ovviamente non è H2SO4 che reagisce ma lo ione idronio.
Il protone( un elettrofilo) si addiziona al C sp2 dell’alchene(nucleofilo) che lega il maggior numero di H (regola di markovnikov ) e quindi al C3. Si forma un intermedio carbocationico con carica positiva su un C terziario. A causa della presenza di un ciclo a 4 termini (elevata tensione angolare) questo carbocatione è instabile. Avremo quindi una trasposizione con espansione dell’anello( da 4 a 5 termini, più stabile dal punto di vista energetico). A questo punto avremo una carica positiva sul c1 del ciclo e quindi un carbocatione secondario (perché perde gli elettroni che prima erano impegnati nel legame).
trasponendo un metiluro dal carbonio che inizialmente era il carbocatione al c adiacente(carbocat. secondario), possiamo formare un carbocatione terziario( ancora più stabile).
A questo punto ci sono 2 nucleofili che possono addizionarsi al carbocatione: l’OH della catena principale e il CH3OH presente in soluzione.
Il gruppo OH è legato al carbocatione e a differenza di CH3OH non deve diffondere attraverso il solvente. Inoltre facendo reagire l’OH si forma un composto ciclico a 5 termini e quindi abbastanza stabile e pertanto l’OH(nucleofilo) è più incline a reagire col carbocatione(elettrofilo),addizionandosi. A questo punto avremo un etere ciclico protonato a cui viene strappato un protone da CH3OH(che funge da base ) andando a riformare il catalizzare acido di partenza( il catalizzatore partecipa alla reazione rendendola più veloce e quindi diminuendo l’energia libera di attivazione ma non viene né consumato né modificato durante la reazione).
Si ottengono come prodotti della reazione 4 stereoisomeri in quanto si sono formati due NUOVI centri asimmetrici. (reagente di partenza privo di centri chirali).
Si formano 4 stereoisomeri perché la reazione passa attraverso la formazione di un intermedio carbocationico quindi nel primo stadio della reazione il protone si può avvicinare sia dalla parte superiore che da quella inferiore per formare il carbocatione. Una volta formato l’intermedio carbocationico anche il nucleofilo può avvicinarsi al C carico positivamente da sotto o da sopra.
LikeLike