Alleniamoci per la seconda prova intercorso

1. Scegliere tra le seguenti opzioni quella che riporta i composti nel corretto ordine di punto di ebollizione crescente

2. Quale dei seguenti composti è meno solubile in acqua?
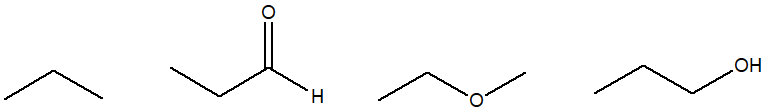
3. Spiegare perchè il neopentano ha un punto di ebollizione più basso rispetto al pentano.
4. Disegna un diagramma di energia potenziale per la rotazione di 360° del legame C2-C3 del pentano, partendo dal conformero meno stabile e disegnando le conformazioni corrispondenti ai massimi e ai minimi di energia.
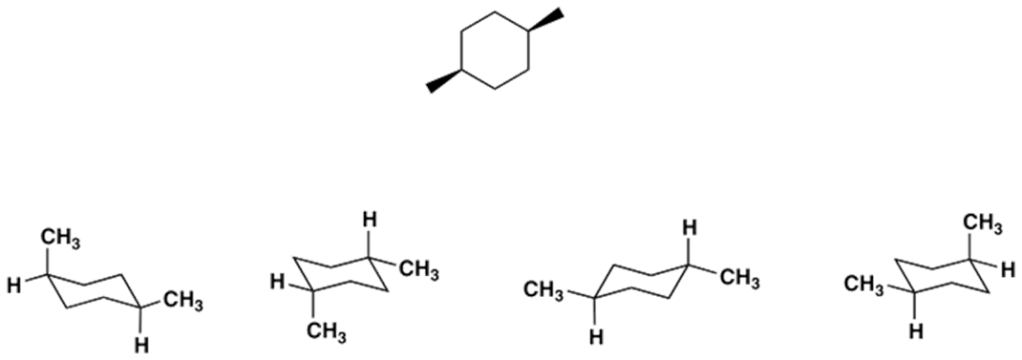
5. Quale sarà più stabile tra l’isomero cis e l’isomero trans del 1-isobutil-4-metilcicloesano. Perchè? Utilizzare le proiezioni di Newman per mostrarlo.
6. Disegnare il conformero a minore energia del trans-1-terz-butil-4-metilcicloesano e del cis-1-terz-butil-4-metilcicloesano. Poi, confrontare tra loro i due isomeri geometrici. Quale dei due sarà quello più stabile? Perché?
7. Disegnare la proiezione di Newman secondo il legame C2-C3 del conformero meno stabile del 2,4- dimetilesano
8. Dare una definizione sintetica (massimo 20 parole per ciascuna definizione) di: a) tensione torsionale; b) tensione sterica; c) tensione angolare; d) iperconiugazione; e) interazioni 1,3-diassiali.
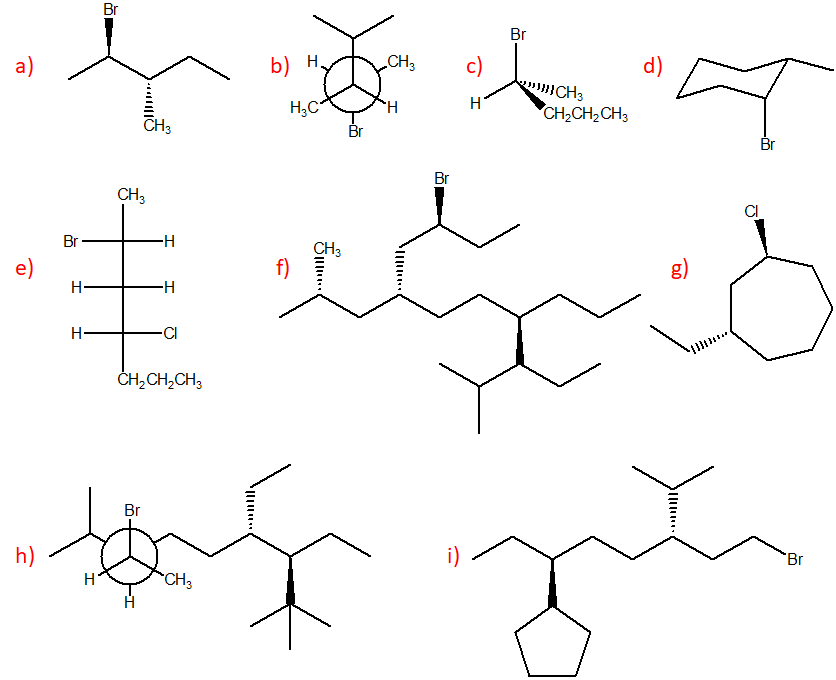
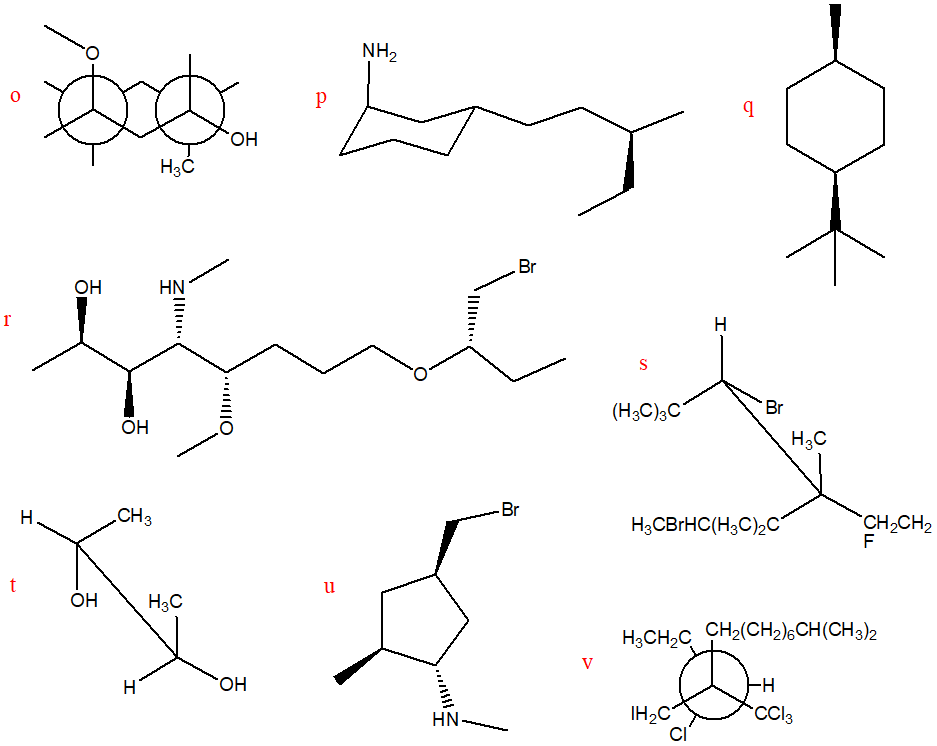
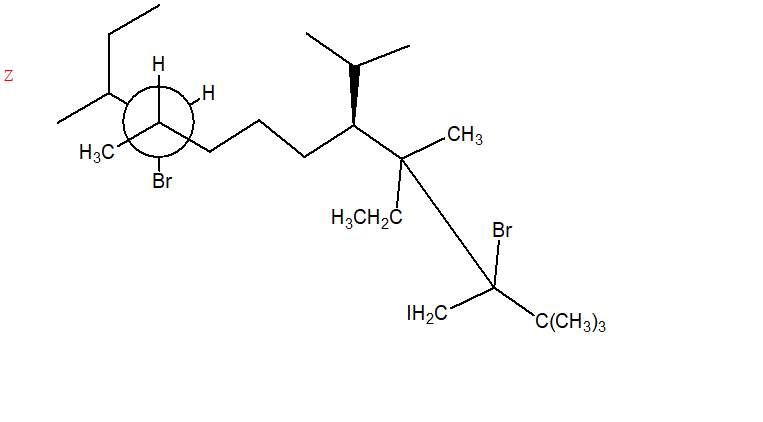
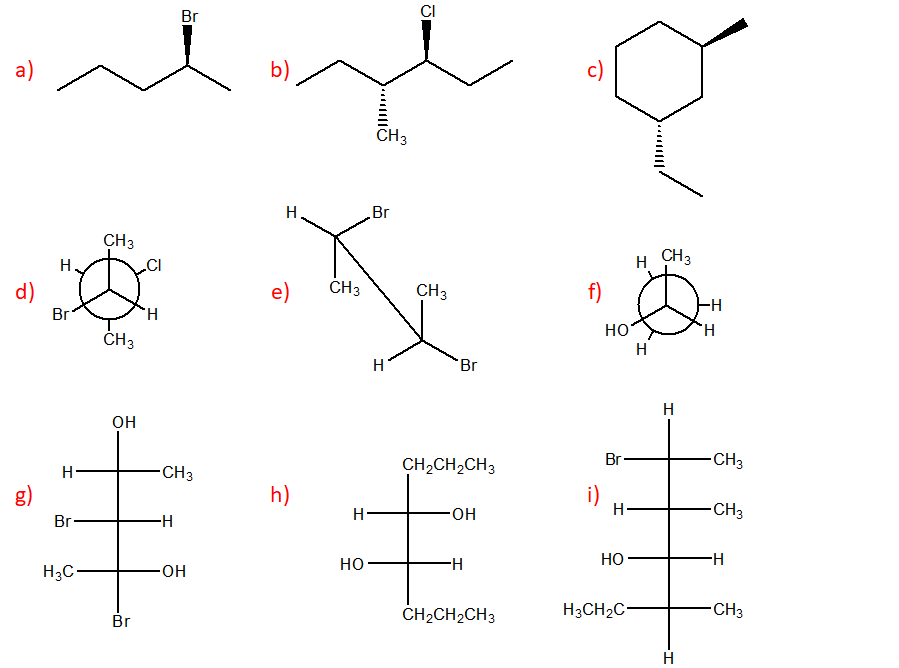
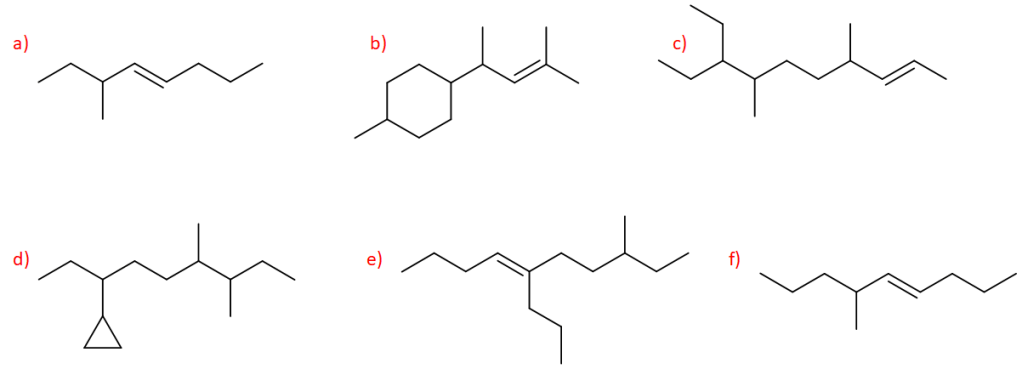
9. Assegnare il nome IUPAC, comprensivo di stereochimica quando necessario, ai seguenti composti:

10. Disegnare il composto di formula molecolare C5H9Br che contenga 2 carboni chirali. Disegnare e attribuire il nome IUPAC a tutti i possibili stereoisomeri.
11. Disegna l’enantiomero di ciascuno dei seguenti composti:
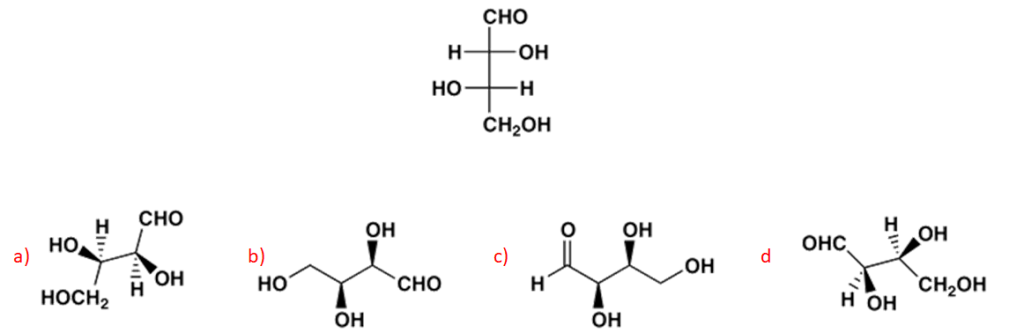
12. Qual è il numero massimo di stereoisomeri per i seguenti composti:
Per i composti che contengono doppi legami, dire se si tratta dell’isomero E o Z.
13. Qual è il numero massimo di stereoisomeri per il seguente composto?

14. Individuare tra le strutture riportate sotto quella che rappresenta l’enantiomero del seguente composto:
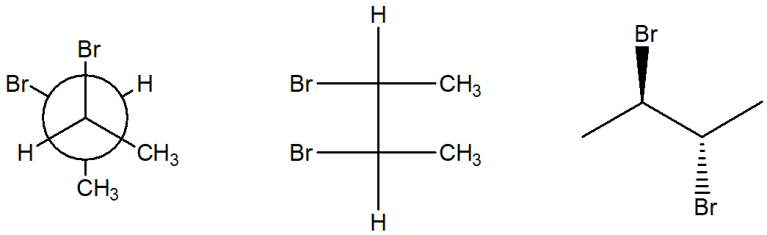
15. Individuare tra le strutture riportate sotto (a-c) quella che corrisponde alla seguente:

16. Attribuire la configurazione assoluta a tutti i carboni chirali e individuare la relazione stereochimica esistente tra le seguenti strutture:
A)
B)

C)

D)

E)
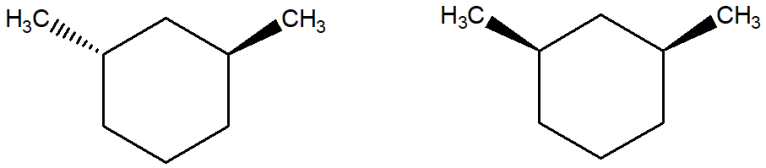
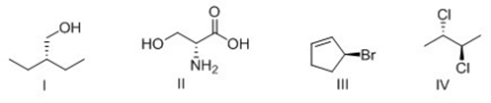
17. Dire se le seguenti molecole sono chirali:

18. Quale dei seguenti è un composto meso?
a) (2R,3S)-diclorobutano
b) (2R,3R)-diclorobutano
c) (2R,3S)-3-cloro-2-butanolo
d) (2R,3R)-3-cloro-2-butanolo
19. Quale dei seguenti composti non è chirale?
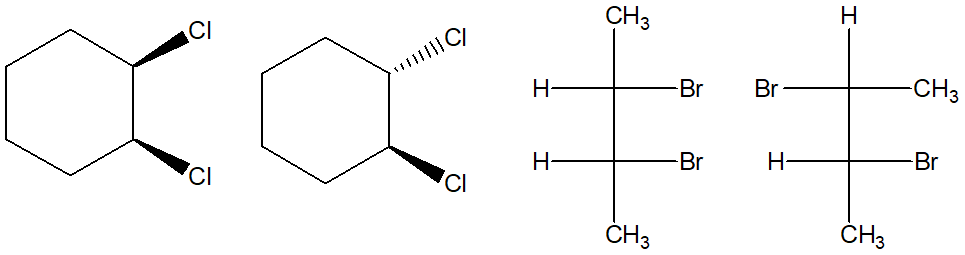
20. Scrivete le formule di struttura dei seguenti composti:
a) una molecola ciclica, isomero costituzionale del cicloesano
b) molecole di formula C6H12 che contengano un anello ed esistano come coppia di enantiomeri
c) molecole di formula C6H12 che contengano un anello e siano diastereoisomere tra loro
21. Scrivere le formule di struttura di tutti gli stereoisomeri e di tutti i conformeri corrispondenti a ciascuno dei seguenti nomi. Indicate le coppie di enantiomeri e i composti achirali eventuali:
a) 1-bromo-2-clorocicloesano
b) 1-bromo-3-clorocicloesano
c) 1-bromo-4-clorocicloesano
Attribuire la configurazione R,S a ciascuno dei composti indicati nelle risposte
22. Il (2R,3R)-2,3-butandiolo ha una rotazione ottica specifica di -13,2° e una temperatura di ebollizione di 77,3° C. Quale delle seguenti affermazioni è falsa?
A) Il (2R,3R)-2,3-butandiolo è un enantiomero treo
B) Il (2S,3R)-2,3-butandiolo è un composto meso
C) Il (2S,3R)-2,3-butandiolo ruota il piano della luce polarizzata di +13,2°
D) Il (2R,3S)-2,3-butandiolo non ruota il piano della luce polarizzata
E) Il (2S,3S)-2,3-butandiolo ha una temperatura di ebollizione di 77.3°C
23. Dire quale dei seguenti composti ruota il piano della luce polarizzata
24. Dire qual è la relazione stereochimica esistente tra i seguenti composti (confrontare a/b; a/c; a/d; b/c; b/d; c/d).

25. Confrontare i seguenti composti e definirne le relazioni stereochimiche. In particolare, dire se sono enantiomeri, diastereoisomeri o isomeri conformazionali.
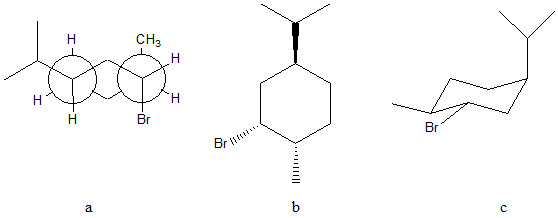
a e b sono___________________
a e c sono___________________
b e c sono___________________
26. Quale/i struttura/e è/sono diversa/e dalla seguente?
27.Scrivere, in proiezione di Fischer, formula prospettica e struttura a segmenti il (2S,3R)-2-bromo-3-metil-3-esanolo.
28. Scrivere la proiezione di Fischer del (2R,3R)-2-bromo-3-metilpentano. Poi scrivere la proiezione di Newman del conformero più e meno stabile lungo il legame C2-C3.
29. Quale delle seguenti strutture è la (2S,3R)-3-bromo-2-butanammina? (NB: è possibile scegliere più di una opzione):

30. Scrivere il (2R,3S)-3-bromopentan-2-olo (struttura a segmenti).
Questo composto sarà quello cui si farà riferimento in tutte le domande seguenti (se non indicato diversamente).
a) Scrivere un isomero di struttura che contenga comunque due carboni chirali e attribuirgli il nome IUPAC (sempre comprensivo di stereochimica
b) Scrivi un isomero costituzionale che non contenga carboni chirali.
c) Scrivi un composto costituito dallo stesso numero di atomi di C, Br e O, ma che sia caratterizzato da un grado di insaturazione e che non contenga carboni chirali.
d) Scrivi la proiezione di Fischer
e) Scrivi la proiezione di Newman del conformero più stabile in assoluto.
f) in che relazione stereochimica sono la struttura descritta in d e quella in e?
g) disegna un diagramma di energia potenziale per la rotazione di 360° del legame C2-C3, disegnando tutti i conformeri che corrispondono ai minimi e ai massimi di energia.
h) analizzare i singoli conformeri eclissati e valutare quali tipi di tensione contribuiscono a renderli meno stabili
i) quale fenomeno fa sì che i conformeri sfalsati siano a più bassa energia?
l) Scrivi l’enantiomero
m) Scrivi un diastereoisomero
n) Scrivi la struttura a cavalletto del conformero più stabile in assoluto per i composti scritti in l ed m
o) qualora conoscessi il potere ottico rotatorio specifico di h, potresti dire qualcosa circa il potere ottico rotatorio specifico del composto iniziale?
p) e qualora conoscessi il potere ottico rotatorio specifico di i?
q) immagina di aver sintetizzato il composto in laboratorio, di averne determinato la struttura, ma la misura del potere ottico rotatorio ti ha fornito un valore pari a 0 nonostante la presenza dei carboni chirali nella molecola. Cosa è possibile dedurre?
Dell’esercizio numero 17, mi trovo che la c ha due carboni chirali ,quindi tutta la molecola lo è ?
LikeLike
Come anche nel numero 19 , l ultimo è chirale ?
LikeLike
Credo che tu debba studiare meglio i composti meso. Se hai l’ultima versione del Bruice, molto utile è anche la strategia per la risoluzione dei problemi a pag. 171.
è ovvio che è essenziale studiare la teoria prima di provare ad applicarla facendo gli esercizi
LikeLike
No prof mi sono confusa , è meso la c del 17
LikeLike
Perchè non la c? Ti ripeto: devi rivedere BENE la teoria. Tra l’altro, sul libro, troverai proprio alcuni di questi composti…
LikeLike
Si prof è meso , quindi non è chirale ,giusto?
LikeLike
Come riportare le notazioni relative alla configurazione dei centri chirali quando il centro chirale cade in un sostituente ramificato? Come fare se c’è un carbonio chirale, ma il cuneo pieno (o tratteggiato) punta dal lato opposto a quello canonico? Due esempi da quest set di esercizi: https://www.dropbox.com/scl/fi/6jf43jogg7vivuuoqzc19/Nomenclatura.pdf?rlkey=o0hic8g0cbta8gprluuvlt8fc&dl=0
LikeLike
1) L’ordine di evoluzione crescente sarà:
Il pentano, in quanto presenta solo forze di London, l’etere, che presenta sia forze di London che interazioni dipolo-dipolo ed infine l’alcol.
2) Il meno solubile in acqua sarà il propano, perché presenta atomi di carbonio che saranno legati solo ad atomi di H, non ad atomi di O.
3) Il pentano ha una catena lineare a differenza del neopentano che presenta una catena ramificata.
Il neopentano ha il punto di ebollizione più basso perché avendo una struttura a catena ramificata, la lunghezza della catena stessa diminuisce, di conseguenza la superficie di contatto diminuisce a sua volta.
Questo comporta la diminuzione delle forze di London tra gli atomi, con una maggiore facilità di rompere i legami.
LikeLike
numero 9 lettera n è 8-(3-clorobutil)-5-isopropil-9-(3-metilcicloesil)-2-propil-1-dodecanolo
LikeLike
buonasera professoressa, il numero 25 quando faccio il confronto fra A e B risultano essere isomeri conformazionali poichè in A ho isopropile equatoriale verso l’alto, bromo assiale verso il basso e CH3 assiale verso l’alto mentre in B ho isopropile assiale verso l’alto, il Bromo equatoriale verso il basso e il CH3 equatoriale verso l’alto?? Oppure devo considerarli come lo stesso composto??
grazie mille.
LikeLike
scusatemi prof non volevo dire A e B ma A e C, ciò che ho detto per “B” è in realtà in riferimento a C
LikeLike