Esercizi su struttura elettronica e legami, acidi e basi

1) Scrivere la struttura di Lewis dello ione solfato. Attenzione: se è possibile avere più strutture di risonanza, scegliere una di quelle che contribuiscono di più all’ibrido di risonanza. Calcolare le cariche formali di ciascun atomo.
2) Completare la seguente struttura di Lewis e calcolare la carica formale per gli atomi di carbonio e ossigeno. Attenzione: se è possibile avere più strutture di risonanza, scegliere una di quelle che contribuiscono di più all’ibrido di risonanza
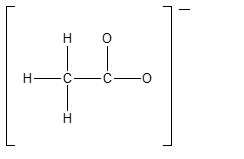
3) Completare la seguente struttura di Lewis e calcolare la carica formale per gli atomi di zolfo e ossigeno. Attenzione: se è possibile avere più strutture di risonanza, scegliere una di quelle che contribuiscono di più all’ibrido di risonanza.

4) Tra le strutture riportate in seguito, solo una rappresenta in maniera corretta il composto di formula molecolare C2H5OH. Individuare la struttura corretta e individuare gli errori presenti nelle altre.
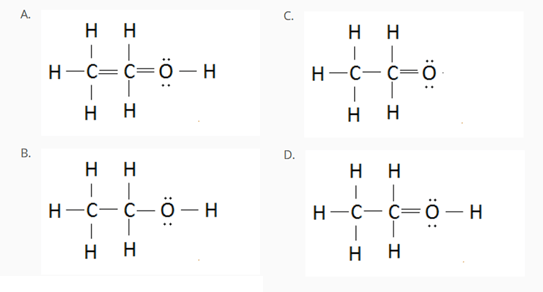
5) Disegnare la struttura di Lewis del composto di formula molecolare CH2Br2
6) Quali orbitali si formano per sovrapposizione assiale di 2 orbitali sp3 ? Quali orbitali sono invece coinvolti nella formazione di un legame pi-greco?
7) Quella qui riportata è la struttura della vitamina C

a) Individuare il legame singolo C-C più corto
b) dire quali orbitali molecolari danno luogo al doppio legame C=O e quali orbitali atomici/ibridi sono usati per formare tali orbitali molecolari
c) dire quanti atomi di idrogeno in tutto sono presenti nella molecola
e) individuare gli atomi di carbonio ibridati sp2
8) Identificare il tipo di orbitali (indicati dalle lettere a-g nell’immagine seguente); specificare anche se si tratta di orbitali atomici o molecolari.

9) La struttura di seguito riportata è quella della chinina. Osservare gli atomi e i legami indicati da lettere e numeri e completare le seguenti frasi o rispondere alle seguenti domande

I) La coppia solitaria dell’atomo di azoto a si trovano in un orbitale_______; quella dell’atomo di azoto b si trova in un orbitale_______
II) Osservare il legame indicato dalla c ed indicare il tipo di orbitale/i molecolare/i:
_____________________________________________________________________________________
III) Quali orbitali atomici ibridi si sovrappongono per formare il legame c?
_____________________________________________________________________________________
IV) Qual è il legame più corto tra quelli indicati dai numeri da 1 a 4?
____________________________________________________________________________________
10) Dire quali sono l’ibridazione, la geometria e l’angolo di legame del catione metile.
11) Proporre la struttura di una molecole che soddisfi i seguenti criteri: contiene 2 atomi di carbonio ibridati sp2 e 2 atomi di carbonio ibridati sp3. Dire quali sono la geometria e gli angoli di legame di ciascun carbonio.
12) La struttura di seguito riportata è quella della chinina, un composto antimalarico. Osservare gli atomi e i legami indicati da lettere e numeri e completare le seguenti frasi o rispondere alle seguenti domande

I) Le coppie solitarie dell’atomo di ossigeno a si trovano in orbitali_______; quella dell’atomo di azoto b si trova in un orbitale_______
II) Osservare il legame indicato dalla c e indicare il tipo di orbitale/i molecolare/i:
III) Quali orbitali atomici si sovrappongono per formare il legame c?
IV) Qual è il legame più corto tra quelli indicati dai numeri da 1 a 4?
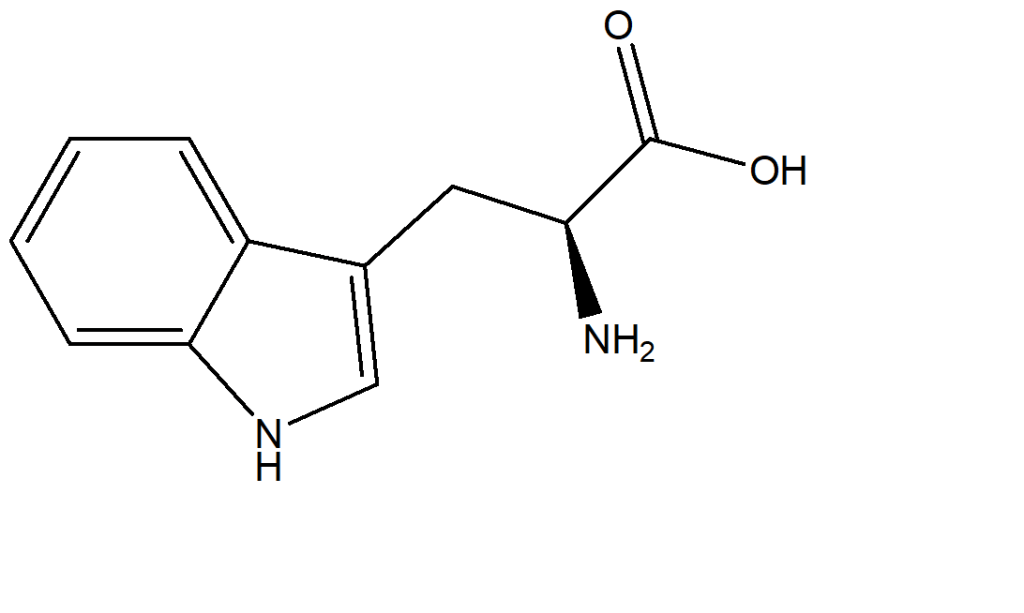
13) Quella di seguito riportata è la struttura dell’amminoacido triptofano. Dire come sono ibridati gli eteroatomi
14) Descrivi ibridazione, geometria e angolo di legame per gli atomi indicati da freccia nella seguente struttura:
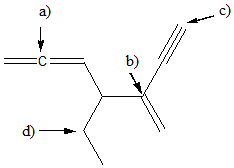
15) Nella seguente figura, alcuni dei legami sono indicati da freccia e da una lettera.

1) Etichettare i legami a-d come singoli, doppi o tripli;
2) indicare il tipo di orbitale/i molecolare/i;
3) dire quali orbitali atomici sono coinvolti nella formazione del legame.
4) Considerando tutti i legami singoli della molecola (ed escludendo i legami C-H) qual è il legame più corto?
16) Il composto mostrato in figura è il paclitaxel, un farmaco antitumorale. Indicare l’ibridazione dei carboni indicati dalle lettere A e B e dai numeri 1,2,3.

17) Cerchiare la/le molecola/e che ha/hanno momento dipolare nullo

18) Disporre i seguenti composti in ordine di basicità decrescente (dal più basico al meno basico) e spiegare sinteticamente il perché:

19) Mettere i seguenti composti in ordine di acidità crescente e motivare la scelta:
a) CH3CH2CH2SH b) CH3CH2CH2NH2 c) CH3CH2CH2OH d) CH3CH2CH2CH3
20) Rispondere ai seguenti quesiti:
a) A quale valore di pH la concentrazione della forma basica di un composto con pKa 5.2 è 100 volte maggiore rispetto alla forma acida?
b) A quale valore di pH il 50% di un composto con pKa 6.4 si troverà in soluzione nella forma basica?
21) Ordina i seguenti composti per acidità crescente e motivare la scelta
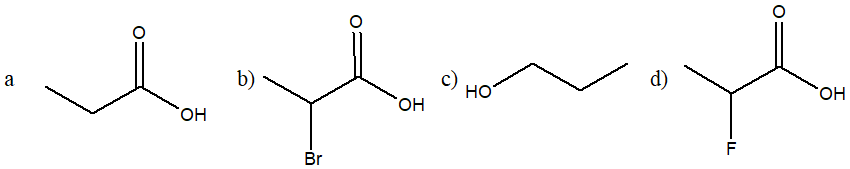
22) Dire chi è più basico nelle seguenti coppie di composti, motivando la scelta:
a) NH3 e NaNH2
b) ![]()
23) Per ciascuno dei seguenti composti, scrivi a) formula molecolare, b) struttura di Kekulè, c) una struttura condensata alternativa, quando possibile d) la struttura a segmenti

24) Disegna la struttura a segmenti per ciascuno dei seguenti composti

25) Scrivi una delle possibili strutture condensate per ciascuno dei seguenti composti

ERRATA CORRIGE: per ora, tralasciate l’esercizio 13 dato che, sulla base delle conoscenze attuali, non potete definire in modo corretto l’ibridazione di tutti gli eteroatomi
LikeLike