Orbitali atomici, orbitali molecolari, orbitali ibridi

- Quale delle seguenti affermazioni è falsa?
Un orbitale molecolare sigma:
a) può derivare dalla sovrapposizione laterale di due orbitali atomici p
b) può derivare dalla sovrapposizione assiale di due orbitali atomici p
c) può derivare dalla sovrapposizione di due orbitali atomici s
d) può derivare dalla sovrapposizione di un orbitale atomico s e un orbitale atomico p
e) può essere sia di legame sia di antilegame - Gli orbitali molecolari di antilegame sono prodotti da:
a) combinazione costruttiva (in fase) degli orbitali atomici
b) combinazione distruttiva (fuori fase) degli orbitali atomici
c) la sovrapposizione degli orbitali atomici di due ioni negativi
d) tutte le precedenti
e) nessuna delle precedenti - Quali orbitali ibridi si trovano nella molecola di acqua?
- Quanti elettroni spaiati sono presenti in un atomo di carbonio isolato (numero atomico = 6)?
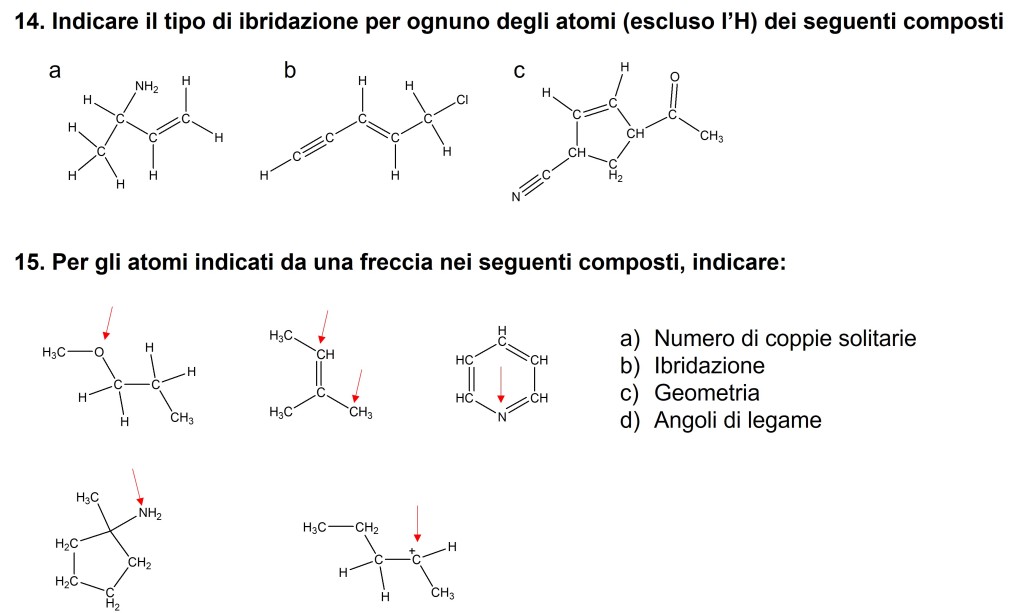
- Quali orbitali sono utilizzati per formare i legami covalenti nel butano (CH3CH2CH2CH3)?
- Quali sono gli orbitali atomici impegnati nella formazione dei legami sigma evidenziati nelle molecole seguenti (partendo da sinistra verso destra)?



7. Quanti legami σ carbonio-carbonio ci sono nella seguente molecola?

8. La molecola di acetonitrile CH3CN contiene (a)______ legami sigma e (b)______ legami pi-greco.
9. Quali sono la geometria, l’angolo di legame e l’ibridazione previste per +CH3? Quali orbitali si sovrappongono per formare i legami C-H del catione metile?
10. Il legame N-H nello ione ammonio NH4+ è formato dalla sovrapposizione di quali due orbitali?
11. Quali due orbitali atomici o orbitali ibridi si sovrappongono per formare il legame sigma carbonio-carbonio nell’etino?
12. Specie con un elettrone spaiato sono dette…
a) chirali
b) radicali
c) alogeni
d) carbocationi
e) carbanioni
13. Quanti elettroni ci sono nell’orbitale p del radicale metile?
1. D
2. B
3. Gli orbitali ibridi sp3
4. 2
5. Gli orbitali atomici ibridi sp3
6. A=sp2-sp2 B=sp-sp3 C=sp2-sp3 D=sp3-sp2
7. 6 legami sigma
8. A=5 B=2
9. Il catione metile è ibridato sp2, ha una geometria trigonale planare e l’angolo di legame è di 120°. Per formare il legame C-H si sovrappone l’orbitane atomico ibrido sp2 del carbonio con l’orbitale atomico S dell’idrogeno.
10. Il legame N-H deriva dalla sovrapposizione dell’orbitale atomico ibrido sp3 dell’azoto con l’orbitale atomico S dell’idrogeno.
11. Il legame C-C deriva dalla sovrapposizione dell’orbitale atomico ibrido sp di un carbonio con l’orbitale atomico ibrido sp dell’altro carbonio.
12. B
13. 1
14. A= sp3-sp3-sp3-sp2-sp2 B= sp-sp-sp2-sp2-sp3-sp3 C=sp-sp-sp3-sp2.sp2-sp3-sp3-sp2-sp2-sp3
15. 1. A) 4 B)sp3 C)Tetraedrica D)109.5°
2. A)0 B)sp2 C)Trigonale planare D)120°
3. A) 2 B)sp2 C)Trigonale planare D)120°
4. A) 2 B)sp3 C)Tetraedrica D)109.5°
5. A) 2? B)sp2 C)trigonale planare D)120°
LikeLike
1. Puoi spiegare perchè sostieni che l’affermazione falsa è la D?
5. Solo? e i legami C-H?
6. B) quale orbitale usa l’idrogeno?
7. Leggi bene la domanda: qui ti viene chiesto solo dei legami C-C
9/10 attenzione l’orbitale atomico si indica con la minuscola (s), inoltre, dobbiamo indicare anche se è 1s, 2s, ecc.
15. Ti consiglio di ricontrollare questo esercizio. Innanzitutto, gli atomi indicati da freccia sono 6. Poi, la domanda A ti chiede di indicare il numero di coppie solitarie (e non di elettroni che sono presenti come coppie solitarie). Inoltre, cosa succede quando degli orbitali sono occupati da coppie solitarie? Es.: quali sono la geometria e gli angoli di legame della molecola d’acqua? E dell’ammoniaca?
LikeLike
1. Sostengo che la D sia falsa perché un orbitale molecolare sigma deriva dalla sovrapposizione di due orbitali atomici s.
5. I legami C-H derivano dalla sovrapposizione dell’ orbitale atomico ibrido sp3 del carbonio con l’orbitale atomico s dell’idrogeno.
6. L’idrogeno usa l’orbitale s
7. 2 legami sigma
LikeLike
1. Se l’orbitale molecolare sigma fosse dato solo dalla sovrapposizione di orbitali atomici s, come spiegheresti la formazione del legame C-C nell’etano (CH3CH3)?
LikeLike
…o la formazione dei legami C-H nell’etano stesso? Quali orbitali sono coinvolti in questo caso nella formazione degli orbitali molecolari sigma?
L’orbitalr sigma può derivare dalla sovrapposizione assiale di diversi tipi di orbitali atomici e/o orbitali ibridi. Domani a lezione chiariremo ulteriormente questo concetto
LikeLike
1) A
2) B
3) sp3
4) 2 elettroni spaiati
5) Sono utilizzati i legami sp3. Si ha la sovrapposizione dell’orbitale sp3-s per il legame C-H.
6) a: sp2-sp2
b: sp-sp, sp-s
c: sp2-sp3
d:sp3-sp2
7) 2 legami sigma
8) 5 legami sigma e 2 pigreco
9) Trigonale planare, 120°, sp2. Si ha la sovrapposizione sp2-s.
10) Si ha la sovrapposizione sp3-s
11) Si ha la sovrapposizione sp-sp
12) B, i radicali.
13) 1 elettrone.
14)a- sp3, sp3, sp2, sp2, sp2
b- sp,sp, sp2, sp2, sp3, sp3
c- sp, sp, sp3, sp2, sp2, sp3, sp3, sp2, sp2, sp3
15) a- 2; sp3; tetraedrica; l’angolo di legame è minore di 109,5° perchè ci sono due coppie solitarie che occupano più spazio.
b- 0; sp2; trigonale planare; 120°.
b- 0; sp3; tetraedrica; 109,5°.
c-1; sp2; trigonale planare; l’angolo di legame è minore di 120° perchè c’è una coppia solitaria che occupa più spazio.
d- 1; sp3; tetraedrica; l’angolo di legame è minore di 109,5° perchè c’è una coppia solitaria che occupa più spazio.
e- 0; sp2; trigonale planare; l’angolo di legame è 120°.
LikeLike
14a) come è ibridato l’azoto?
15 a e d) qui la geometria non è tetraedrica. Ti ricordi la geometria della molecola di acqua e di quella dell’ammoniaca? In c, inoltre, l’N sta in un ciclo, ma approfondiremo successivamente questo argomento.
LikeLike
14) a- sp3, ho sbagliato a scrivere prima
15) a geometria angolare con due coppie solitarie
d geometria piramidale trigonale con 1 coppia solitaria
– Nell’acqua abbiamo una geometria angolare
-Nell’ammoniaca abbiamo una geometria piramidale trigonale
LikeLike
Es 1. A)
Es 2. B)
Es 3. nella molecola di acqua si trovano 4 orbitali ibridi di tipo sp3,l’O usa orbitali ibridi l’orbitale s e i tre orbitali p si combinano per dare i 4 orbitali sp3, l’O usa due orbitali sp3 che si sovrappongono all’orbitale s dell’H e i restanti due orbitali sp3 sono occupati da una coppia solitaria.
Es 4. 2 e- spaiati
Es 5. Orbitali sp3, il legame C-C si forma per sovrapposizione degli orbitali sp3 dei C, per i legame C-H si ha la sovrapposizione dell’orbitale sp3 dei C con orbitale s degli H
Es6.
A) sp2-sp2
B)sp-s
C) sp2-sp3
D) sp3-sp2
Es7. 2 legami sigma
Es8. 5 legami sigma 2 legami pigreco
Es9. +CH3 è ibridato sp2,geometria trigonale planare, 3 orbitali sp2 formeranno legami sigma con gli orbitali s dell’H,l’orbitale p non ibridato resta vuoto perpendicolare al piano.
Es 10.i legame N-H è dato dalla sovrapposizione degli orbitali sp3-s
Es 11. il legame sigma C-C nell’etino è dato dalla sovrapposizione degli orbitali sp-sp
Es 12. B) Radicali
Es13. 1 e-
Es 14.
A) sp3-sp3-sp3-sp2-sp2
B) sp-sp-sp2-sp2-sp3-sp3
C) sp- sp- sp3-sp2-sp2-sp3-sp- sp2-sp2- sp3
Es15.
A)2 coppie solitarie ibridazione sp3 geometria tetraedrica angolo di legame 104.5° perché sono presenti le coppie solitarie
B)0coppie solitarie ibridazione sp2 geometria trigonale planare angolo di legame 120°
B) 0 coppie solitarie, ibridazione sp3, angolo di legame 109.5° geometria tetraedrica
C)1 coppia solitaria ibridazione sp2, geometria trigonale planare, angolo di legame minore di 120° per la presenza della coppia solitaria,.
D1 coppia solitaria ibridazione sp3, geometria tetraedrica, l’angolo di legame è minore di 109,5° per la presenza della coppia solitaria
E) 0 coppie solitarie,ibridazione sp2 ,angolo di legame 120° geometria trigonale planare.
LikeLike
14 c) qual è l’atomo ibridato sp? Es. 15: vedi risposte a commenti precedenti
LikeLike
14 c) l’atomo di N e C che danno legame triplo sono ibridati sp
15 ok prof sono sbagliate i tipi di geometria
LikeLike
1.a
2.b
3.Gli orbitali ibridi sp3
4.2
5.Nel butano il legame covalente C-H deriva dalla sovrapposizione assiale di un orbitale ibrido sp3 dell’atomo di carbonio con l’orbitale 1s dell’atomo di idrogeno; il legame covalente C-C deriva dalla sovrapposizione assiale di un orbitale ibrido sp3 di un atomo di carbonio con l’orbitale ibrido sp3 dell’altro atomo di carbonio
6.a.sp2-sp2; b.sp-s; c.sp2-sp3; d.sp3-sp2
7.2
8.a.5;b.2
9. il carbonio carico positivamente è ibridato sp2; la geometria è trigonale planare; l’angolo di legame è di 120°. Il legame C-H deriva dalla sovrapposizione assiale di un orbitale ibrido sp2 del carbonio carico positivamente e di un orbitale atomico 1s dell’idrogeno
10. Il legame N-H deriva dalla sovrapposizione assiale di un orbitale ibrido sp3 dell’atomo di azoto e di un orbitale atomico 1s dell’idrogeno
11.sp-sp
12.b
13.1
14.a.Gli atomi di carbonio che formano legami singoli sono ibridati sp3; gli atomi di carbonio che formano doppi legami sono ibridati sp2; l’atomo di azoto è ibridato sp3
b.gli atomi di carbonio che formano legami singoli sono ibridati sp3; gli atomi di carbonio che formano doppi legami sono ibridati sp2; gli atomi di carbonio che formano tripli legami sono ibridati sp; il cloro è ibridato sp3;
c.gli atomi di carbonio che formano legami singoli sono ibridati sp3; gli atomi di carbonio che formano doppi legami sono ibridati sp2; gli atomi di carbonio che formano tripli legami sono ibridati sp; l’atomo di azoto è ibridato sp e l’atomo di ossigeno è ibridato sp2
15.1.L’atomo di ossigeno presenta 2 coppie solitarie; è ibridato sp3; la geometria è angolare; l’angolo di legame è di 104,5°
2.L’atomo di carbonio che forma legami singoli non presenta coppie solitarie, è ibridato sp3, ha una geometria tetraedrica, l’angolo di legame è di 109,5°; l’atomo di carbonio che forma un doppio legame non presenta coppie solitarie, è ibridato sp2, ha una geometria trigonale planare, l’angolo di legame è di 120°
3.L’atomo di azoto presenta una coppia solitaria di elettroni, è ibridato sp2, la geometria è trigonale planare, l’angolo di legame è di 120°
4.L’atomo di azoto presenta una coppia solitaria di elettroni, è ibridato sp3, la geometria è trigonale piramidale, l’angolo di legame è di 107,3°
5.L’atomo di carbonio carico positivamente non presenta coppie solitarie, è ibridato sp2, la geometria è trigonale planare, l’angolo di legame è di 120°
LikeLiked by 1 person
Professoressa mi scusi ma non riesco a capire come mai nell’esercizio 15, l’N dell’esercizio tre l’angolo è di 120 e planare, mentre l’N dell’esercizio 4 ci rifacciamo alla regola dell’ammoniaca. grazie
LikeLike
I due atomi di azoto sono ibridati rispettivamente sp2 ed sp3 (e quindi avranno geometria e angolo di legame diversi)
LikeLike
grazie.
LikeLike