Esercizi: Ibridazione del Carbonio e legami nei composti organici

“Scaldiamo i motori” in vista della Weekend Organic Chemistry Challenge!
NB: è possibile discutere degli esercizi nell’area commenti!
Università degli Studi della Campania "Luigi Vanvitelli"

“Scaldiamo i motori” in vista della Weekend Organic Chemistry Challenge!

NB: è possibile discutere degli esercizi nell’area commenti!
Attenzione: questi esercizi non sono quelli della Challenge! Servono a voi per esercitarvi. In questo caso, potete usare la sezione commenti per discutere tra voi o chiedere chiarimenti a me! Quelli della Challenge saranno strutturati in maniera tale da permettervi di inserire in maniera semplice le risposte nei commenti!
LikeLike
Inoltre, sia questi esercizi sia quelli del post precedente (https://chimicaorganicadistabif.com/2020/10/12/esercizi-di-ricapitolazione-su-atomi-e-legami/ ) saranno discussi a lezione
LikeLike
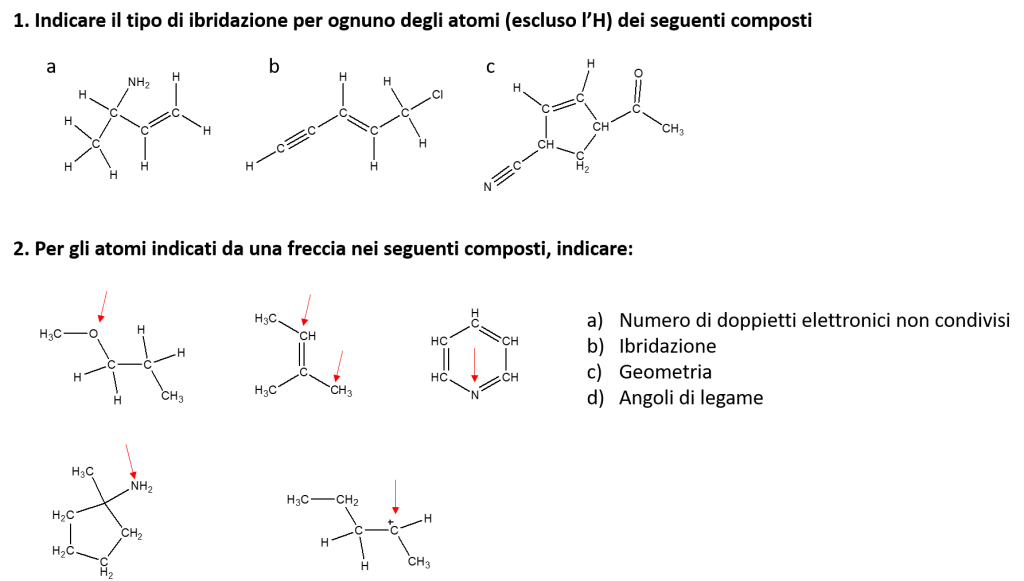
1ESERCIZIO:
a) sp3-sp3- sp3per i legami singoli (C-C C-NH2 C-C )e sp2 per il doppio legame (C=C)
B) sp per il triplo legame (C-C) ,sp3 per il legame semplice C-C, sp2 per il doppio legame (C=C) sp3 per i legami singoli successivi (C-C e C-Cl).
C) sp per il triplo legame( N-C) sp3 per i legami singoli (C-C) sp2 per il doppio legame (C=C) sp3 per i legami singoli (CH-CH2 e CH2-CH C-CH CH-C e C-CH3) e sp2 per il doppio legame ( C=O)
2 ESERCIZIO
1 molecola) 2 doppieti elettronici sp3 triangolo planare angoli 120 gradi
2 molecola) 0 doppietti elettronici liberi sp3 per CH3 e sp2 per (CH=C) e sp3 per (CH-CH3) CH con ha una geometria tetraedrica con angoli di 109 gradi e CH3 geometria triangolare planare con angoli di 120 gradi.
3 molecola ) 1 doppietto elettronico libero sp2 per (N=CH) e sp3 per (N-CH) la molecola HV-N=CH ha una geometria tetraedrica con angoli di 109 gradi.
4 molecola) 1 doppietto elettronico libero sp3 perché è presente un legame singolo (NH2-C) Forma tetraedrica con angoli di 109 gradi
5 molecola) O doppieti elettronici disponibili sp3 per ogni legame singolo di C Forma tetraedrica con angoli di 109 gradi.
LikeLike
Ciao Anna, non mi trovo con te la quarta e la quinta molecola del secondo esercizio, ti dico io come ho ragionato:
-4 molecola) la forma è tetraedrica, e su questo ci troviamo, ma poiché N presenta una coppia di elettroni di non legame c’è una maggiore repulsione e quindi, secondo me, l’angolo di legame diminuisce ed è pari a circa 107 gradi .
-5 molecola) poiché ci troviamo un carbocatione ho pensato si trattasse di un ibridazione sp2 con forma trigonale planare e quindi con angolo di legame pari a 120 gradi.
Cosa ne pensi?
LikeLike
Ciao Annarita
Per la 4 molecola avevo dimenticato la coppia di elettroni di non legame , quindi sono d’accordo con te sul valore dell’angolo di legame.
Riguardo alla 5 molecola sinceramente ero un po’ titubante e quindi potresti anche aver ragione, dovremmo confrontarci con qualcun’altro.
LikeLike
Annarita ciao, io ho fatto il tuo stesso ragionamento per la molecola numero 5; non so se sia effettivamente corretto.
LikeLike
ESERCIZIO 1
a) legami sp3: C-C / C-C / C-NH2
legami sp2: C=C
b) legami sp3: C-C / C-Cl
legami sp2: C=C
legami sp: C≡C
c) legami sp3: C-CH / C-CH / C-CH2 / C-CH /C-CH /C-CH3
legami sp2: C=O / C=C
legami sp: N≡C
ESERCIZIO 2
Mol.1) a)2 b)sp3 c) trigonale planare d) 120°
Mol.2) CH a) 0 b)sp2 (CH=C) c) tetraedrica d) 109°
CH3 a) 0 b) sp3 (CH-CH3) c) trigonale planare d) 120°
Mol.3) a)1 b) sp2 (N=CH) e sp3 (N-HC) c) tetraedrica d) 109°
Mol.4) a) 1 b) sp3 (NH2-C) c)tetraedrica d) 107°
Mol.5) a) 0 b) sp2 (carbocatione) c)trigonale planare d)120°
LikeLike
Bravi per aver rotto il ghiaccio e aver dato vita a questa discussione…
Però attenzione…attenzione!
Il primo esercizio vi chiede, non a caso, l’ibridazione degli ATOMI, anzi per essere più precisi dovremmo parlare di ibridazione DEGLI ORBITALI DEGLI ATOMI. Non abbiamo MAI parlato di legami sp3, sp2 o sp. Questi ultimi sono orbitali ibridi del carbonio (o di altri atomi i cui orbitali vanno incontro al processo di ibridazione).
Inoltre, fate attenzione ad utilizzare la terminologia corretta e siate precisi nelle risposte. Ad es.: l’angolo tetraedrico non è di 109°, ma 109.5°; nel caso di un carbonio ibridato sp2, gli orbitali si dispongono su un piano con angoli di 120° l’uno rispetto all’altro: parliamo in questo caso di geometria trigonale planare.
Nelle risposte date fino ad ora ci sono vari errori…vediamo se riuscite ad individuarli voi stessi o se qualcun altro dei vostri colleghi vuole intervenire…
LikeLike
ma l’ibridizzazione degli orbitali degli atomi è giusto scrivere sp, sp2 o sp3 non capisco perchè sia sbagliato
LikeLike
Leggi bene il commento (e i commenti precedenti) e capirai. Si parla nei commenti spesso erroneamente di “legami sp3” o sp2 o sp
LikeLike